汉族人群布加综合征患者膜性阻塞病因探讨
2016-06-05王进广乔晓春王利明
王进广,乔晓春,祁 冬,王利明
蚌埠市第一人民医院 1.消化内科; 2.医学影像科,安徽 蚌埠 233000
汉族人群布加综合征患者膜性阻塞病因探讨
王进广1,乔晓春2,祁 冬2,王利明1
蚌埠市第一人民医院 1.消化内科; 2.医学影像科,安徽 蚌埠 233000
目的 探讨汉族人群布加综合征患者膜性阻塞形成原因。方法 选取2012年4月-2013年12月在蚌埠市第一人民医院接受诊疗的布加综合征患者93例作为研究对象,所有患者均接受下腔静脉(inferior vena cava, IVC)、肝静脉(hepatic veins, HVs)计算机断层扫描造影(computerized tomographly angiography, CTA)检查, 评估血管病变情况。结果 IVC病变者39例(41.94%), HVs病变者23例(24.73%), 同时受累者31例(33.33%)。IVC病变最常见的类型为膜性阻塞(43.59%),HVs病变最常见的类型为非膜性阻塞(47.83%),HVs非膜性阻塞伴IVC膜性或非膜性阻塞也是较常见类型(分别为38.71%和41.94%)。单纯IVC病变和单纯HVs病变患者中各自相应类型之间首次发病时的年龄分布未见明显差异(P>0.05)。与非膜性阻塞相比, 在IVC受累(Ⅰ型和Ⅲ型)和HVs受累(Ⅱ型和Ⅲ型)患者中,膜性阻塞患者的首次发病年龄较小, 但差异无统计学意义(P>0.05)。通过年龄-类型分布图发现, 多数患者首次发病年龄为30~50岁, 且主要的类型为HVs或IVC膜性阻塞。随着年龄的增长(50~70岁), 膜性阻塞发生率迅速下降。结论 汉族人群布加综合征患者以IVC膜性阻塞多见,膜性阻塞与非膜性阻塞患者发病年龄之间差异无统计学意义。
布加综合征;膜性阻塞;非膜性阻塞;肝静脉;下腔静脉
布加综合征是一种少见病, 但在发展中国家发病率较高,如中国、印度、尼泊尔和南非[1-2]。在东方民族中,患者主要为下腔静脉(inferior vena cava, IVC)膜性阻塞;而在西方国家中, 肝静脉(hepatic veins, HVs)非膜性阻塞(主要为血栓形成)为主要病理类型[3-4]。长期以来,国内外众多学者对布加综合征的病因展开研究,但并未发现其根本的发病原因[5-6]。近年来,研究人员将研究重点转移到遗传学领域,以期对该病的发生做出合理的解释[7]。经过长期探索, 一些研究人员认为基因突变可能是该病的主要病因。在西方人群中,大多数布加综合征患者存在HVs血栓, 且往往伴有血栓形成倾向或高危因素,如凝血因子V基因G1691A Leiden突变(FLVM)、亚甲基四氢叶酸还原酶基因突变和JAK2 V617F突变[8-9]。研究人员推测, 最初, 这些高危人群早期形成HVs或IVC血栓, 随着疾病的进展,血栓逐渐机化,最终形成膜性物质,造成血流中断或阻塞, 最终发展成膜性阻塞型布加综合征[10]。简言之, 膜性阻塞的形成并不是原发性基因突变的结果。本研究旨在探讨汉族人群布加综合征患者膜性阻塞与非膜性阻塞之间的相关性,进而推测膜性阻塞型布加综合征的可能病因。
1 资料与方法
1.1 一般资料选取2012年4月-2013年12月在蚌埠市第一人民医院接受诊治的布加综合征患者93例作为研究对象, 男60例,女33例,年龄22~77岁,中位年龄48岁。患者通过病史资料、血液学检查、超声检查、放射学检查或血管造影确诊。
1.2 材料本研究中所采用的MissouriTM XD-2001 CT-注射器由德国Ulrich GmbH公司生产,所用血管造影剂碘海醇是一种水溶性对比造影剂,规格为100 ml∶35 g,由中国扬子江药业集团有限公司生产。
1.3 方法
1.3.1 CT扫描:本研究采用电子计算机断层扫描(computerized tomography angiography, CTA)血管三维成像技术评估HVs、IVC病变情况。每位患者在接受检查前均接受全面体格检查。检查前30 min行碘过敏试验, 检查前10 min肌注异丙嗪注射液25 mg预防检查过程中出现的消化道反应。检查开始前静脉推注地塞米松5 mg。采用MissouriTM XD-2001 CT-注射器向患者体内输注血管造影剂。首先需要计算血管造影剂碘海醇的用量,我们根据患者实际体质量, 以2 mg/kg计算, 最大用量不超过150 mg。
1.3.2 图像处理:所有患者的原始图像由1名具有5年以上工作经验的放射科技师处理, 处理后图像分别由2名具有10年以上工作经验的放射科医师双盲阅片, 二者阅片结果一致率达95.70%(89/93)。其余4例患者的图片经2名医师共同审阅后做出最终诊断。
1.3.3 布加综合征分型:采用张小明教授推荐的布加综合征分型方法将布加综合征分为3型6种亚型, 即Ⅰ型:单纯性IVC受累(Ⅰa型:膜性阻塞;Ⅰb型: 短段非膜性阻塞<5 cm;Ⅰc型: 长段非膜性阻塞>5 cm);Ⅱ型:单纯性HVs受累(Ⅱa型:膜性阻塞;Ⅱb型:非膜性阻塞);Ⅲ型:HVs与IVC同时受累。
2 结果
2.1 布加综合征类型分布所有患者中,单纯IVC受累(Ⅰ型)及HVs、IVC同时受累(Ⅲ型)者最常见(分别为41.94%和33.33%), 单纯HVs受累(Ⅱ型)者相对少见(24.73%)。在Ⅰ型患者中, 单纯膜性阻塞(I a型)阳性率达43.59%,非膜性阻塞(I b和I c型)占46.15%,4例患者同时存在两种类型病变。单纯HVs受累(Ⅱ型)的患者中,11例(47.83%)患者存在非膜性阻塞(Ⅱb型),是最常见的类型。此外, 膜性阻塞与非膜性阻塞同时存在也是此类患者中较常见的类型(30.43%)。在这类患者中,41.94%的患者被证实HVs与IVC均存在血栓。此外,IVC膜性阻塞伴HVs血栓形成(38.71%)也是常见的类型(见表1)。

表1 布加综合征类型分布
2.2 布加综合征患者不同亚型发病年龄分布(Ⅰ型和Ⅱ型)根据布加综合征病理类型, 我们将Ⅰ型和Ⅱ型重新分为三类,即单纯膜性阻塞(Ⅰa和Ⅱa)、单纯非膜性阻塞(Ⅰb、Ⅰc和Ⅱb)和同时存在(Ⅰa+Ⅰc和Ⅱa+Ⅱb)。在单纯IVC受累的患者中,43.59%的患者仅存在膜性阻塞,其发病年龄(47.82±10.73)岁,小于单纯非膜性阻塞(54.00±9.98)岁和两种类型同时存在的患者(55.00±8.04)岁。在HVs受累的患者中, HVs非膜性阻塞最常见(47.83%), 与相应的其他两种类型相比,其发病年龄最大为(45.91±12.71)岁。总体看来, 单纯HVs膜性阻塞或IVC膜性阻塞患者发病年龄均较相应的非膜性阻塞患者小。但各组相应亚型之间在发病年龄方面比较,差异无统计学意义(ⅠavsⅠb/Ⅰc,P=0.087; ⅠavsⅠa+Ⅰc,P=0.227; Ⅰb/ⅠcvsⅠa+Ⅰc,P=0.571; ⅡavsⅡb,P=0.737; ⅡavsⅡa+Ⅱb,P=0.944; ⅡbvsⅡa+Ⅱb,P=0.632,见表2)。
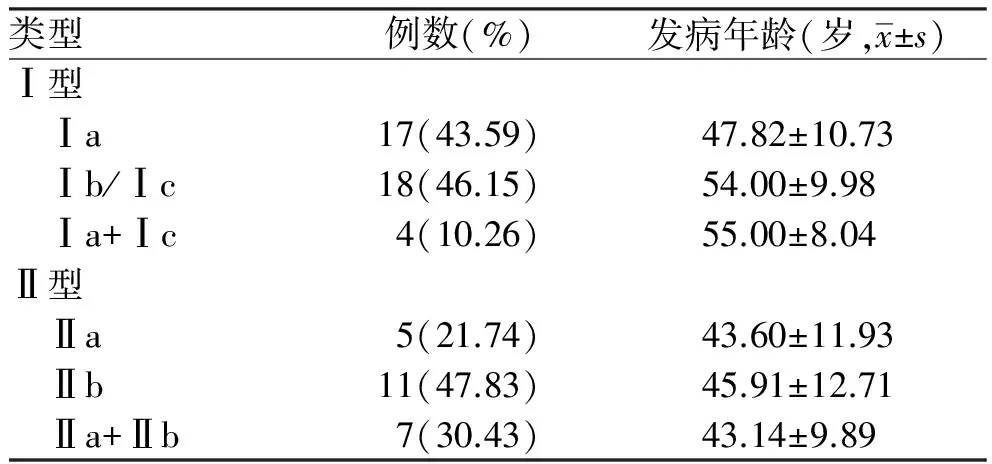
表2 布加综合征患者亚型年龄分布
2.3 不同静脉的病变类型与年龄分布本研究中,共70例患者存在IVC病变(Ⅰ型和Ⅲ型)。其中, 单纯膜性阻塞和非膜性阻塞患者分别占44.29%和50.00%。仅有5.71%的患者同时存在两种类型的病变。三组间发病年龄比较,差异无统计学意义(P>0.05)。在所有患者中, 共54例患者存在HVs病变(Ⅱ型和Ⅲ型)。其中,70.37%的患者存在HVs非膜性阻塞, 其发病年龄稍高于单纯膜性阻塞和两种类型共存的患者,但差异无显著统计学意义(非膜性阻塞vs膜性阻塞,P=0.189;膜性阻塞vs同时受累,P=0.906;非膜性阻塞vs同时受累,P=0.169,见表3)。
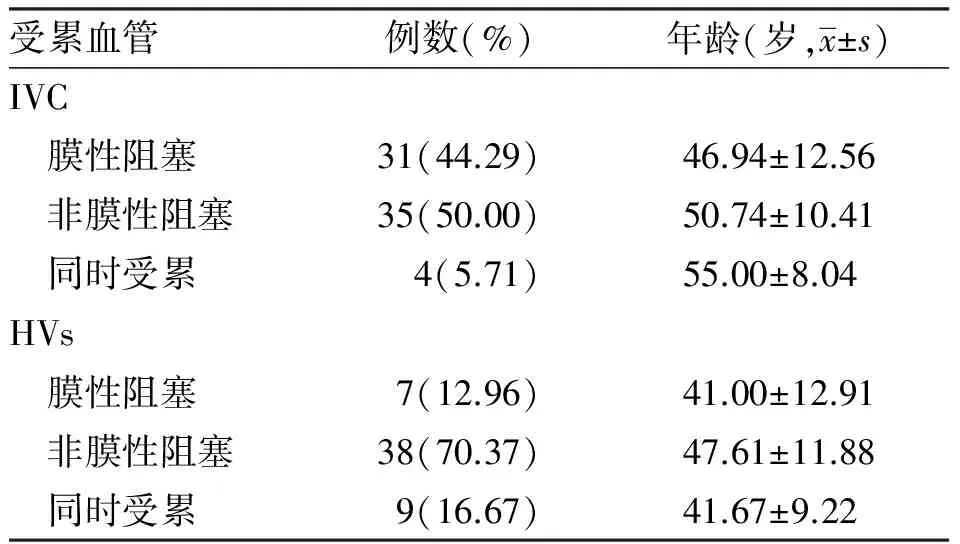
表3 不同静脉的病变类型与年龄分布
2.4 HVs膜性阻塞患者的IVC病变情况共有16例患者存在HVs隔膜形成,其中12例(75.00%)患者的IVC未发现任何病变;其余4例患者IVC存在病变,其中2例(12.50%)患者存在膜性阻塞,2例(12.50%)患者存在非膜性阻塞。
2.5 布加综合征病变类型与年龄的关系根据阻塞血流的病理形态不同, 我们将所有患者分为膜性阻塞(HVs或IVC存在隔膜)和非膜性阻塞(HVs和IVC均无隔膜)两组。我们发现,在年龄<20岁的年龄组无发病患者。大多数患者(66.67%)分布在30~50岁发病年龄组,其中最主要的病理类型为IVC或HVs膜性阻塞。在50~70岁发病年龄组,随着年龄的增长, 膜性阻塞病变的发生率显著降低(见图1)。

图1 不同病理类型随年龄分布情况
3 讨论
在本研究中,通过影像学方法分析了93例布加综合征患者病理形态, 初步探讨汉族人群布加综合征患者膜性阻塞形成的原因。2002年,一项由Valla[11]开展的研究指出,布加综合征可在所有种族群体中发生,其平均发病年龄为30~40岁, 尤以女性常见。本研究发现, 男性发病率显著高于女性(分别为64.52%和35.48%),高发年龄为30~50岁,中位年龄48岁。这说明在汉族人群中男性是高危发病群体,且平均发病年龄较西方人群推迟。这与国外众多类似报道有显著性差异,提示汉族人群与西方群体在发病原因方面存在差异。
自从人类首次报道布加综合征以来,研究人员认为该病可能是由于血管内血栓形成导致[12]。然而,随着越来越多的患者被诊断为布加综合征,人们发现, 该病不仅是由血栓形成导致,HVs或IVC内隔膜形成也可导致该病发生, 这种情况尤其多见于东方民族中[13]。在西方国家, HVs内血栓形成是最常见的布加综合征类型, 通常约74%的患病个体至少伴有一种遗传性或获得性凝血功能失调,如原发性骨髓增生性疾病(primary myeloproliferative disorders, MHP)[14]。与此不同的是,我国布加综合征患者多以IVC病变为主,且膜性阻塞是最常见的病理类型。本研究发现,由单纯IVC病变导致布加综合征的患者占41.94%,显著高于单纯HVs病变(24.73%)。在病理类型方面,单纯IVC病变患者中以膜性阻塞最常见(43.59%)。由此看来,汉族人群在受累血管及病理类型方面均与西方人群存在很大差异。
在西方国家,多数学者认同如下观点,即布加综合征膜性阻塞起源于机化的血栓[10]。该理论认为,最初在某种高危凝血因素的影响下,如基因突变、口服避孕药等,HVs或IVC内血栓形成。随着疾病的进展,血栓在原位逐渐机化, 最终形成隔膜,这种隔膜尤以HVs汇入IVC处常见。该理论也被当前的部分研究所支持[15]。在西方布加综合征患者中, 凝血因子V基因Leiden突变及亚甲基四氢叶酸还原酶基因突变常常被发现, 而此类突变往往与凝血功能失调有关[9],携带这些突变基因的患者具有较高的血栓形成倾向[16]。此外,部分学者通过对隔膜物质的病理学分析结果也支持该理论[17]。然而,令人不解的是, 如果该病最初起源于基因突变所致的血栓形成, 应如何解释迄今为止我们很少在婴幼儿及儿童群体中发现此类疾病?且国内学者针对布加综合征患者凝血功能的研究提示凝血功能异常所致血栓形成并不是膜性阻塞型布加综合征的主要病因[18]。此外, 本研究发现, 通过对不同病理类型的患者进行发病年龄分析, 膜性阻塞患者的发病年龄小于非膜性阻塞患者,但二者间未见显著性差异。通过对不同年龄段患者的病理类型进行研究发现, 在高危发病年龄阶段(30~50岁),膜性阻塞患者发病率显著高于同年龄段非膜性阻塞患者。更重要的是,近年来,国内学者开展的相关研究发现, 国人布加综合征患者凝血因子V基因突变、亚甲基四氢叶酸还原酶基因突变、蛋白C及蛋白S系统基因、JAK2 V617F基因突变很少发生[19-20]。 这一方面提示汉族人群布加综合征发病机制与西方人群可能存在很大的差异,另一方面, 我国布加综合征患者膜性阻塞与非膜性阻塞之间的关系可能有待进一步探讨。
[1]Darwish Murad S, Valla DC, de Groen PC, et al. Determinants of survival and the effect of portosystemic shunting in patients with Budd-Chiari syndrome [J]. Hepatology, 2004, 39(2): 500-508.
[2]Wang ZG, Jones RS. Budd-Chiari syndrome [J]. Curr Probl Surg, 1996, 33(2): 83-211.
[3]Singh V, Sinha SK, Nain CK, et al. Budd-Chiari syndrome: our experience of 71 patients [J]. J Gastroenterol Hepatol, 2000, 15(5): 550-554.
[4]Cheng D, Xu H, Lu ZJ, et al. Clinical features and etiology of Budd-Chiari syndrome in Chinese patients: a single-center study [J]. J Gastroenterol Hepatol, 2013, 28(6): 1061-1067.
[5]Qi X, De Stefano V, Wang J, et al. Prevalence of inherited antithrombin, protein C, and protein S deficiencies in portal vein system thrombosis and Budd-Chiari syndrome: a systematic review and meta-analysis of observational studies [J]. J Gastroenterol Hepatol, 2013, 28(3): 432-442.
[6]D’Amico M, Pasta F. Combined genetic mutations have remarkable effect on portal vein thrombosis and Budd Chiari syndrome: comment to Simsek, E., Yesilyurt, A., Pinarli, F., et al., combined genetic mutations have remarkable effect on deep venous thrombosis and/or pulmonary embolism occurrence, Gene(2013), http://dx.doi.org/10.1016/j.gene.2013.11.019 [J]. Gene, 2014, 540(2): 268-269.
[7]Jain A, Shetty S, Kulkarni B, et al. Association of factor Ⅶ gene polymorphisms with Budd Chiari syndrome [J]. Blood Coagul Fibrinolysis, 2010, 21(3): 296-297.
[8]Pemmaraju N, Hamilton JP, Cameron AM, et al. Abdominal venous thrombosis presenting in myeloproliferative neoplasm with JAK2 V617F mutation: a case report [J]. J Med Case Rep, 2012, 6: 102.
[9]Colak Y, Karasu Z, Oruc N, et al. Hyperhomocysteinaemia and factor V Leiden mutation are associated with Budd-Chiari syndrome [J]. Eur J Gastroenterol Hepatol, 2006, 18(8): 917-920.
[10]Okuda K. Membranous obstruction of the inferior vena cava (obliterative hepatocavopathy, Okuda) [J]. J Gastroenterol Hepatol, 2001, 16(11): 1179-1183.
[11]Valla DC. Hepatic vein thrombosis (Budd-Chiari syndrome) [J]. Semin Liver Dis, 2002, 22(1): 5-14.
[12]Chiari H. Ueber die selbst ndige Phlebitis obliterans derHauptst mme der Venae hepaticae als Todesursache [J]. Beitr Z Pathol Anat, 1899, 26: 1-18.
[13]Zhou P, Ren J, Han X, et al. Initial imaging analysis of Budd-Chiari syndrome in Henan province of China: most cases have combined inferior vena cava and hepatic veins involvement [J]. PLoS One, 2014, 9(1): e85135.
[14]Smalberg JH, Arends LR, Valla DC, et al. Myeloproliferative neoplasms in Budd-Chiari syndrome and portal vein thrombosis: a meta-analysis [J]. Blood, 2012, 120(25): 4921-4928.
[15]Zhang XM, Li QL. Diagnosis and treatment of Budd-Chiari syndrome [J].Acta Academiae Medicinae Sinicae, 2007, 29(1): 25-28. 张小明, 李清乐. 布加综合征诊治现状[J].中国医学科学院学报, 2007, 29(1): 25-28.
[16]Qi X, Ren W, De Stefano V, et al. Associations of coagulation factor V Leiden and prothrombin G20210A mutations with Budd-Chiari syndrome andportal vein thrombosis: a systematic review and meta-analysis [J]. Clin Gastroenterol Hepatol, 2014, 12(11): 1801-1812, e7.
[17]Wang Y, Zhang H, Guo CH, et al. Pathologic and etiologic studies of membrane obstruction of the inferior vena cava in Budd-Chiari syndrome [J]. J Intervent Radiol, 2008, 17(7): 500-503. 王佾, 张辉, 郭成浩, 等. 下腔静脉隔膜阻塞型布加综合征的病理学及病因学研究[J]. 介入放射学杂志, 2008, 17(7): 500-503.
[18]Zhang F, Zhuang JH, Jin LM, et al. Blood coagulation determination of the patients with membrane of inferior vena cava of Budd Chiarri syndrome [J]. Chin J Curr Adv Gen Surg, 2010, 13(4): 277-279. 张帆, 庄建宏, 金鲁明, 等. 下腔静脉隔膜型布加综合征患者血凝的测定[J]. 中国现代普通外科进展, 2010, 13(4): 277-279.
[19]Qi X, Wu F, Ren W, et al. Thrombotic risk factors in Chinese Budd-Chiari syndrome patients. An observational study with a systematic review of the literature [J]. Thromb Haemost, 2013, 109(5): 878-884.
[20]Hu FR, Gao F, Yang Q, et al. Significance of factor V Leidin mutation in Budd-Chiari syndrome and portal vein thrombosis [J]. J Clin Hepatol, 2014, 30(1): 86-89. 胡凤蓉, 高帆, 杨庆, 等. 因子V Leiden突变在布加综合征与门静脉血栓形成中的意义[J]. 临床肝胆病杂志, 2014, 30(1): 86-89.
(责任编辑:王豪勋)
Mechanism of membranous obstruction in Chinese Han Budd-Chiari syndrome patients
WANG Jinguang1, QIAO Xiaochun2, QI Dong2, WANG Liming1
1.Department of Gastroenterology; 2.Department of Radiology, the First People’s Hospital of Bengbu City, Bengbu 233000, China
Objective To investigate the underlying mechanisms of the formation of membranous obstruction in Chinese Han Budd-Chiari syndrome patients. Methods A total of 93 patients with Budd-Chiari syndrome from Apr. 2012 to Dec. 2013 were enrolled as the subjects. Each patient accepted an examination of computerized tomography angiography (CTA) to evaluate the impairments in hepatic veins (HVs) and inferior vena cava (IVC).Results Thirty-nine cases (41.94%) had obstructions in IVC, 23 cases (24.73%) in HVs and 31 cases (33.33%) in both. The most common type of obstruction in IVC was membranous (43.59%), and which in HVs was non-membranous (47.83%). It was also a common type that patients with the presence of non-membranous obstructions in HVs accompanying membranous or non-membranous obstructions in IVC (38.71%, 41.94%). There was no significant difference as to the age for the first time to identify Budd-Chiari syndrome in patients IVC-involved or HVs-involved singly (P>0.05). In patients IVC-involved (typeⅠand typeⅢ) and HVs-involved (typeⅡand typeⅢ), compared with non-membranous obstructions, patients with membranous obstructions seemed to be slightly younger, however, there was no significant difference (P>0.05). Most subjects were from 30 to 50 years old, with the most common type of membranous obstructions in HVs or IVC. With the increase of age(from 50 to 70 years old), the occurrence of membranous obstructions in HVs or IVC decreased sharply.Conclusion In Chinese Han cohort, membranous obstruction is the most common injury in Budd-Chiari syndrome patients. We failed to find a remarkable difference as to the age to identify Budd-Chiari syndrome between the type of membranous and non-membranous obstruction.
Budd-Chiari syndrome; Membranous obstruction; Non-membranous obstruction; Hepatic veins; Inferior vena cava
王进广,住院医师,硕士研究生,研究方向:门脉高压症及其防治。E-mail: xiao_huiqq@sina.com
王利明, 主任医师,研究方向:慢性肝病。E-mail: bbwlim@163.com
10.3969/j.issn.1006-5709.2016.01.025
R575
A
1006-5709(2016)01-0090-04
2015-01-01
