胃癌与幽门螺杆菌相关性研究进展
2016-06-05王玉平周永宁
高 鹏,王玉平,周永宁
兰州大学第一医院消化内科 甘肃省胃肠病重点实验室,甘肃 兰州 730000
专题
胃癌与幽门螺杆菌相关性研究进展
高 鹏,王玉平,周永宁
兰州大学第一医院消化内科 甘肃省胃肠病重点实验室,甘肃 兰州 730000
研究认为幽门螺杆菌(Helicobacter pylori,H.pylori)感染是引起胃癌的一个重要因素,其包含的毒力基因及生活方式能够诱导胃上皮化生、癌变。但H.pylori引起胃癌的机制尚不清楚,已经成为一个公认的全球健康问题。大量的流行病学、临床和实验研究支持H.pylori是胃癌发生、发展过程中的启动和促动因子,做好H.pylori根除工作对于胃癌预后和预防至关重要。H.pylori疫苗的发展对于胃癌的防治提供了一种新的思路。本文旨在对H.pylori与胃癌相关性的研究进展作一概述。
胃癌;幽门螺杆菌;毒力基因;疫苗;相关性
近年来胃癌的发病率和死亡率有所下降,但仍是全球第五常见的癌症,也是死亡率第三高的癌症[1-2]。根据2011年世界胃肠病组织全球指南[1]统计,超过70%胃癌发生在发展中国家。目前中国、日本和韩国三个东亚国家占全球胃癌总发病率的60%。按照胃癌发病年龄标准,男性发病率约是女性的2倍。在东亚,男性发病率为35.4/10万,而女性为13.8/10万。H.pylori引起胃癌的模式经过正常胃黏膜、慢性胃炎、萎缩、肠化生、异型增生及胃癌的一系列过程。目前,大量流行病学研究[3-5]表明,H.pylori感染是胃癌的高危因素。H.pylori对人体消化道造成重大风险是由于它可以生成毒性基因,但切实的致癌机制并不清楚。在过去20年,大量研究致力于H.pylori疫苗的开发。本文主要通过对H.pylori流行病学、胃癌的病因、H.pylori疫苗及H.pylori与胃癌相关性研究作一概述。
1 H.pylori的流行病学
流行病学调查表明,全球各个地区均有不同程度的H.pylori感染,发病率为23.5%~79.4%[6]。大多数国家H.pylori的感染率仍然很高,研究[7]表明,在北欧和北美的人群中,约有1/3的成年人还在被感染,而在欧洲南部、东部、南美洲和亚洲,H.pylori的感染率往往高于50%。此外,来自高H.pylori感染率国家的移民仍保持高H.pylori感染率。感染率随着年龄降低而降低,表示H.pylori流行将在未来几十年进一步下降。日本研究[8]表明,日本儿童H.pylori感染率约为1.8%,远低于日本成年人,所以儿童感染H.pylori是罕见的,全球H.pylori感染统计见表1。
2 胃癌的病因研究
2.1 H.pylori主要毒力基因与胃癌的关系H.pylori最典型的毒力基因代表是细胞毒素相关基因致病岛(CagPAI)、空泡毒素A(VacA)和血型组抗原结合黏附素(BabA)。
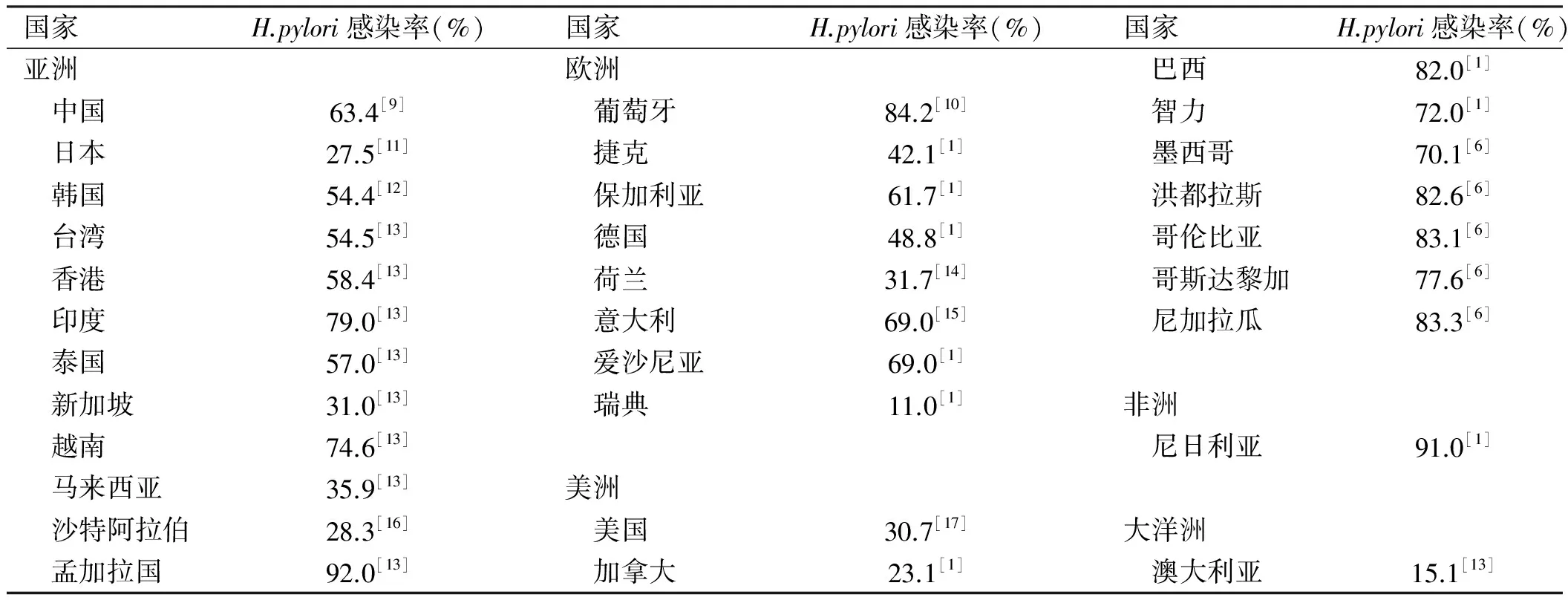
表1 全球H.pylori感染统计(截止2014年)
2.1.1 CagPAI与胃癌的关系:CagPAI是一长度为40 KB、含27~31个基因(Gene)的DNA片段,是H.pylori菌体内最具特点的毒力标记,但在胃癌形成的过程中并不是一个重要的毒力因子[18]。在CagA基因编码的3′区域遗传变异的EPIYA序列常被用来评估胃癌危险[19]。感染EPIYA C序列菌株数与胃萎缩风险(1个为7.3倍;不少于2个为12倍)和胃癌风险(1个为17倍;不少于2个为51倍)相关联。然而,感染无EPIYA C序列的CagA阳性菌株与感染CagA阴性菌株相比并没有显著增加胃癌的风险。CagA基因分为ABC和ABCC型。研究[20]表明,与ABC类型不同,ABCC肿瘤蛋白变体可以完全改变细胞的分化。结果表明ABCC类型诱导肠上皮化生,增加IL-8,加强干扰Crk衔接蛋白,抗细胞凋亡作用和致癌作用比ABC类型更显著。另一项研究[21]印证了这一观点,在287例H.pylori感染患者中,消化性溃疡的风险(OR=7.0,95%CI:3.3~15.1,P<0.001)和胃癌风险(OR=5.9,95%CI:1.5~22.1,P=0.008)在EPIYA-ABCC类型中显著增高。沙特一项新研究[22]显示,CagA和抗CagA IgG在患者血清样本中分别占H.pylori感染患者总数的63.4%和61.8%。其中胃癌和消化性溃疡患者显著高于非溃疡性消化不良患者(P<0.01)。以上研究均表明CagA基因与胃癌和消化性溃疡之间显著相关。
2.1.2 VacA与胃癌的关系:VacA是最强的毒力基因,与CagA不同,所有的H.pylori都有VacA基因,但功能性表达不同。比利时的一项研究[23]表明,s和i区域是VacA活性的关键因素,因此与胃癌和十二指肠溃疡相关最好的菌株标志是s1和i1 VacA基因型。VacA基因是由H.pylori通过V型运输分泌系统分泌的一种88 kDa的蛋白质,由P33和P55亚基组成。它与宿主细胞结合并内化造成“空泡化”集合的大囊泡,增大破裂后释放水解酶可导致细胞死亡,进而细胞凋亡加强。空泡归因于细胞膜上VacA阴离子选择性通道的形成。VacA除了具有空泡化作用,还直接影响线粒体功能。关于VacA如何进入线粒体了解甚少,VacA是通过一个未知的机制以诱导细胞凋亡,这是VacA研究领域争议最大的地方[24]:许多观点认为P33和P55需要在线粒体膜内形成阴离子选择性通道。大多研究仅表明P33能够独立于P55形成稳定的细胞膜通道。但近期证据[25]显示,P55可以间接上调促凋亡因子诱导细胞凋亡,进一步增加了不确定性。
2.1.3 BabA与胃癌的关系:BabA是一种外膜蛋白,起黏附分子的作用,在40%~95%的H.pylori菌株表达。BabA的表达能使附着于胃上皮的H.pylori影响最大化,介导菌体与糖化(果糖)的Lewis b抗原牢固结合。而Lewis b抗原在胃上皮细胞表面及胃黏膜都有表达[26]。感染BabA阳性菌株后胃内细菌定植密度增加,且由于IL-8水平的增高导致了炎症加重。伊朗的一项研究[27],在160例H.pylori感染患者中BabA2基因的总感染率为40.6%。感染BabA2基因的胃癌患者、十二指肠患者和非溃疡性消化不良患者分别为95%、18.1%和26.1%,BabA2基因在胃癌患者的感染率最高。
2.2 生活方式与胃癌的关系最近国内研究[28]表明,体质量指数(BMI)与H.pylori感染呈正相关,高BMI增加感染的风险。国外有报道H.pylori感染与饮酒呈正相关,与抗生素及阿司匹林使用呈反相关[29]。
3 H.pylori与胃癌的关系
3.1 H.pylori与胃癌的相关性H.pylori涉及不同的免疫反应机制,既保护又损害宿主。H.pylori感染引起的慢性胃炎是最强的引起胃癌的危险因素[3]。2015年法国Plummer等[4]研究,通过更新归因分数(AF)评估H.pylori对全球癌症造成的负担,发现H.pylori感染形成的非贲门胃癌从所有癌症总数的5.2%上升到6.2%,加强了H.pylori对癌症的影响作用。韩国Kwak等[5]在近期的一项研究中筛选出1 833例充分评估的胃腺癌患者,其过去感染H.pylori、近期感染H.pylori患者分别占75.2%、22.5%,而没有感染H.pylori的患者仅占2.3%。以上结果充分表明了大多数胃癌均与H.pylori感染有关,并具有潜伏性,应引起重视。当然也有例外,出现“印度之谜”和“非洲之谜”这些术语的国家,H.pylori感染率较高却出现不成比例的低胃癌发病率或低死亡率[1]。近年来,H.pylori的“保护”作用逐渐被报道。中国最新一项研究中[30]对2 454例胃癌患者进行的Meta分析表明,H.pylori感染对于胃癌的预后具有保护作用。但H.pylori作为胃癌的致癌因素观点仍是主流。另外研究报道H.pylori感染对于反流性食管炎具有保护作用[31]。
3.2 根除H.pylori治疗与胃癌的关系根除H.pylori可改变胃黏膜上皮细胞增殖失衡和凋亡的近状,根除H.pylori能够有效预防溃疡及胃癌发生。至今多项研究支持了这一观点[5,32-34]。最近一项研究[32]表明,筛查并根除H.pylori,能降低无感染症状亚洲高危人群的胃癌发病率。韩国Yoon等[33]通过Meta分析研究表明,胃切除术后的胃癌患者通过H.pylori根除,能够降低残胃癌的发生。对于既往有无H.pylori根除的患者,进行H.pylori治疗均能降低胃癌发生率和死亡率,但在无H.pylori根除的患者身上表现出降低趋势更显著[34]。
4 H.pylori疫苗的实验研究
H.pylori疫苗已成为H.pylori研究领域的热点。虽然H.pylori疫苗已用于动物模型的临床调查,但还未被用于人体。最近中国宣布已经成功地开发了H.pylori疫苗,可以有效地预防H.pylori相关性胃癌,这将是癌症一级预防的重要突破,但疫苗应用于人体还需要一定的时间[35]。H.pylori能够引起先天性和适应性免疫反应导致炎症和抗炎反应,使感染持久存在。因此,开发新疗法和有效的H.pylori疫苗是艰巨的,也取得了一些进展。澳大利亚Baker等[36]在一项研究中对小鼠皮下一起接种疱疹病毒重组糖蛋白G和H.pylori疫苗(KatA),比单独接种KatA产生的抗KatA IgG显著增多,且H.pylori的定植密度显著降低,表明疱疹病毒重组糖蛋白G可以提高H.pylori疫苗的保护性免疫反应。加拿大Altman等[37]一项实验研究表明,以葡聚糖为基础合成的糖复合物对以碳水化合物为基础的H.pylori疫苗的发展可以提供一种简单和成本效益的策略。研究[38]表明,CD4+T细胞抗原与Th1佐剂组成的疫苗可以在老鼠模型中抗H.pylori感染。因此包含CD4+T细胞抗原的疫苗会是一种前景广阔的H.pylori候选疫苗。成功的疫苗建设新方向应遵循H.pylori毒性因子感染的免疫病理学的强制性学说。它是一种关于H.pylori先天反应、黏膜炎症和H.pylori毒力因子相互作用的新内容,包括诱导免疫应答、对H.pylori适应性反应的调节。如同新型疫苗平台的建设是用于实现广泛的免疫应答,形成杀菌免疫力[39]。
综上所述,胃癌的发生和H.pylori感染有着不同寻常的关系,多因素在不同阶段起着协同作用,但H.pylori绝不是胃癌的特异病因。H.pylori与胃癌密切关系为探索胃癌的发病机理及其防治提供好的方法。全球H.pylori流行广泛,最具成本效益的战略是行H.pylori血清学检测进行筛查,其次是抗生素治疗[40]。因此,预防工作可以广泛地被应用,范围不必局限于青年人或组织病理轻度病变者[34]。H.pylori根除结合内镜检查已经表明能够减少高胃癌发病地区的胃癌发病率[41]。全球现阶段只能采用筛查联合治疗的方法用于预防胃癌。费用昂贵、易产生副作用且导致抗生素耐药性不断增加,所以开发H.pylori疫苗作为H.pylori根除的新疗法成为必然趋势,为胃癌的研究提供新的理论和方法,但仍需进一步验证。
[1]World Gastroenterology Organisation. World Gastroenterology Organisation Global Guideline: Helicobacter pylori in developing countries [J]. Clin Gastroenterol, 2011, 45(5): 383-388.
[2]Okuchukwu EH, Olayiwola OA. Epidemiology and clinicopathological characteristics of gastric cancer the Nigerian setting in view [J]. Nigerian J Med, 2015, 24(1): 71-80.
[3]Kiga K, Mimuro H, Suzuki M, et al. Epigenetic silencing of miR-210 increases the proliferation of gastric epithelium during chronic Helicobacter pylori infection [J]. Nat Commun, 2014, 5: 4497.
[4]Plummer M, Franceschi S, Vignat J, et al. Global burden of gastric cancer attributable to Helicobacter pylori [J]. In J Cancer, 2015, 136(2): 487-490.
[5]Kwak HW, Choi IJ, Cho SJ, et al. Characteristics of gastric cancer according to Helicobacter pylori infection status [J]. J Gastroenterol Hepatol, 2014, 29(9): 1671-1677.
[6]Porras C, Nodora J, Sexton R, et al. Epidemiology of Helicobacter pylori infection in six Latin American countries (SWOG Trial S0701) [J]. Cancer Causes Control, 2013, 24(2): 209-215.
[7]Eusebi LH, Zagari RM, Bazzoli F. Epidemiology of Helicobacter pylori infection [J]. Helicobacter, 2014, 19: 1-5.
[8]Okuda M, Osaki T, Lin YL, et al. Low prevalence and incidence of Helicobacter pylori infection in children: a population-based study in Japan [J]. Helicobacter, 2015, 20(2): 133-138.
[9]Zhu Y, Zhou X, Wu J, et al. Risk factors and prevalence of Helicobacter pylori infection in persistent high incidence area of gastric carcinoma in Yangzhong city [J]. Gastroenterol Res Pract, 2014,2014: 481365.
[10]Bastos J, Peleteiro B, Barros R, et al. Sociodemographic determinants of prevalence and incidence of Helicobacter pylori infection in portuguese adults [J]. Helicobacter, 2013, 18(6): 413-422.
[11]Hirayama Y, Kawai T, Otaki J, et al. Prevalence of Helicobacter pylori infection with healthy subjects in Japan [J]. J Gastroenterol Hepatol, 2014, 29 Suppl 4: 16-19.
[12]Lim SH, Kwon JW, Kim N, et al. Prevalence and risk factors of Helicobacter pylori infection in Korea: nationwide multicenter study over 13 years [J]. BMC Gastroenterol, 2013, 13: 104.
[13]Fock KM, Ang TL. Epidemiology of Helicobacter pylori infection and gastric cancer in Asia [J]. J Gastroenterol Hepatol, 2010, 25(3): 479-486.
[14]van Blankenstein M, van Vuuren AJ, Looman CW, et al. The prevalence of Helicobacter pylori infection in the Netherlands [J]. Scan J Gastroenterol, 2013, 48(7): 794-800.
[15]Lahner E, Zullo A, Hassan C, et al. Detection of gastric precancerous conditions in daily clinical practice: a nationwide survey [J]. Helicobacter, 2014, 19(6): 417-424.
[16]Hanafi MI, Mohamed AM. Helicobacter pylori infection: seroprevalence and predictors among healthy individuals in AI Madinah, Saudi Arabia [J]. J Egypt Public Health Assoc, 2013, 88(1): 40-45.
[17]Grad YH, Lipsitch M, Aiello AE. Secular trends in Helicobacter pylori seroprevalence in adults in the United States: evidence for sustained race/ethnic disparities [J]. Am J Epidemiol, 2012, 175(1): 54-59.
[18]Salehi Z, Mollasalehi H, Jelodar MH, et al. The relationship between Helicobacter pylori infection and gastric adenocarcinoma in Northern Iran [J]. Oncol Res, 2010, 18(7): 323-328.
[19]Ferreira RM, Machado JC, Figueiredo C. Clinical relevance of Helicobacter pylon vacA and cagA genotypes in gastric carcinoma [J]. Best Practice Res Clin Gastroenterol, 2014, 28(6): 1003-1015.
[20]Vaziri F, Peerayeh SN, Alebouyeh M, et al. Novel effects of Helicobacter pylori CagA on key genes of gastric cancer signal transduction: a comparative transfection study [J]. Pathog Dis, 2015, 73(3). pii: ftu021.
[21]Beltrán-Anaya FO, Poblete TM, Román-Román A, et al. The EPIYA-ABCC motif pattern in cagA of Helicobacter pylori is associated with peptic ulcer and gastric cancer in Mexican population [J]. BMC Gastroenterol, 2014, 14: 223.
[22]Saber T, Ghonaim MM, Yousef AR, et al. Association of Helicobacter pylori cagA gene with gastric cancer and peptic ulcer in Saudi patients [J]. J Microbiol Biotechnol, 2015, 25(7): 1146-1153.
[23]Memon AA, Hussein NR, Miendge Deyi VY, et al. Vacuolating cytotoxin genotypes are strong markers of gastric cancer and duodenal ulcer-associated Helicobacter pylori strains: a matched case-control study [J]. J Clin Microbiol, 2014, 52(8): 2984-2989.
[24]Palframan SL, Kwok T, Gabriel K. Vacuolating cytotoxin A (VacA), a key toxin for Helicobacter pylori pathogenesis [J]. Front Cell Infect Microbiol, 2012, 2: 92.
[25]Lan CH, Sheng JQ, Fang DC, et al. Involvement of VDAC1 and Bcl-2 family of proteins in VacA-induced cytochrome C release and apoptosis of gastric epithelial carcinoma cells[J]. J Dig Dis, 2010, 11(1): 43-49.
[26]Yamaoka Y. Roles of Helicobacter pylori BabA in gastroduodenal pathogenesis [J]. World J Gastroenterol, 2008, 14(27): 4265-4272.
[27]Talebi Bezmin Abadi A, Taghvaei T, Mohabbati Mobarez A, et al. High correlation of babA 2-positive strains of Helicobacter pylori with the presence of gastric cancer [J]. Intern Emerge Med, 2013, 8(6): 497-501.
[28]Xu CF, Yan M, Sun Y, et al. Prevalence of Helicobacter pylori infection and its relation with body mass index in a Chinese population [J]. Helicobacter, 2014, 19(6): 437-442.
[29]Cheung J, Goodman KJ, Girgis S, et al. Disease manifestations of Helicobacter pylori infection in Arctic Canada: using epidemiology to address community concerns [J]. BMJ Open, 2014, 4(1): e003689.
[30]Wang F, Sun G, Zou Y, et al. Protective role of Helicobacter pylori infection in prognosis of gastric cancer: evidence from 2 454 patients with gastric cancer [J]. PLoS One, 2013, 8(5): e62440.
[31]Dimoulios F, Tsikrika E, Kontotasios K, et al. Protective role of Helicobacter pylori infection against severer reflux esophagitis [J]. Helicobacter, 2014, 19: 117.
[32]Ford AC, Forman D, Hunt RH, et al. Helicobacter pylori eradication therapy to prevent gastric cancer in healthy asymptomatic infected individuals: systematic review and meta-analysis of randomised controlled trials [J]. BMJ, 2014, 348: g3174.
[33]Yoon SB, Park JM, Lim CH, et al. Effect of Helicobacter pylori eradication on metachronous gastric cancer after endoscopic resection of gastric tumors: a meta-analysis [J]. Helicobacter, 2014, 19(4): 243-248.
[34]Li WQ, Ma JL, Zhang L, et al. Effects of Helicobacter pylori treatment on gastric cancer incidence and mortality in subgroups [J]. J Natl Cancer Inst, 2014, 106(7). pii: dju116.
[35]Wang SM, Qiao YL. Vaccine and cancer prevention [J]. Progress in Chemistry, 2013, 25(9): 1583-1587. 王少明,乔友林.疫苗与癌症预防[J]. 化学进展, 2013, 25(9):1583-1587.
[36]Baker L, Chitas AM, Hartley CA, et al. Recombinant herpesvirus glycoprotein G improves the protective immune response to Helicobacter pylori vaccination in a mouse model of disease [J]. PLoS One, 2014, 9(5): e96563.
[37]Altman E, Chandan V, Harrison B. The potential of dextran-based glycoconjugates for development of Helicobacter pylori vaccine [J]. Glycoconj J, 2014, 31(1): 13-24.
[38]Li HB, Zhang JY, He YF, et al. Systemic immunization with an epitope-based vaccine elicits a Th1-biased response and provides protection against Helicobacter pylori in mice [J]. Vaccine, 2012, 31(1): 120-126.
[39]Ihan A, Gubina M. The immune response to Helicobacter pylori [J]. Food Technol Biotechnol, 2014, 52(2): 204-209.
[40]Wong IO, Schooling CM, Cowling BJ. Cost-effectiveness of Helicobacter pylori screening and treatment for gastric cancer in Hong Kong: a decision analytic approach [J]. Hong Kong Med J, 2014, 20 Suppl 7: 13-15.
[41]Fock KM. Review article: the epidemiology and prevention of gastric cancer [J]. Aliment Pharmacol Ther, 2014, 40(3): 250-260.
(责任编辑:王豪勋)
Research progress of the correlation between gastric cancer and Helicobacter pylori
GAO Peng, WANG Yuping, ZHOU Yongning
Department of Gastroenterology, the First Affiliated Hospital of Lanzhou University, the Key Laboratory for Gastrointestinal Diseases of Gansu Province, Lanzhou 730000, China
Helicobacter pylori (H.pylori) infection is an important correlation factor of inducing gastric cancer. Virulence genes ofH.pyloriand lifestyle may affect gastric metaplasia and canceration, but the mechanism ofH.pyloriinduced gastric cancer is still not clear, andH.pyloriinfection is recognized as a worldwide health problem. Numerous epidemiology, clinical and experimental studies support thatH.pyloriis the starting and actuation factor of the development of gastric cancer.H.pylorieradication therapy is essential in gastric cancer prognosis and prevention. The development of vaccines for the prevention of gastric cancer provides a new way of thinking. The research progress on the correlation betweenH.pyloriand gastric cancer was reviewed.
Gastric cancer; Helicobacter pylori; Virulence gene; Vaccine; Correlation
国家科技惠民计划(2012GS620101);国家自然科学基金项目(81372145;81172366)
高鹏,硕士在读,研究方向:消化道肿瘤。E-mail:1605543820@qq.com
周永宁,博士,教授,主任医师,研究方向:消化道肿瘤。E-mail:yongningzhou@sina.com.cn
10.3969/j.issn.1006-5709.2016.01.001
R735.2
A
1006-5709(2016)01-0001-04
2015-05-04
