米根霉脂肪酶的制备及其在餐厨废弃油脂转化中的应用*
2016-06-05姜苏峻林蒋海吕晓静肖文娟龚映雪刘泽寰
姜苏峻,林蒋海,吕晓静,肖文娟,龚映雪,刘泽寰
(暨南大学生命科学技术学院,广东 广州510632)
米根霉脂肪酶的制备及其在餐厨废弃油脂转化中的应用*
姜苏峻,林蒋海,吕晓静,肖文娟,龚映雪,刘泽寰
(暨南大学生命科学技术学院,广东 广州510632)
利用脂肪酶把餐厨废弃油脂转化成为生物柴油能够达到绿色化、资源化处理餐厨垃圾的目的。从米根霉CICC3005 cDNA文库扩增得到脂肪酶基因(proROL),并克隆到毕赤酵母组成型表达载体pGAPZαA中,电转入毕赤酵母X-33中构建重组毕赤酵母,SDS-PAGE电泳发酵液上清,结果显示重组酶的相对分子质量约为35 000。以橄榄油为底物测得脂肪酶活性为(426.6±0.8) U/mL。利用重组的米根霉脂肪酶对餐厨废弃油脂进行转酯化反应,以乙醇为酰基受体制备脂肪酸乙酯,在水含量为5%,醇油摩尔比为4∶1,酶添加量为10%的条件下得到脂肪酸乙酯的最高得率为49%。
餐厨废弃物;生物柴油;米根霉;脂肪酶;毕赤酵母
随着我国城镇化建设步伐的日益加快,城市垃圾的产生量和危害也日益增加,其中尤以餐厨垃圾最为凸显[1]。 “地沟油”就是从餐厨垃圾中的废弃油脂提炼而来的。而且餐厨废弃油脂占餐厨垃圾的比重还相当的高[2],如能合理利用,非但可以消除其对人们健康生活的危害,还能变废为宝,生产大量的工业用油或生物柴油造福人类[3]。
利用餐厨废弃油脂生产生物柴油目前多采用化学法[4],化学法存在工艺复杂,醇消耗量大,污染环境等缺点。而酶法生产生物柴油具有操作简单,醇消耗量小,无污染物排放等优点。但是传统酶法工艺一般以毒性较大的甲醇为酰基受体,加工过程中仍然存在污染较大的隐患。
脂肪酶是一种能够在油水界面起催化作用[5],催化甘油三酯进行转酯化反应[6]和酯化反应[7]的特殊酯酶,在生产生物柴油、手性大分子以及表面活性剂[8]领域中具有重要的应用价值。因此通过基因工程技术实现脂肪酶的外源高效表达对于合理利用餐厨废弃油脂具有重要意义。米根霉来源的脂肪酶是一种比酶活较高的酯酶,在转酯化反应方面有较好的表现[9]。该酶的编码基因包括26个氨基酸残基的信号序列(presequence),97个残基的前导肽序列(prosequsence)和 269个氨基酸残基的成熟肽序列(matureROL),其中前导肽序列对脂肪酶的活性起到重要作用[10-11]。
本文从米根霉CICC3005菌株中克隆得到了脂肪酶基因,在毕赤酵母X-33中实现了高效表达,选取毒性较低的乙醇替代传统酰基受体甲醇,以重组酵母生产的脂肪酶为催化剂进行转酯化反应生产生物柴油,从而达到降低催化剂的生产成本,减少对环境破坏的目的。
1 材料和方法
1.1 质粒与菌株
载体pGAPZαA、大肠杆菌Escherichiacoli(E.coli) DH5α 菌株、米根霉RhizopusoryzaeCICC 3005菌株。
毕赤酵母P.pastorisX33菌株由中国广东省广州市华南理工大学某实验室馈赠。
1.2 培养基和培养条件
含有zeocin和Amp抗性的LB培养基、马铃薯葡萄糖琼脂培养基、含有zeocin抗性的YPD培养基分别用以培养大肠杆菌、米根霉和酵母菌。
1.3 米根霉总RNA的提取以及cDNA文库的构建
米根霉总RNA的提取按照Invitrogen公司的TRIzol®Reagent说明书进行操作;反转录与cDNA文库的构建按照ReverTra Ace-α-试剂盒说明书进行。然后根据Genebank公布的米根霉基因序列(GenBank登录号AF229435)设计引物扩增脂肪酶基因,上游引物:5′-GAATTCGTTCCTGTTTCTGGTAAATC-3′;下游引物:5′-TCTAGAGCCAAACAGCTTCCTTCGTT-3′。
1.4 重组毕赤酵母的构建与鉴定
将经过测序的proROL序列克隆到pMD18-T中,得到pMD18-T-proROL。利用EcoR Ⅰ和XbaⅠ同时双酶切pMD18-T-proROL和pGAPZαA载体,并在T4 DNA 连接酶作用下构建pGAPZαA-proROL重组质粒,用BlnⅠ线性化后电转入毕赤酵母X-33构建重组菌,最后通过菌落PCR、SDS-PAGE和三丁酸甘油酯-维多利亚蓝平板[12-13]鉴定阳性克隆并筛选高产菌株。
1.5 重组酵母发酵及酶活测定
将鉴定得到的重组酵母接种到含有zeocin抗性的YPD培养基中过夜培养,然后按照1%的接种量接种到含有100 mL YPD培养基的250 mL锥形瓶中,用于重组酵母发酵以及酶活测定,在酶活最高点时收集粗酶液,冻干后低温储存备用。脂肪酶酶活测定采用橄榄油乳化法[14],脂肪酶酶活计算公式:
X1—脂肪酶酶活(U/mL)
V1—滴定样品消耗氢氧化钠标准液的体积(mL)
V2—滴定空白消耗氢氧化钠标准液的体积(mL)
C—标准氢氧化钠滴定液浓度(mol/L)
50—1 mL 0.05 mol/L氢氧化钠相当于脂肪酸50 μmoL
n1—酶液稀释倍数
0.05—氢氧化钠标准滴定液浓度
1/15—反应时间为15 min,以1 min计。
1.6 脂肪酶酶学特性分析
脂肪酶酶学特性分析采用对硝基苯酚法[16-18]:配置10 mL 10 mmol/L的pNPC底物溶液:称量24.23 μL pNPC溶于10 mL乙腈溶液。将以上底物溶液、乙醇、Tris-cl(pH 8.0)按照1∶4∶95(体积比)的比例混匀,然后取240 μL,加入适当稀释的酶液10 μL,于37 ℃水浴中准确反映10 min,用酶标仪测定405 nm下的吸光值,根据pNP标准曲线计算脂肪酶的pNP酶活。脂肪酶酶活定义为每分钟释放1 μmoL pNP所需要的酶量。分别研究了温度、pH、有机溶剂,以及脂肪酶的底物特异性[18]。
1.7 油脂提取和以无水乙醇为酰基受体的转酯化反应
首先通过索氏提取法提取餐厨废弃物中的废弃油脂[19],测得餐厨废弃油脂的酸值为(2.89±0.5) mg/g,皂化值为(199.94±0.8) mg/g,其平均摩尔质量为(854.1±0.8) g/mol。然后将2 g餐厨废弃油脂和不同醇油摩尔比下的无水乙醇在25 mL带帽血清瓶中进行转酯化反应:实验中采取3步(0,4,8 h)添加乙醇的方法来减少乙醇对脂肪酶酶活的损害。转酯化反应温度为40 ℃,转速为300 r/min。反应结束后采用气相色谱法计算生成生物柴油的量[20]。
2 结果和讨论
2.1 重组毕赤酵母的构建
用PCR方法扩增得到RhizopusoryzaeCICC 3005的米根霉脂肪酶基因,连接T载后测序,测序结果显示没有发生突变。琼脂糖电泳结果显示,在1 100 bp处有明显亮带,表明成功克隆得到了米根霉脂肪酶基因,电泳结果如图1所示。
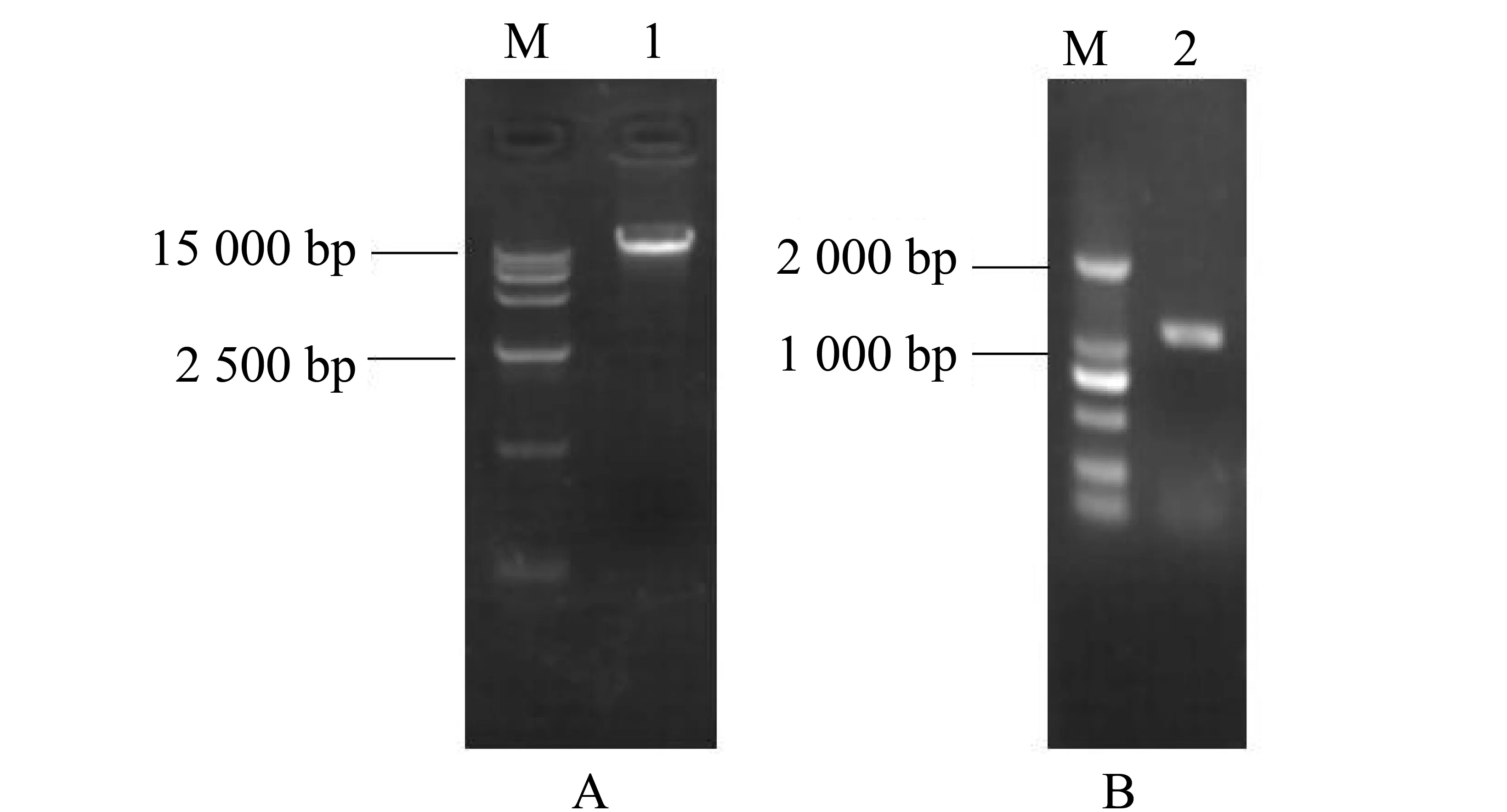
图1 米根霉RNA提取(A)和proROL(b)基因的扩增Fig.1 RNA of Rhizopus oryzae(A)and proROL gene(B)
2.2 菌落PCR鉴定pGAPZαA-proROL阳性转化子
从含有博来霉素抗性的YPD平板挑取8个单克隆做菌落PCR,如图2所示。挑取1,2,11,12,13号单克隆进行活化,4 ℃离心获得粗酶液,取30 μL点到三丁酸甘油酯-维多利亚蓝平板上观察水解圈,13号水解圈最大,如图3。后续实验采用13号重组子。

图2 菌落PCR鉴定重组毕赤酵母Fig.2 Colony PCR of recombinant Pichia pastoris

图3 三丁酸甘油酯-维多利亚蓝平板水解圈Fig.3 Colour halos of Tributyrin-Victoria Blue
2.3 重组米根霉脂肪酶酶活曲线及生长曲线
选取显色平板中水解圈最大的13号重组子进行发酵培养,并采用橄榄油乳化法测定重组脂肪酶酶活,在84 h(A600为30.0)的时候酶活达到最高值(426.6±0.8) U/mL,如图4。对发酵液上清进行SDS-PAGE分析,显示在理论值35 000附近存在明显条带,如图5,表明米根霉脂肪酶在毕赤酵母中成功获得了表达。
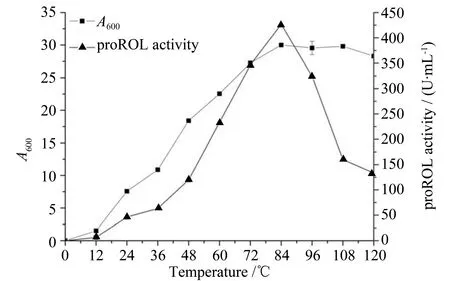
图4 重组米根霉脂肪酶的酶活曲线及生长曲线Fig.4 Time course analysis of recombinant proROL activities and biomass of recombinant Pichia pastoris

图5 重组脂肪酶SDS-PAGE分析Fig.5 SDS-PAGE analysis of recombinant lipase proROL
2.4 重组米根霉脂肪酶酶学特性分析
2.4.1 温度和pH对重组脂肪酶的影响 如图6和图7所示,重组脂肪酶最适温度和pH分别是30 ℃和pH 8.0,这与严翔翔[21]得出的结果一致。在温度大于40 ℃后,酶活迅速下降,说明重组脂肪酶对温度敏感。在pH 大于8.0后,酶活有所下降,但不明显,表现出较强的pH耐受性。

图6 温度对重组脂肪酶的影响Fig.6 Influence of temperature on recombinant proROL
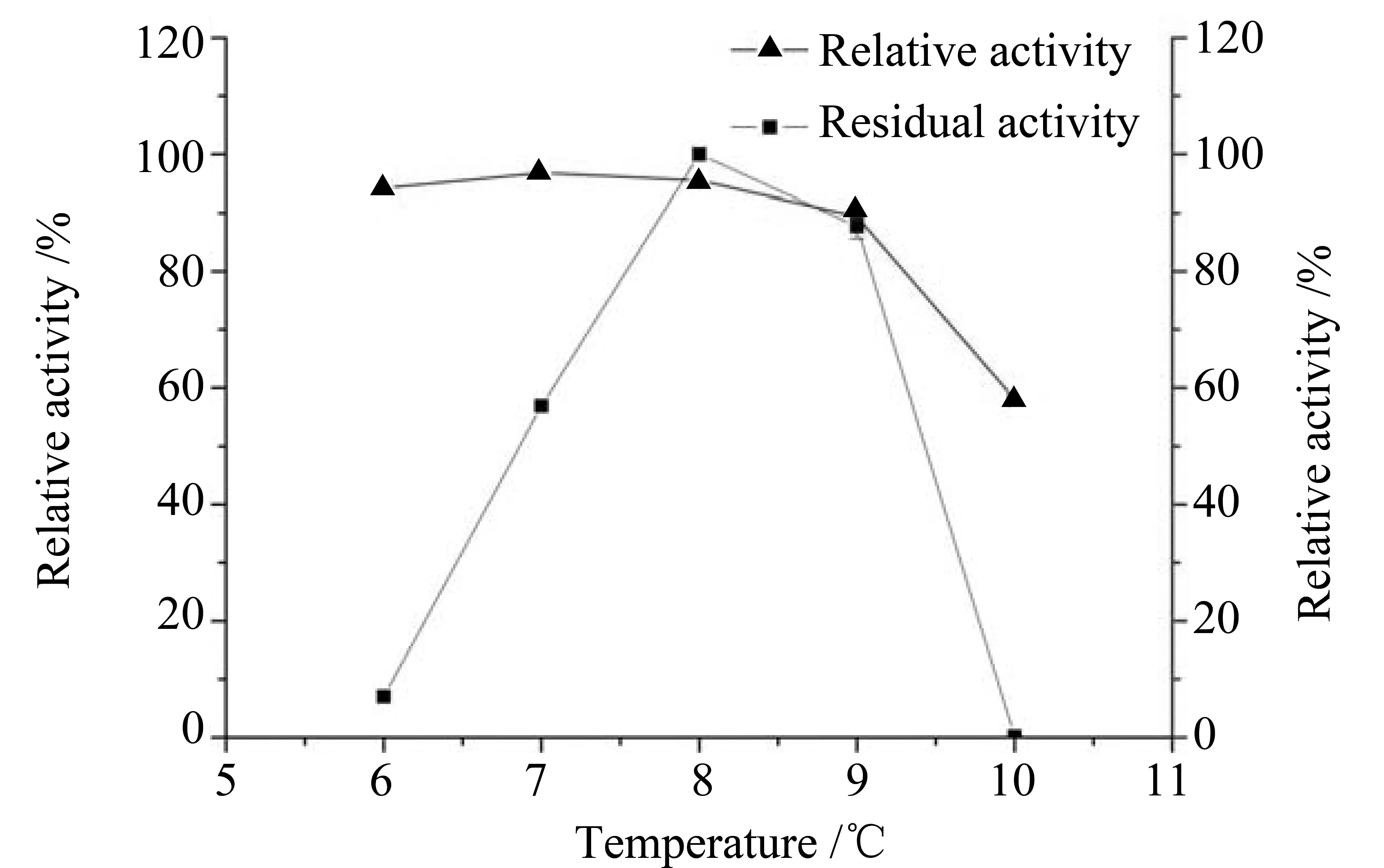
图7 pH对重组脂肪酶的影响Fig.7 Influence of pH on recombinant proROL
2.4.2 有机溶剂对重组脂肪酶酶活的影响 从图8可以看出,重组脂肪酶仅对甲醇、甲苯和正己烷有较好的耐受性,其相对酶活分别为87.70%、91.30%和89.40%。考虑到后续实验以乙醇为酰基受体,我们又研究了不同体积分数的乙醇对脂肪酶酶活的影响。当无水乙醇和脂肪酶粗酶液体积比为1∶9,即乙醇体积分数约为4%时,对脂肪酶酶活的抑制作用较小,如图9。
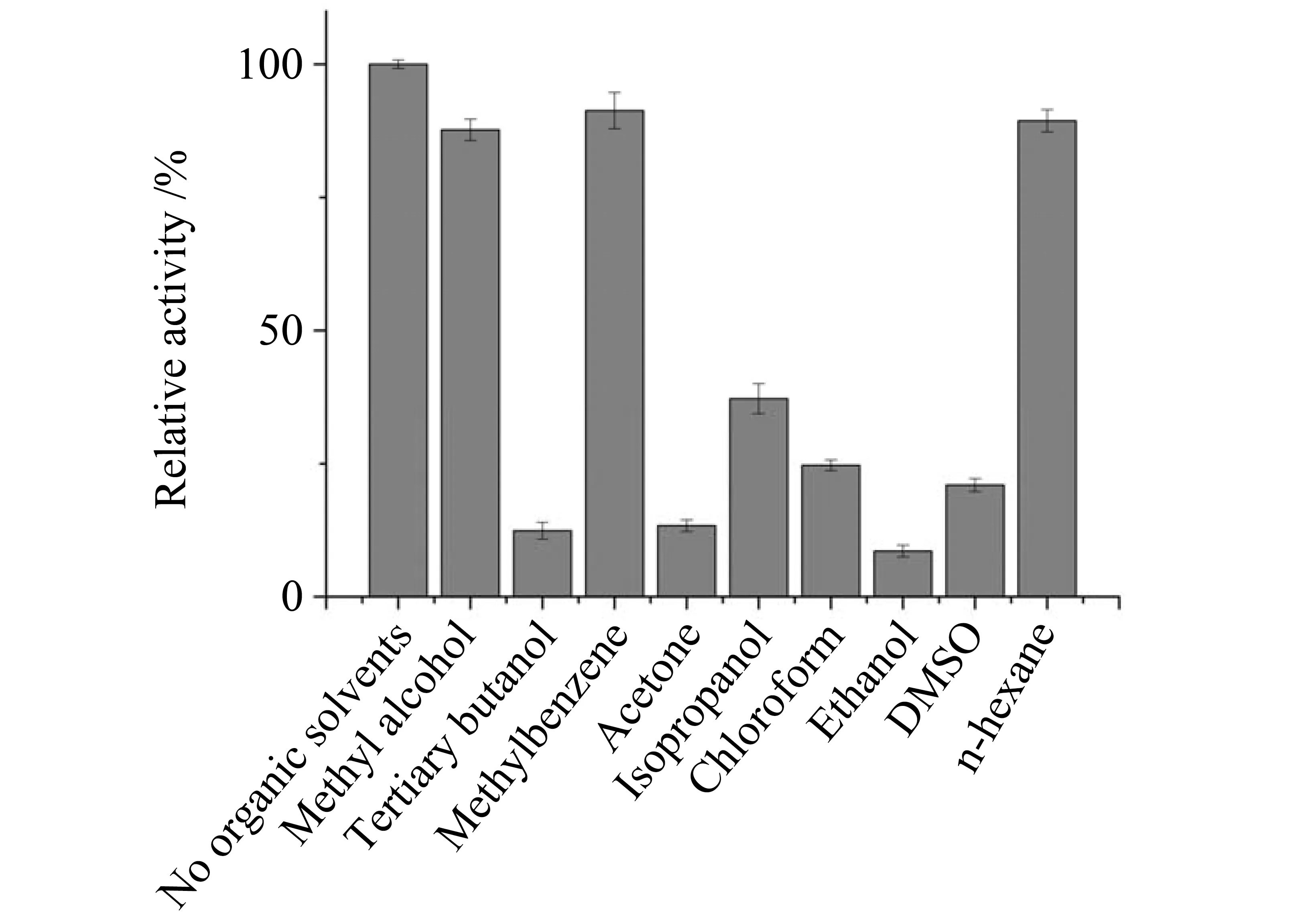
图8 有机溶剂对重组脂肪酶的影响Fig.8 Influence of organic solvents on recombinant proROL
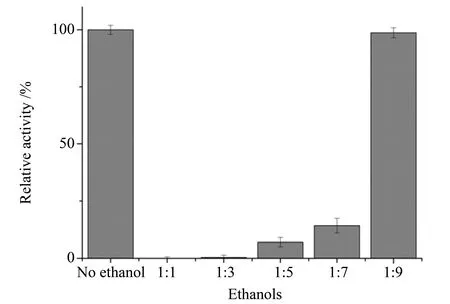
图9 不同φ(乙醇)对重组脂肪酶的影响Fig.9 Influence of different concentrations of ethanol on recombinant proROL
2.4.3 proROL的底物特异性分析 从图10可以看出,若设定图10:14C底物与重组脂肪酶反应时的酶活为100%,那么重组脂肪酶对图10:8C底物的水解活性为85.20%,对图10:8C-14C中长度碳链底物表现出较好的水解活性,而对其他碳链长度的底物水解活性较低。

图10 重组脂肪酶底物特异性Fig.10 Substrate specificity of recombinant ProROL
2.5 以乙醇为酰基受体的转酯化反应
2.5.1 水含量对转酯化反应的影响 脂肪酶是一种在油水界面起催化作用的特殊酯酶,因此需要一定量的水分来辅助转酯化反应。从图11可以看出,将脂肪酶冻干粉用于转酯化反应,在没有水的情况下转酯化效率很低,基本没有脂肪酸乙酯的生成。当水含量增加到5%时,转酯化效率达到最高,此时脂肪酸乙酯得率为44%。继续提高水含量,转酯化效率随之降低,这可能是由于过多的水存在时,脂肪酶水解活性增强,水解生成的脂肪酸乙酯,导致产率下降。
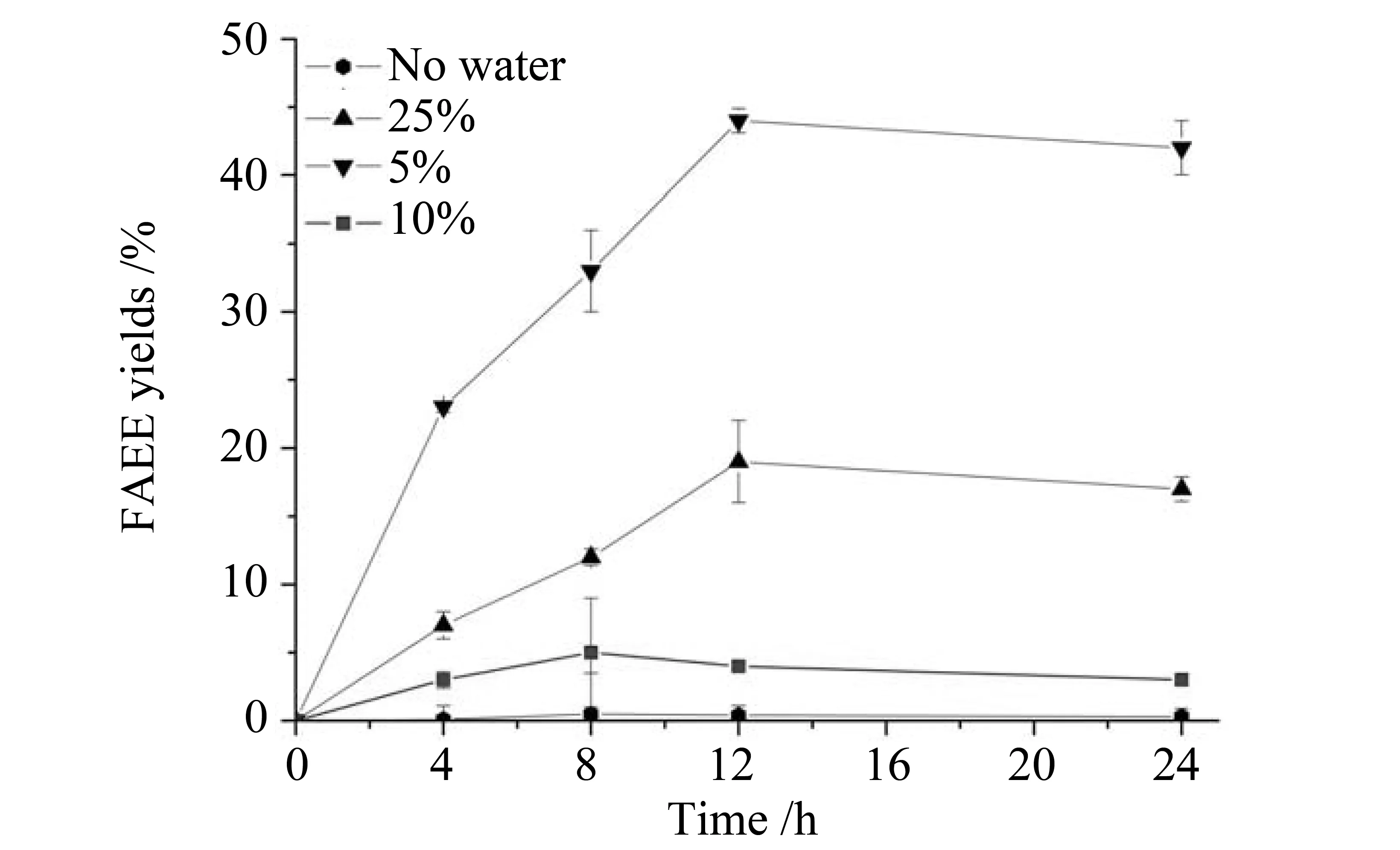
图11 水含量对转酯化反应的影响Fig.11 Influence of water content on transesterification
2.5.2 醇油摩尔比对转酯化反应的影响 醇油摩尔比是影响转酯化反应的另一个重要因素。理论上,1 moL油脂需要3 moL乙醇来醇解,但往往总是需要更多的乙醇来保证反应的充分进行。如图12,在醇油摩尔比为3∶1时,脂肪酸乙酯得率为40%;当醇油摩尔比增加到增加到4∶1时,脂肪酸乙酯得率达到最高44%;继续增加醇油摩尔比,脂肪酸乙酯得率有所下降,在醇油摩尔比为6∶1时,脂肪酸乙酯得率最高仅为21%,此时乙醇体积分数远大于4%,过多的乙醇能抑制了脂肪酶酶活,导致转化率有所下降。

图12 醇油摩尔比对转酯化反应的影响Fig.12 Influence of ethanol/oil molar ratio on transesterification
2.5.3 酶添加量对转酯化反应的影响 在转酯化反应过程中控制脂肪酶添加量能够降低生物柴油的生产成本。如图13,在醇油摩尔比为4∶1时,5%的酶添加量可以得到脂肪酸乙酯的得率为44%,当酶量增加到10%时,脂肪酸乙酯得率最高仅为49%。继续增加酶量到20%时,脂肪酸乙酯得率有所下降,这可能是由于过量酶粉降低了反应体系的流动性,导致转化效率有所降低。
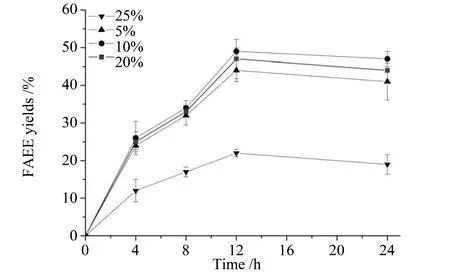
图13 酶添加量对转酯化反应的影响Fig.13 Influence of lipase amount on transesterification
3 结 论
本文尝试建立一种低碳绿色的利用餐厨废弃油脂制备生物柴油的新工艺。毕赤酵母中对米根霉脂肪酶实现了高效的分泌表达,重组脂肪酶酶活高达(426.6±0.8) U/mL,相比已报道的在大肠杆菌和酿酒酵母中表达的重组脂肪酶酶活有很大的优势[22],进一步降低了脂肪酶和后续转酯化反应的成本,具有了工业化应用的潜力。其次,我们在采用环境友好的酶法制备生物柴油的同时,还选择了毒性较低的乙醇替代甲醇作为酰基受体来制备生物柴油,并详细研究了水含量、醇油摩尔比、酶添加量对转酯化反应的影响,整体上实现了对餐厨废弃油脂的绿色转化,为进一步的工业化应用提供了一定的依据。
[1] 沈超清. 广州市餐厨垃圾的资源化利用研究[D]. 广州:华南理工大学,2013:1-4.
[2] WATANABE Y, SHIMADA Y, SUGIHARA A, et al. Enzymatic conversion of waste edible oil to biodiesel fuel in a fixed-bed bioreactor[J]. Journal of the American Oil Chemists’ Society, 2001, 78(7): 703-707.
[3] 周后波. 利用废弃油制备生物柴油技术研究[D]. 海南:海南大学,2013:9-10.
[4] 杨实权. 生物柴油基因工程菌的构建及酿酒酵母产油脂条件研究[D]. 北京:北京化工大学,2010:2-3.
[5] YAN J, LI A, XU Y, et al. Efficient production of biodiesel from waste grease: one-pot esterification and transesterification with tandem lipases[J]. Bioresource Technology, 2012, 123: 332-337.
[6] VAN GERPEN J. Biodiesel processing and production[J]. Fuel Processing Technology, 2005, 86(10): 1097-1107.
[7] NIE K, WANG M, ZHANG X, et al. Additives improve the enzymatic synthesis of biodiesel from waste oil in a solvent free system[J]. Fuel, 2015, 146: 13-19.
[8] GUPTA R, GUPTA N, RATHI P. Bacterial lipases: an overview of production, purification and biochemical properties[J]. Applied Microbiology and Biotechnology, 2004, 64(6): 763-781.
[9] 朱俊任, 郑旭煦, 李强, 等. 不同来源脂肪酶催化制备生物柴油的研究进展 [J]. 中国农学通报, 2010, 26(4): 318-322.
[10] SAYARI A, FRIKHA F, MILED N, et al. N-terminal peptide ofRhizopusoryzaelipase is important for its catalytic properties[J]. FEBS Letters, 2005, 579(5): 976-982.
[11] BEER H, WOHLFAHRT G, SCHMID R, et al. The folding and activity of the extracellular lipase ofRhizopusoryzaeare modulated by a prosequence[J]. Biochem J, 1996, 319: 351-359.
[12] 王欢, 何腊平, 周换景, 等. 脂肪酶活力测定方法及其在筛选产脂肪酶微生物中的应用[J]. 生物技术通报, 2013 (1): 203-208.
[13] KOUKER G, JAEGER K E. Specific and sensitive plate assay for bacterial lipases[J]. Applied and Environmental Microbiology, 1987, 53(1): 211-213.
[14] WANG J R, LI Y Y, XU S D, et al. High-level expression of pro-form lipase fromRhizopusoryzaeinPichiapastorisand its purification and characterization[J]. International Journal of Molecular Sciences, 2013, 15(1): 203-217.
[15] 滕宏飞, 王丹静, 徐青, 等. 橄榄油乳化法测定脂肪酶活性的优化研究[J]. 食品工业, 2011, 6(3).
[16] EOM G T, LEE S H, SONG B K, et al. High-level extracellular production and characterization ofCandidaantarcticalipase B inPichiapastoris[J]. Journal of Bioscience and Bioengineering, 2013, 116(2): 165-170.
[17] ANDERSON E M, LARSSON K M, KIRK O. One biocatalyst-many applications: the use ofCandidaantarcticaB-lipase in organic synthesis[J]. Biocatalysis and Biotransformation, 1998, 16(3): 181-204.
[18] PAGLIARO M, CIRIMINNA R, KIMURA H, et al. From glycerol to value‐added products[J]. Angewandte Chemie International Edition, 2007, 46(24): 4434-4440.
[19] 方龙. 一种能降解利用餐厨垃圾的基因重组酵母构建及应用研究[D]. 广州 :暨南大学,2014:59-60.
[20] LI A, NGO T P N, YAN J, et al. Whole-cell based solvent-free system for one-pot production of biodiesel from waste grease[J]. Bioresource Technology, 2012, 114: 725-729.
[21] 严翔翔. 米根霉脂肪酶基因的克隆、密码子优化及在毕赤酵母中的分泌表达[D]. 武汉:华中科技大学, 2009:32-33.
[22] 郭勇亮. 米根霉(Rhizopusoryzae)脂肪酶基因的克隆及其在毕赤酵母中的高效表达研究[D]. 无锡:江南大学,2012:3-4.
Rhizopusoryzaelipase preparation and its application in the conversion of waste cooking oil
JIANGSujun,LINJianghai,LVXiaojing,XIAOWenjuan,GONGYingxue,LIUZehuan
(College of Life Science and Technology, Jinan University, Guangzhou 510632,China)
Using lipase to change waste cooking oil into biodiesel can achieve the goal of green, recycling of food waste. A gene encodingRhizopusoryzaelipase containing prosequence(ProROL) was cloned into the pGAPZαA and electrotransformed into thePichiapastorisX-33 strain. The lipase was functionally expressed and secreted with a molecular weight of 35 000. The lipase activity was (426.6±0.8) U/mL when using olive oil as substract. Using waste cooking oil as the raw material and alcohol as acyl receptor, lipase as catalyst for the production of fatty acid ethyl ester, 49% of the fatty acid ethyl ester yield was obtained when the water content is 5%, the alcohol oil molar ratio is 4∶1, and lipase adding amount is 10%, under this condition the fatty acid ethyl ester yield is 49%.
food waste; biodiesel;Rhizopusoryzae; lipase;Pichiapastoris
10.13471/j.cnki.acta.snus.2016.02.020
2015-04-07
姜苏峻(1990年生),男;研究方向:秸秆降解微生物的基因组和代谢工程;通讯作者:刘泽寰;E-mail:zhliu@jnu.edu.cn
Q815
A
0529-6579(2016)02-0111-06
