管氏肿腿蜂感染Wolbachia的分子检测
2016-06-04黄镜梅刘乃勇许小露李丽芳朱家颖西南林业大学林学院云南省森林灾害预警与控制重点实验室云南昆明650224
黄镜梅 刘乃勇 许小露 李丽芳 杨 斌 朱家颖(西南林业大学林学院云南省森林灾害预警与控制重点实验室,云南昆明 650224)
管氏肿腿蜂感染Wolbachia的分子检测
黄镜梅 刘乃勇 许小露 李丽芳 杨 斌 朱家颖
(西南林业大学林学院云南省森林灾害预警与控制重点实验室,云南昆明 650224)
摘要:Wolbachia是一类在节肢动物中广泛感染的胞内共生菌,为了解Wolbachia在管氏肿腿蜂体内的感染情况,采用Wolbachia的通用引物、A大组特异性引物和B大组特异性引物对管氏肿腿蜂体内Wolbachia的wsp基因进行PCR扩增及序列测定,所获得的基因片段分别命名为wSgu、wSguA和wSguB,长度分别为620、572 bp和463 bp。基因序列分析表明wSgu与wSguB序列间碱基差异较大,同源性仅为60%。系统发育分析表明该寄生蜂感染了A大组的Wolbachia,但对于该寄生蜂是否也感染了B大组的Wolbachia尚待确定。
关键词:管氏肿腿蜂;Wolbachia;wsp基因;PCR;序列分析
Wolbachia(沃尔巴克氏体)是一种广泛存在于节肢动物中的细胞内共生菌,属于细菌门,变形杆菌α亚门的立克次氏体,为革兰氏阴性细菌。据统计,昆虫中Wolbachia的感染率已经达到70%以上[1]。Wolbachia是通过母系细胞质遗传,在寄主中能产生多种生殖调控行为来保证其在寄主中稳定遗传[2]。目前,对生物体内Wolbachia的检测,主要利用其l6S rDNA、ftsZ和wsp等进行PCR扩增与序列分析[3-6]。由于Wolbachia的wsp基因相对于其他基因进化最快,且在GenBank中登录的基因量也越来越多,因而该基因被广泛运用于Wolbachia的感染检测[5-6]。根据分子系统发生,将Wolbachia划分为11个超群(supergroup A-K);又根据wsp基因序列,将主要感染昆虫等的Wolbachia A大组和B大组进一步分为12个亚组[7]。
管氏肿腿蜂(Scleroderma guani)属膜翅目肿腿蜂科(Hymenoptera:Bethylidae),分布广泛,是许多钻蛀性害虫幼虫和蛹的体外寄生蜂,被较为广泛的应用于林间防治天牛、小蠹虫等钻蛀性害虫。关于该寄生蜂的生物学特性等方面均已取得显著的进展[8]。然而,关于管氏肿腿蜂Wolbachia的感染检测仍未有报道。为此,本研究对管氏肿腿蜂体内Wolbachia的wsp基因进行PCR检测,并对其wsp基因序列进行系统进化分析,进而了解Wolbachia在该寄生蜂内的感染情况,旨在为今后进一步研究Wolbachia对该寄生蜂生殖方式的影响和将管氏肿腿蜂更好地应用于钻蛀害虫的生物防治奠定基础。
1 材料与方法
1.1供试昆虫源
试验中所用管氏肿腿蜂由黄粉甲蛹在实验室内进行继代饲养,取成蜂保存于-70℃备用。
1.2基因组DNA提取
采用改良的蛋白酶K法,具体方法如下:1)取5头用超纯水洗涤过的管氏肿腿蜂放在装有200 μL裂解液(100 mmol Tris-HC1,25 mmol EDTA,500 mmol NaCl,1%SDS,pH 8.0)的1.5 mL离心管中研磨,然后用300 μL裂解液冲洗研磨棒;2)加蛋白酶K至终浓度为100 μg/ mL,50℃水浴4 h;3)加入等体积的酚-氯仿-异戊醇(25∶24∶1),离心(14 000 r/ min,5 min),用氯仿-异戊醇(24∶1)重复抽提1次;4)转移上清至洁净的1.5 mL离心管中,加入1 mL预冷的无水乙醇,离心(14 000 r/ min,10 min),用75%乙醇洗涤沉淀,充分干燥后用0.5×TE溶解沉淀,4℃保存备用。
1.3Wilbachia的wsp基因片段PCR扩增
wsp基因片段的PCR扩增参照Zhou等[7]的方法,采用wsp基因的通用引物为81F/691R、A大组特异性引物为136F/691R和B大组特异性引物为81F/522R,3对引物所用扩增体系和PCR反应程序相同,PCR反应体系(50 μL)为:正向引物和反向引物各(10 μmol/ L)为1.25 μL,DNA模板为2.5 μL,10×PCR buffer为5 μL,dNTP(10 mmol/ L)为1.25 μL,Taq polymerase(Promega)为0.5 μL,MgCl2(25 μmol/ L)为3.75 μL,用ddH2O补足体积。PCR程序为:94℃预变性4 min;94℃变性1 min,48℃退火1 min,72℃延伸1 min,35个循环;72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳分析,紫外灯下检测拍照。
1.4克隆和测序
PCR扩增反应结束后,按照Axygen凝胶回收试剂盒将PCR产物纯化后,连接至pMD-18T载体上,转化到大肠杆菌DH5α感受态细胞中,涂平板后通过蓝白斑筛选及菌液PCR检测阳性重组克隆。最后菌液送至南京金斯瑞公司进行测序验证。
1.5序列分析
用NCBI网站上的BLAST工具进行Wolbachia的wsp基因序列检索和同源性比较,ClustalX1.83软件[9]对所测得的结果以及GenBank中已登陆的其他相关物种的wsp基因序列进行比对后,用MEGA 4.0中的邻接法(neighbor-joining,NJ)构建系统发育树,并用1 000次自导复制来评价各分支的置信度[10]。
2 结果与分析
2.1wsp基因的PCR检测
以管氏肿腿蜂基因组DNA为模板,利用wsp基因的通用引物、A大组特异性引物和B大组特异性引物均扩增出了wsp基因的目的片段(图1),说明其感染了Wolbachia。根据所用引物不同,将通过通用引物获得的基因片段命名为wSgu,A和B大组特异引物获得的基因片段分别命名为wSguA 和wSugB。
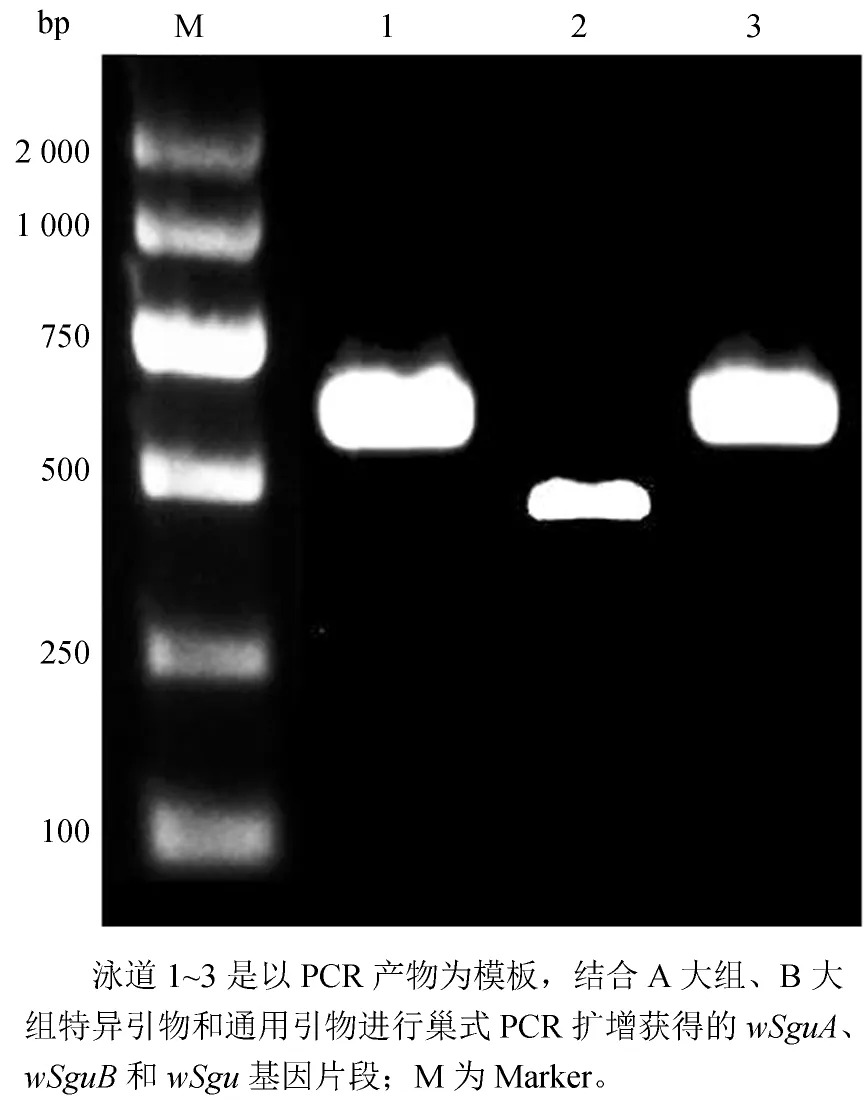
图1 管氏肿腿蜂体内Wilbachia的wsp基因的PCR扩增电泳图Fig.1 Electrophorogram of PCR amplification of wsp genes of Wolbachia in Scleroderma guani
2.2wsp基因片段的序列测定及分析
含目的基因的重组质粒经测序验证后发现,当使用81F和691R通用引物时,扩增获得的wSgu基因片段长度为620 bp;采用A大组特异性引物136F和691R扩增获得的wSguA基因片段长度为572 bp;采用B大组特异性引物81F和522R扩增获得的wSguB基因片段长度为463 bp。对测序获得的序列分析结果表明,wSguA序列不正确,因而不进行后续分析,而wSgu和wSguB基因片段已经提交GenBank(登录号分别为KX001811和KX001812)。基因序列比对结果表明,wSgu与wSguB序列间碱基差异较大,同源性仅为60%(图2)。

图2 管氏肿腿蜂体内Wilbachia的wsp基因序列比较Fig.2 Comparisons of wsp gene sequences of Wolbachia in Scleroderma guani
在NCBI网站上进行BLAST发现(相关序列见表1),wSgu和wSguB与A大组序列的一致性高达87%,因此采用B大组特异性引物获得的片段并非来自B大组Wolbachia。系统发育分析进一步表明,wSgu和wSguB同时聚到A大组,说明该寄生蜂感染了A大组的Wolbachia(图3)。但由于wSguA序列不对,对于该寄生蜂是否也感染了B大组的Wolbachia有待进一步研究。
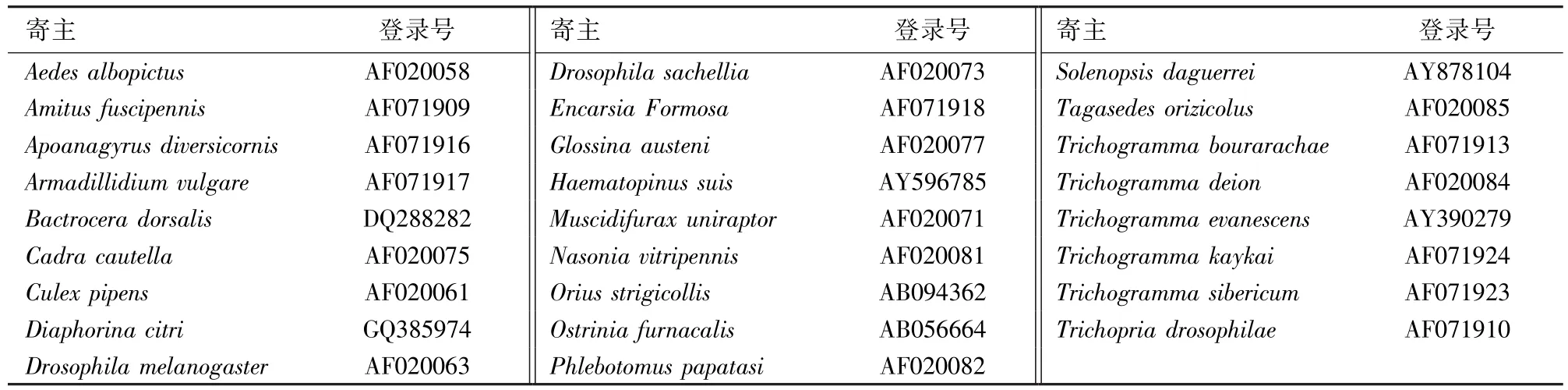
表1 GenBank中其他相关物种的wsp基因序列Table 1 Wsp gene sequences of other related species in GenBank
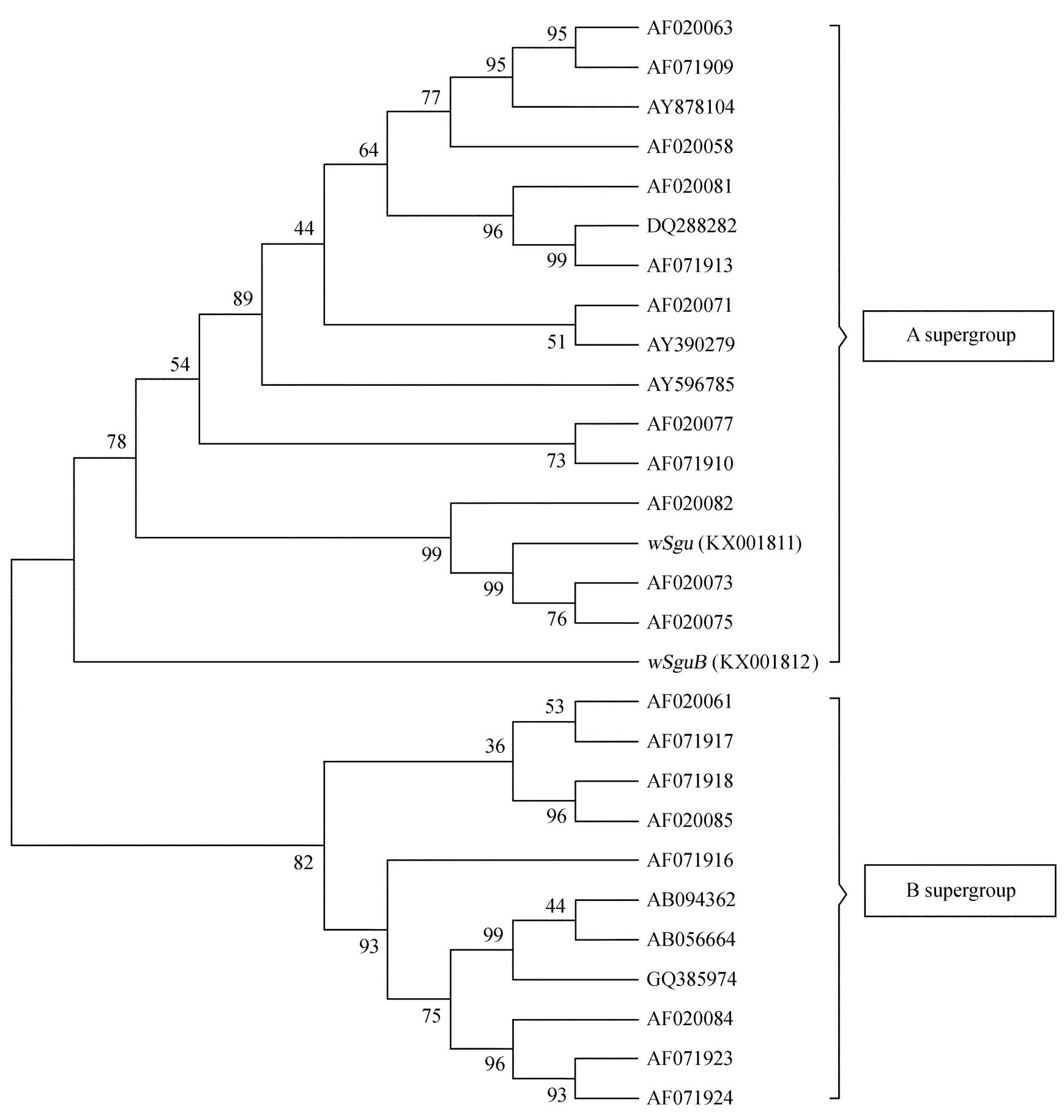
图3 Wilbachia的wsp基因序列NJ树Fig.3 Neighbor-joining tree of Wolbachia based on the wsp sequences
3 结论与讨论
据报道Wolbachia在许多昆虫体内均有感染,是节肢动物体内最为丰富的共生微生物之一[11-12]。本试验采用了wsp基因的通用引物、A大组特异性引物和B大组特异性引物,对管氏肿腿蜂体内Wolbachia感染情况进行检测,从PCR扩增结果得知,该寄生蜂已经感染了Wolbachia。另外,虽然获得了相应的基因片段,但是序列分析表明,wSgu 与wSguB序列间核苷酸同源性较低(60%),这很可能与在同一寄主里可能存在多种传播机制有关[13-14],也可能是复合感染引起的[15]。系统发育分析进一步支持PCR检测结果,且证实该寄生蜂感染的是A大组的Wolbachia。虽然在研究中曾多次尝试鉴定wSguA基因,但均未能成功获得该基因的正确序列,因此,对于该寄生蜂是否也感染了B大组的Wolbachia,仍然有待进一步研究。Wolbachia在昆虫中感染的检测结果与检测时所用的引物有关,并且Wolbachia在昆虫中存在2种感染[15-16](三重感染和复合感染)以及在昆虫体内Wolbachia的A大组和B大组的丰富度不同[17],如果在检测时若用通用引物就只能判断出该昆虫被Wolbachia的某一个大组感染。由于本研究仅采用了Wolbachia的wsp基因来检测Wolbachia在管氏肿腿蜂中的感染情况,以及构建了系统进化树对管氏肿腿蜂所感染Wolbachia的类型进行了分析,虽能得出一些判断,但还需把wsp基因检测与其他16S rDNA等相关基因检测相结合做进一步的验证[18-20]。研究发现,感染了Wolbachia的昆虫和其它节肢动物的生殖方式受Wolbachia的调控[11,21],但其调控作用因寄主种类不同而不同[22]。因此,关于Wolbachia对管氏肿腿蜂的生殖调控机制也有待进一步研究。
[参考文献]
[1]Hilgenboecker K,Hammerstein P,Schlattmann P,et al.How many species are infected with Wolbachia?A statistical analysis of current data[J].FEMS Microbiology Letters,2008,281(2):215-220.
[2]Werren J H,Baldo L,Clark E.Wolbachia:master manipulators of invertebrate biology[J].Nature Reviews Microbiology,2008,6(10):741-751.
[3]郭晓鹏,李正西.我国烟粉虱自然种群中存在广泛的Wolbachia感染现象[J].微生物学报,2008,48(1):63-67.
[4]林煌真,李正西.福建省烟粉虱自然种群Wolbachia感染特点[J].昆虫学报,2008,51(1):14-19.
[5]宋月,王哲,刘宏岳,等.北京地区亚洲玉米螟种群中Wolbachia超感染[J].昆虫学报,2008,51(6):665-670.
[6]江幸福,王蕾,张蕾,等.蔬菜蚜虫感染沃尔巴克氏体(Wolbachia)的分子检测[J].植物保护,2009,35(4):63-65.
[7]Zhou W,Rousset F,O’Neill S.Phylogeny and PCR-based classification of Wolbachia strains using wsp gene sequences[J].Proceedings of the Royal Society B Biological Sciences,1998,265(1395):509-515.
[8]陈君,程惠珍.肿腿蜂的应用研究进展[J].中国生物防治,2000,16(4):166-170.
[9]Thompson J D,Gibson T J,Plewniak F,et al.The ClustalX windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools [J].Nucleic Acids Research,1997,25(24):4876-4882.
[10]Tamura K,Dudley J,Nei M,et al.MEGA4:molecular evolutionary genetics analysis(MEGA)software version 4.0[J].Mo1ecular Biology and Evolution,2007,24 (8):1596-1599.
[11]Werren J H.Biology of Wolbachia[J].Annual Review of Entomology,1997,42(1):587-609.
[12]赵玲,朱道弘,杨筱慧,等.四种瘿蜂体内Wolbachia感染的PCR检测及感染株系的wsp基因序列分析[J].应用昆虫学报,2013,50(4):998-1005.
[13]Raychoudhury R,Baldo L,Oliveira D C,et al.Modes of acquisition of Wolbachia:horizontal transfer,hybrid introgression,and codivergence in the Nasonia species complex[J].Evolution,2009,63(1):165-183.
[14]刘淑平,吕仲贤,徐红星,等.寄生蜂体内共生菌Wolbachia研究进展[J].环境昆虫学报,2011,3 (1):107-116.
[15]宋月,沈佐锐,王哲,等.Wolbachia在玉米螟赤眼蜂内的三重感染[J].昆虫学报,2009,52(4):445-452.
[16]Cook J M,Butcher R D J.The transmission and effects of Wolbachia bacteria in parasitoids[J].Researches on Population Ecology,1999,41(1):15-28.
[17]杨璞,朱家颖,陈晓鸣,等.一种新的白蜡虫寄生蜂体内Wolbachia的wsp基因分子检测及序列分析[J].林业科学研究,2011,24(3):340-344.
[18]柴换娜,杜予州,吴海燕.稻纵卷叶螟感染Wolbachia 的ftsZ基因和16S rDNA基因的序列分析[J].昆虫学报,2011,54(4):416-424.
[19]王欢,胡萃,叶恭银,等.两种金小蜂体内Wolbachia 的wsp基因分子检测及序列分析[J].植物保护学报,2006,33(3):235-240.
[20]Paraskevopoulos C,Bordenstein S R,Wernegreen J J,et al.Towards a Wolbachia multilocus sequence typing system:discrimination of Wolbachia strains present in Drosophila species[J].Current Microbiology,2006,53(5):388-395.
[21]Stouthamer R,Breeuwer J A J,Hurst G D D.Wolbachia pipientis:microbial manipulator of arthropod reproduction[J].Annual Review of Microbiology,1999,53 (1/2):71-102.
[22]Kageyama D,Narita S,Imamura T,et al.Detection and identification of Wolbachia endosymbionts from laboratory stocks of storedproduct insect pests and their parasitoids[J].Journal of Stored Products Research,2010,46(1):13-19.
(责任编辑张坤)
第1作者:黄镜梅(1992—),女,硕士生。研究方向:昆虫生理生化与分子生物学。Email:1025682082@qq.com。
Molecular Detection of Wolbachia Infection in Scleroderma guani
Huang Jingmei,Liu Naiyong,Xu Xiaolu,Li Lifang,Yang Bin,Zhu Jiaying
(Key Laboratory of Forest Disaster Warning and Control of Yunnan Province,College of Forestry,Southwest Forestry University,Kunming Yunnan 650224,China)
Abstract:Wolbachia is a group of intracellular symbionts ubiquitously occurred in arthropods.To investigate the Wolbachia infection in Scleroderma guani,wsp gene of Wolbachia in S.guani were detected with universal primers and gene-specific primers of A and B supergroups.The sequences obtained were named as wSgu,wSguA and wSguB with the lenth of 620,572 bp and 463 bp,respectively.Gene sequence analysis showed that the difference of base pairs were large between wSgu and wSguB,and their nucleotide identity was only 60%.Phylogenetic analysis showed that this parasitic wasp was infected with A-Wolbachia,while whether this parasitic wasp infected with B-Wolbachia remains to be further investigated.
Key words:Scleroderma guani,Wolbachia,wsp gene,PCR,sequence analysis
通信作者:朱家颖(1984—),男,博士,教授。研究方向:昆虫生理生化与分子生物学。Email:jyzhu001@gmail.com。
基金项目:云南省林学一级学科博士点建设项目(林学学位授权学科项目经费)资助;国家自然科学基金项目(31260449)资助;云南省中青年学术与技术带头人后备人才项目(2013HB077)资助;云南省高校森林有害生物科技创新团队项目资助;西南地区生物多样性保育国家林业局重点实验室开放基金资助。
收稿日期:2015-12-19
doi:10.11929/ j.issn.2095-1914.2016.03.029
中图分类号:S718.7
文献标志码:A
文章编号:2095-1914(2016)03-0169-05
