盐酸多奈哌齐治疗轻、中度阿尔茨海默病患者临床疗效及血清炎性介质水平变化的动态观察
2016-06-03王淑贞郭洪志王飞飞
白 银 王淑贞 郭洪志 王飞飞
(山东大学齐鲁医院神经内科,山东 济南 250012)
盐酸多奈哌齐治疗轻、中度阿尔茨海默病患者临床疗效及血清炎性介质水平变化的动态观察
白银王淑贞郭洪志王飞飞
(山东大学齐鲁医院神经内科,山东济南250012)
〔摘要〕目的探讨阿尔茨海默病(AD)患者应用盐酸多奈哌齐(安理申)药物治疗前后血清白细胞介素(IL)-1β、IL-6及肿瘤坏死因子(TNF)-α水平变化以及与认知功能障碍的关系。方法收集36例AD患者(治疗组)和30例正常健康老年人(对照组),治疗组给予安理申药物(5 mg,1次/d)治疗24 w,采用酶联免疫吸附法(ELISA)分别测定安理申治疗前后AD患者及对照组血清IL-1β、IL-6、TNF-α水平。治疗前、治疗后12 w及24 w进行MMSE、ADAS-Cog及ADAS-ADL量表测评。结果①治疗前,治疗组血清IL-1β、IL-6及 TNF-α水平均显著高于治疗后及对照组(P<0.05);②安理申治疗AD后,患者MMSE 评分、ADAS-ADL评分显著高于治疗前(分别为P=0.003,0.011);ADAS-Cog评分显著低于治疗前(P=0.005);③AD患者安理申治疗后单词记忆及回忆测验、结构性练习、单词辨认等方面较治疗前有显著改善(分别为P=0.004,0.018,0.001)。结论AD患者血清炎性介质水平升高,且与认知功能障碍程度及日常生活能力缺损程度存在明显相关性。AD患者经安理申治疗后,血清炎性介质水平降低,同时认知功能及日常生活能力均有所提高。推测安理申治疗AD的临床疗效除抑制胆碱酯酶外,还可能通过抑制炎性介质的表达,在一定程度上改善患者的认知功能及日常生活能力,减缓AD进展。
〔关键词〕阿尔茨海默病;盐酸多奈哌齐(安理申);炎性介质;认知功能
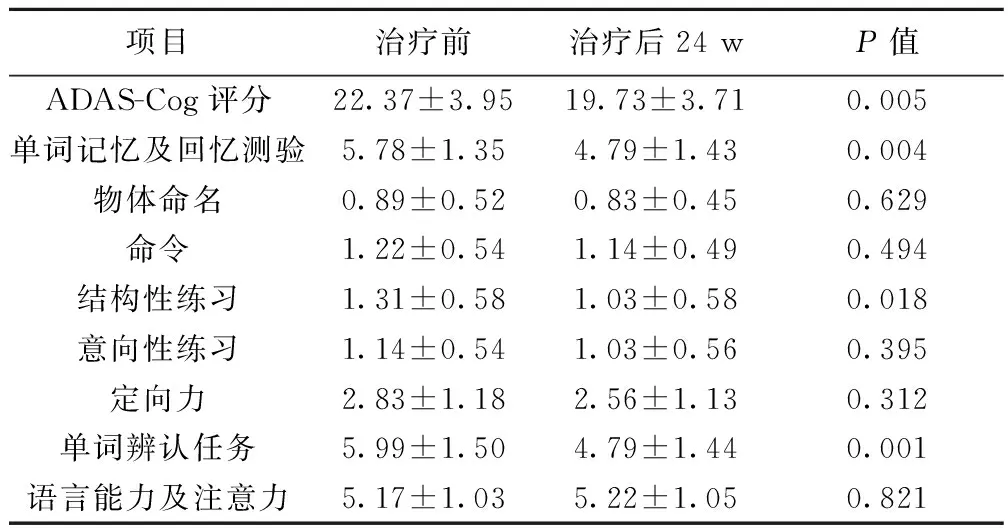
阿尔茨海默病(AD)是老年人常见的神经系统变性疾病,是老年痴呆症最常见的类型(约占75%),严重危害老年人的身体健康和生活质量。AD以广泛的神经元丢失所致的进行性记忆丧失和全面的认知功能障碍为主要临床表现。其主要病变部位是与记忆有关的海马等结构,病理学改变是神经元内磷酸化的tau蛋白沉积形成的神经原纤维缠结及神经元外部的淀粉样β蛋白(Aβ)沉积形成的老年斑。进一步研究发现,在 AD 患者的脑组织、脑脊液和血液中,多种细胞因子如白细胞介素(IL)-1β、IL-6及肿瘤坏死因子(TNF)-α等都发生明显变化〔1〕。盐酸多奈哌齐(安理申)治疗轻、中度认知功能障碍的AD患者,可改善其记忆力、认知功能以及日常生活能力,已在近年来的多项研究中得到证实〔2〕。本研究通过观察轻、中度AD患者安理申治疗前后血清的IL-1β、IL-6、TNF-α水平,探讨其变化与认知功能障碍及日常生活能力变化的关系。
1资料与方法
1.1病例选择收集自2012年2月至2013年6月在山东大学齐鲁医院门诊、住院的轻中度AD患者36例,年龄58~89〔平均(65±10)〕岁,平均受教育年限(10±3)年。
1.2纳入及排除标准纳入标准:①年龄58~90岁,性别不限,均为非文盲;②以记忆障碍为主诉,病程超过6个月;③全部病例AD的诊断证据均符合精神疾病诊断与统计手册,第4版,修订版(DSM-Ⅳ-TR)的诊断标准;④全部病例均进行简易精神状态量表(MMSE)测试,得分12分 1.3对照组选择同期30例老年健康体检者。入组标准:①年龄58~90 岁,性别不限;②目前认知功能良好,MMSE>24分;③无严重的躯体疾病(高血压、高脂血症、糖尿病等);④否认二系三代有任何痴呆疾病遗传史。 1.4方法 1.4.1标本的收集所有受试者均在基线期及治疗后24 w时抽取清晨空腹肘静脉血5 ml,4 000 r/min 即时离心(离心半径=8 cm)10 min,取血清置于-80℃ 低温冰箱内冻存。 1.4.2评定方法(1)认知功能:采用简易精神状态量表(MMSE)、阿尔茨海默病评估量表认知次量表(ADAS-Cog)评价患者安理申治疗前后的定向力、计算力、注意力、记忆力、语言等方面的变化。(2)行为能力:采用阿尔茨海默病评估量表日常生活能力次量表行为量表(ADAS-ADL)评价患者治疗前后日常生活能力改变。以上量表均由一位经过培训的专业医师在治疗前、治疗后12 w、治疗后24 w进行评定。 1.4.3治疗方法36例AD患者给予安理申:起始剂量为2.5 mg,1 次/d,1 w后增至5 mg,1 次/d,连续用药24 w,治疗期间禁止服用其他促智类药以及影响血清炎性介质的药物,如非甾体抗炎药、他汀类药物等。 1.4.4血清IL-1β、IL-6、TNF-α的测定血清 IL-1β、IL-6、TNF-α采用酶联免疫吸附法(ELISA)测定,试剂盒由上海博谷生物科技有限公司提供。严格按照说明书规范操作。 1.5统计学处理采用SPSS17.0行t检验。 2结果 2.1患者治疗前后神经心理学测评成绩比较患者在安理申治疗后12 w,MMSE评分及ADAS-ADL评分较治疗前提高,ADAS-Cog评分较治疗前降低,但差异无统计学意义(分别为P=0.199,0.354,0.122)。治疗后24 w,MMSE评分及ADAS-ADL评分较治疗前提高,ADAS-Cog评分较治疗前降低(分别为P=0.003,0.011,0.005)。见表 1。 2.2患者安理申治疗前后血清炎性介质水平的比较患者治疗前血清IL-1β、IL-6、TNF-α水平均显著高于对照者(P<0.01);安理申治疗24 w后上述指标与治疗前相比显著降低(P=0.000,0.015,0.000),见表2。 2.3AD患者安理申治疗前后ADAS-Cog评分及各因子差值的比较AD患者安理申治疗后单词记忆及回忆测验、结构性练习、单词辨认方面较治疗前有显著改善(分别为P=0.004,0.018,0.001)。见表3。 表1治疗组患者治疗前后神经心理学测评评分比较(x±s,n=36) 心理测评项目治疗前治疗后12w治疗后24wMMSE总分17.06±2.6617.89±2.7919.16±2.861)ADAS-Cog总分22.37±3.9520.93±3.8219.73±3.712)ADAS-ADL总分67.11±2.8467.69±2.4669.22±2.503) 与V0时点比较:1)P=0.003,2)P=0.011,3)P=0.005 表2各组治疗前后血清IL-1β、IL-6、TNF-α水平的比较(x±s,pg/L) 组别nIL-1βIL-6TNF-α对照组300.24±0.131)62.34±37.481)152.66±10.731)治疗组36治疗前24w0.58±0.12229.45±168.78202.25±21.03治疗后24w0.38±0.112)153.61±71.283)168.29±17.014) 与治疗组V0时点比较:1)P<0.01,2)P=0.000,3)P=0.015,4)P=0.000 表3安理申治疗前后ADAS-Cog评分及各因子差值的比较(x±s,n=36,分) 项目治疗前治疗后24wP值ADAS-Cog评分22.37±3.9519.73±3.710.005单词记忆及回忆测验5.78±1.354.79±1.430.004物体命名0.89±0.520.83±0.450.629命令1.22±0.541.14±0.490.494结构性练习1.31±0.581.03±0.580.018意向性练习1.14±0.541.03±0.560.395定向力2.83±1.182.56±1.130.312单词辨认任务5.99±1.504.79±1.440.001语言能力及注意力5.17±1.035.22±1.050.821 3讨论 AD是一种不可逆的慢性退行性疾病,病因仍然不明确,患病率高、治疗效果不理想、预后差是该病的突出特点,据统计,该病影响全球约2 700万人,而每20年这个数字将翻一番〔3〕。AD患者中枢神经系统最具特征的神经生化方面的改变为大脑皮质、海马中乙酰胆碱的含量和胆碱乙酰转移酶的含量显著减少,而乙酰胆碱酯酶活性升高的现象,其改变程度与AD患者脑内老年斑沉积和神经原纤维缠结的严重程度有密切关系〔4〕。安理申是一种可逆的、相对特异性乙酰胆碱酯酶抑制剂,它可以有效地选择性抑制中枢神经系统内乙酰胆碱的降解,增加神经元突触间隙乙酰胆碱的浓度,近年来已有多项临床研究显示,安理申治疗轻、中度认知功能障碍的AD患者有一定的疗效,有助于延缓AD的病程,提高AD患者的生存质量〔5〕。 目前经正电子发射层扫描技术所做的脑成像研究发现,AD患者顶叶和额叶皮层,特别是在边缘皮层和联络皮层,Aβ的累积导致细胞间突触传递效能的降低,这种精细变化可持续存在多年,Aβ进一步累积才会形成神经炎斑块,即老年斑〔6〕。临床和实验证据表明,Aβ的神经毒性一方面产生炎性介质直接或间接损伤神经元,另一方面其诱导的氧化应激反应又可以加速淀粉样前体蛋白(APP)的水解,从而增加Aβ的生成,进一步增强Aβ的神经毒性作用〔7〕。近年来研究表明,老年斑周围不但出现了明显的神经退行性病变,还伴有小胶质细胞和星形胶质细胞的激活,提示AD患者脑内存在炎症反应〔8~11〕。当脑组织出现退行性变或损伤时,激活小胶质细胞,并在上调表面受体表达及参与清除凋亡细胞的同时增加自身的数量。小胶质细胞过度活化后,由其产生的大量炎性介质将最终导致细胞的死亡,同时炎症反应的强度也会大幅上升,而这些异常沉积的Aβ可能是炎症反应的起始动因〔12,13〕。起主要作用的炎性介质包括IL-1β、IL-6、TNF-α,其中IL-1β通过胆碱酯酶表达和活性调节影响AD的病程,其可能的作用机制是通过激活星形胶质细胞,上调 IL-6、TNF-α的表达,同时刺激APP的启动因子促进其表达,水解产生Aβ并沉积〔14,15〕。脑内高水平的IL-6可导致认知功能相关区域,如海马、颞叶、顶叶、额叶皮质出现明显的神经元退化〔16〕,同时,胆碱能神经通路的功能也受到严重损害。 本研究结果表明,轻、中度AD患者应用安理申治疗前血清的IL-1β、IL-6、TNF-α水平较对照组明显升高;经安理申治疗24 w后上述炎性介质水平与治疗前相比显著降低。本研究还发现,AD患者经安理申治疗后,MMSE评分及ADAS-ADL评分较治疗前提高,ADAS-Cog评分较治疗前降低,且在单词记忆及回忆测验、结构性练习、单词辨认等方面有显著改善,而患者血清IL-1β、IL-6、TNF-α水平呈下降趋势。可见,安理申能够改善轻、重度AD患者的认知功能及日常生活能力,尤其在记忆力、视空间能力等方面作用较为显著。 本研究结果显示,安理申作为乙酰胆碱酯酶抑制剂,不仅可以通过抑制中枢神经系统中乙酰胆碱的降解,增加神经细胞突触间隙乙酰胆碱的浓度,促进胆碱能神经通路功能恢复,从而改善近记忆障碍;还可能通过制炎症因子的表达,抗氧化、抗自由基损伤,减轻炎性介质的破坏作用,从而使APP水解产生的Aβ减少,减缓AD 的病理发展,达到延缓AD的进程,改善认知功能,提高患者的日常生活能力。 4参考文献 1Takeda S,Sato N,Ikimura K,etal.Increased blood-brain barrier vulnerability to systemic inflammation in an Alzheimer disease mouse model〔J〕.Neurobiol Aging,2013;34(8):2064-70. 2张淑萍,王昆祥,李凤君,等.安理申治疗阿尔茨海默病的临床研究〔J〕.黑龙江医药科学杂志,2010;33(5):33-4. 3Thies W,Bleiler L.Alzheimer’s disease facts and figures〔J〕.Alzheimers Dement,2011;7(2):208-44. 4Barrantes FJ,Borroni V,Vallés S,etal.Neuronal nicotinic acetylcholine receptor-cholesterol crosstalk in Alzheimer′s disease〔J〕.Front Membrane Biochem,2010;584(9):1856-63. 5Yang WN,Han H,Hu XD,etal.The effects of perindopril on cognitive impairment induced by D-galactose and aluminum trichloride via inhibition of acetylcholinesterase activity and oxidative stress〔J〕.Pharmacol Biochem Behav,2013;114-5(12):31-6. 6Tse D,Langston RF,Kakeyama M,etal.Schemas and memory consolidation〔J〕.Science,2007;316(5821):76-82. 7Tamagno E,Guglielmotto M,Aragno M,etal.Oxidative stress activates a positive feedback between the gamma and beta secretase cleavages of the beta amyloid precursor protein〔J〕.Neurochem,2008;104(3):683-95. 8Ongali B,Nicolakakis N.Transgenic mice over expressing APP and transforming growth factor-beta1 feature cognitive and vascular hallmarks of Alzheimer’s disease〔J〕.Am J Pathol,2010;177(6):3071-80. 9Chan KH,Lam KS,Cheng OY,etal.Adiponectin is protective against oxidative stress induced cytotoxicity in amyloid-beta neurotoxicity〔J〕.PLoS One,2012;7(12):e52354. 10张雪梅,柯开福,方小霞,等.Aβ1-42诱导阿尔茨海默病模型大鼠海马内细胞因子表达变化的研究〔J〕.天津医药杂志,2013;41(8):789-92. 11Lecanu L,Greeson J,Papadopoulos V.Beta amyloid and oxidative stress jointly induce neuronal death,amyloid deposits,gliosis,and memory impairment in the rat brain〔J〕.Pharmacology,2006;76(1):19-33. 12Meng QH,Lou FL,Hou WX,etal.Acetylpuerarin reduces inflammation and improves memory function in a rat model of Alzheimer′s disease induced by Abeta 1-42〔J〕.Pharmazie,2013;68(11):904-8. 13Sipos E,Kurunczi A,Kasza A,etal.β-amyloid pathology in the entorhinal cortex of rats cortex of rats induces memory deficits:implications for Alzheimer′s disease〔J〕.Neuroscience,2007;147(1):28-36. 14Passos GF,Medeiros R,Cheng D,etal.The bradykinin B1 receptor regulates Aβ deposition and neuroinflammation in Tg-SwDI mice〔J〕.Am J Pathol,2013;182(5):1740-9. 15Luccarini I,Grossi C,Traini C,etal.Aβ plaque-associated glial reaction as a determinant of apoptotic neuronal death and cortical gliogenesis:a study in APP mutant mice〔J〕.Neurosci Lett,2012;506(1):94-9. 16周思朗,陈俊抛,曹东林,等.碱性成纤维细胞生长因子影响痴呆大鼠海马神经发生〔J〕.中国现代医学杂志,2004;14(8):67-9. 〔2014-10-06修回〕 (编辑赵慧玲/曹梦园) 〔中图分类号〕R742.8 〔文献标识码〕A 〔文章编号〕1005-9202(2016)08-1871-03; doi:10.3969/j.issn.1005-9202.2016.08.039 通讯作者:王淑贞(1963-),女,主任医师,硕士,硕士生导师,主要从事脑血管病与老年期痴呆研究。 第一作者:白银(1988-),女,硕士,主要从事脑血管病与老年期痴呆研究。