铁代谢在大鼠缺血再灌注急性肾损伤后的变化
2016-06-01谢光亮张燕敏张倩楠
谢光亮 朱 琳 张燕敏 张倩楠 于 青
铁代谢在大鼠缺血再灌注急性肾损伤后的变化
谢光亮 朱 琳 张燕敏 张倩楠 于 青
目的:研究SD大鼠肾缺血再灌注损伤(IRI)后铁代谢的变化特点,探讨IRI后铁调素和铁代谢的变化及意义。 方法:雄性SD大鼠48只,随机分为对照组(n=6)和IRI模型组,模型组分别在IRI后1h、4h、8h、12h、16h、20h、24h 7个时间点(n=6/组),检测大鼠血生化及铁代谢指标,以及肝组织铁调素 mRNA和肾组织膜转铁蛋白1(FPN1)mRNA和蛋白的表达水平。 结果:与对照组相比,IRI组肾组织铁含量、血清铁、铁蛋白在再灌注早期升高(P<0.05),并随再灌注时间的延长逐渐下降。IRI组肝组织铁调素 mRNA表达水平在再灌注早期明显升高,再灌注4h达峰值后开始下降,而血清铁调素于再灌注8h后升高,并于再灌注16h达峰值后开始下降,两者在再灌注24h后仍高于对照组(P<0.05)。IRI组肾组织FPN1 mRNA和FPN1蛋白的表达水平随再灌注时间的延长逐渐下降,两者表达水平明显低于对照组(P<0.05)。 结论:大鼠肾脏IRI过程中伴有铁代谢的紊乱,铁调素和肾脏FPN1可能参与了IRI过程中铁稳态的调控。
铁调素 铁代谢 膜转铁蛋白 缺血再灌注 急性肾损伤
急性肾损伤(AKI)是临床常见疾病,缺血-再灌注损伤 (IRI)是AKI的常见原因之一。肾脏是一个高灌注器官,对缺血非常敏感,肾血管手术、肾移植、心脏停搏、低血压休克等均会导致不同程度的IRI[1],主要表现为肾脏缺血重新获得血供后,组织细胞损伤无明显减轻反而进一步加重的病理现象,其发生机制非常复杂,是导致肾衰竭和影响疾病预后的重要因素。因此,进一步研究IRI的发生及机体的反应机制,对了解IRI的发生发展,从而采取有效的防治措施有重要意义。
研究表明,肾脏是滤过和重吸收铁的重要器官[2],铁和铁介导的氧化应激反应在肾损伤中发挥重要作用,如亚铁离子有细胞毒性作用,对近端小管细胞的毒性作用尤为明显[3];铁能催化羟自由基的产生并促使脂质过氧化,从而导致氧化应激反应和组织损伤[4]。近年来,铁调素的发现为深入了解机体铁代谢的机制提供了新的途径。铁调素主要由肝细胞合成和分泌,通过与膜转铁蛋白1(FPN1)结合并引起FPN1的内化和降解来减少铁从铁输出体组织流向血浆中来实现对机体铁稳态的调控[5-6],被认为是维持机体铁稳态的核心要素,铁调素与铁的相互作用在慢性肾脏病贫血的相关研究也逐渐成熟,然而铁调素与铁代谢的变化及意义在IRI方面的研究较少,因此本研究通过IRI的动物模型,观察铁调素和铁代谢相关因素的变化特点,探索IRI后机体铁稳态的调控机制,为进一步研究及防治IRI提供理论机制依据。
对象和方法
研究对象 6周龄健康雄性SD(Sprague-Dawley)大鼠(清洁级)48只,体质量(200±20)g,随机分为8组:对照组(n=6)、IRI模型组,模型组分为IRI后1h、4h、8h、12h、16h、20h、24h 7组(n=6/组)。IRI组麻醉后切除右肾,用无创小血管夹夹闭左侧肾蒂45min后松开血管夹进行缺血后再灌注,逐层关腹[7],分别于再灌注1h、4h、8h、12h、16 h、20 h、24 h后取材;对照组按相同方法切除右肾,不夹闭肾蒂,暴露左肾45 min,关腹1h后取材。取大鼠静脉血3 000转离心15 min,收集上层血清分装后置-80 ℃保存;取左肾上部1/3置10%中性甲醛固定,留作组织学检查;肝组织、剩余左肾组织置液氮冷冻后于-80 ℃冰箱保存。
血生化及铁代谢指标检测 肌酐、尿素氮、血清铁、铁蛋白水平由本院检验科全自动生化分析仪检测。血清铁调素浓度用ELISA法(南京建成)检测,酶标仪(BIO-RAD)测定吸光度值计算其浓度。
肾组织铁含量检测 取冻存肾组织,加入0.9%生理盐水制成10%组织匀浆,BCA法测定匀浆液蛋白浓度,按组织铁检测试剂盒(南京建成)步骤进行操作,分光光度计(BIO-RAD)测定组织铁含量。
肾组织HE染色 肾组织经10%中性甲醛固定48h,乙醇阶梯脱水,石蜡包埋,4 μm厚石蜡切片,常规HE染色,光学显微镜观察各组大鼠肾组织病理变化。
RT-PCR法检测肝组织铁调素mRNA、肾组织FPN1 mRNA的表达 取冻存肝组织、肾组织,Trizol(Invitrogen)法提取总RNA,检测总RNA的浓度和纯度之后,按cDNA逆转录试剂盒(Takara)步骤逆转录合成cDNA。以β-actin为内参照,cDNA以相应特异性引物(上海生工)进行PCR扩增,引物为β-actin:上游5’AGGATGCAGAAGGAGATTACTGC3’,下游5’AAAACGCAGCTCAGTAACAGTGC3’;铁调素:上游5’TCTCCTGCTTCTCCTCCTG3’,下游5’TGTTATGCAACAGAGACCACA3’;FPN1:上游5’TTGCTGTTCTTTGCCTTAGTTGT3’,下游5’GAGGAGGCTGTTTCCGTAGAG3’。应用PCR仪(Applied Biosystems),按SYBRGreen 荧光定量PCR试剂(Takara)进行扩增,反应体系20 μl: SYBR Mixture 10 μl, Rox 0.4 μl,上游引物0.5 μl,下游引物0.5 μl,H2O 6.6 μl,cDNA 2.0 μL。扩增条件:95℃ 预变性2 min,(95℃ 5s,62℃ 30s,72℃ 15s)X40个循环,每个样本同时做3个重复。以β-actin作为内参基因计算各样本的相对表达量,相对表达量=2^-(Ct目的基因-Ct内参基因)。
Western Blot法检测大鼠肾组织FPN1蛋白表达 取冻存肾组织剪碎,加入RIPA+PMSF(Thermo Scientific)研磨成组织匀浆,13 000g离心5 min,取上清,BCA法测总蛋白浓度,调整样品浓度至4 μg/μl,煮沸变性10 min。SDS-PAGE分离蛋白,蛋白上样量40 μg/孔,电转移(BIO-RAD)300 mA恒定电流转膜90 min。5%脱脂奶粉封闭2h,加入1∶ 1 000稀释兔抗FPN1抗体(Abcam)、1∶ 1 000稀释 β-actin抗体(Abcam),4℃摇床过夜。次日用TBST洗膜3次,每次10 min,加入1∶ 5 000稀释羊抗兔二抗(碧云天),室温摇床90 min,TBST洗膜3次,每次10 min。ECL化学发光剂(Sigma)显影2 min,用目的蛋白与β-actin内参蛋白的灰度值比值计算各样品蛋白的相对表达水平。
免疫组织化学法检测肾组织FPN1蛋白的表达 石蜡切片常规脱蜡至水,微波修复抗原。3% H2O2阻断内源性过氧化物酶室温处理15 min。加封闭用正常山羊血清37℃孵育30 min。加兔抗大鼠FPN1抗体(1∶ 400)4℃孵育过夜。加生物素标记山羊抗兔二抗37℃孵育30 min。每个步骤均用PBS反复冲洗。加DAB显色,自来水冲洗,苏木精复染,封片。采用Image-pro plus 6.0软件对各组切片进行定量分析,每张切片选取4个200倍高倍镜视野,测定肾小管FPN1阳性染色累积光密度值(IOD)并做统计分析。
统计学分析 采用SPSS 19.0 软件进行数据处理,所得实验数据以均数±标准差表示,两组间比较采用两独立样本t检验,P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
肾功能和病理变化 IRI各组大鼠肌酐、尿素氮水平均明显高于对照组,差异有统计学意义(P<0.05),肾组织病理:对照组大鼠肾组织结构正常,IRI组大鼠随再灌注时间延长肾小管出现不同程度的变性、坏死、间质充血水肿等变化,肾小管上皮细胞刷状缘消失,肾小管腔扩张、管型形成。
血清铁、铁蛋白、铁调素浓度变化 IRI组大鼠血清铁在再灌注早期明显升高,随再灌注时间延长逐渐下降,其中IRI 1h、4h、8h、12h组血清铁水明显高于对照组,差异有统计学意义(P<0.05),IRI 16h、20h、24h组血清铁水平与对照组比较差异无统计学意义(P>0.05)。IRI组血清铁蛋白在再灌注4h时开始升高,并于再灌注16h时达高峰后开始下降,其中IRI 4h、8h、12h、16h、20h组铁蛋白水平高于对照组,差异有统计学意义(P<0.05),而IRI 1h、24h组与对照组比较差异无统计学意义。IRI组血清铁调素浓度在再灌注8h后开始明显升高,并于再灌注16h达高峰后开始下降,其中IRI 8h、12h、16h、20h、24h组血清铁调素浓度明显高于对照组(P<0.05),IRI 1h、4h组与对照组比较差异无统计学意义(表1)。
肾组织铁含量变化 IRI组大鼠肾组织铁含量出现升高,铁含量在再灌注1~8h期间逐渐上升,并于再灌注12h后开始下降。其中IRI 1h、4h、8h、12h、16h组肾组织铁含量明显高于对照组(P<0.05),IRI 20h、24h组与对照组比较无统计学意义(表1)。
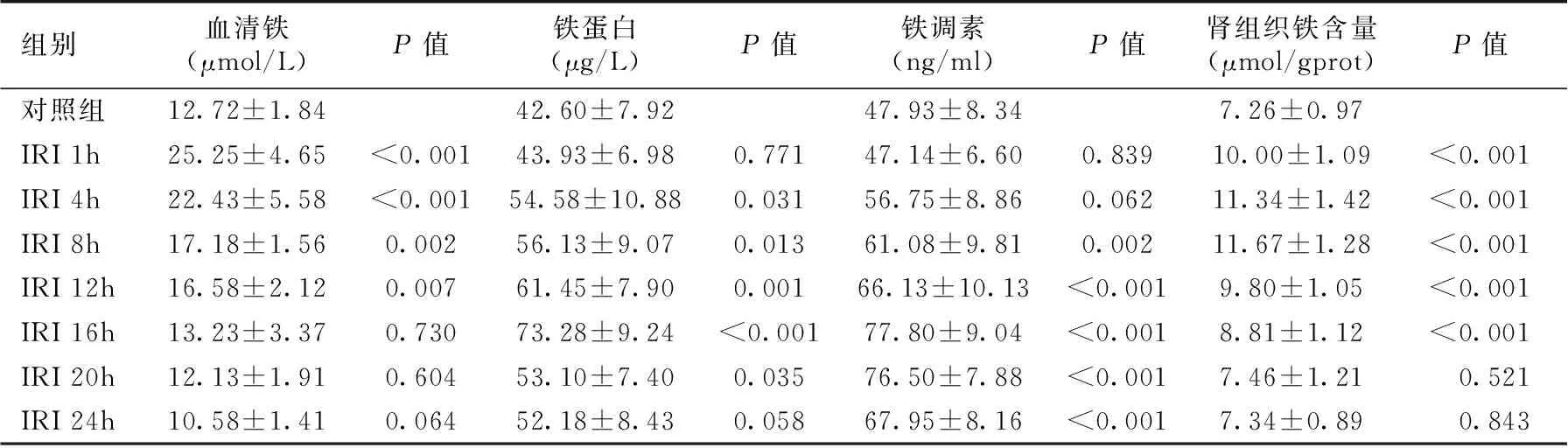
表1 各组大鼠血清铁、铁蛋白、铁调素、肾组织铁含量的比较
肝组织铁调素 mRNA、肾组织FPN1 mRNA表达分析 IRI组大鼠肝组织铁调素mRNA的表达水平于再灌注1~4h迅速增加,再灌注8h后缓慢下降,但在再灌注24h时仍高于对照组(P<0.05)(图 1)。IRI组肾组织FPN1 mRNA的表达水平在再灌注1~4h与对照组比较无统计学意义(P>0.05),再灌注8~24h则明显低于对照组(P<0.05),其中再灌注12~24h IRI组肾组织FPN1 mRNA的表达水平基本停止了继续下降的趋势(图2)。
肾组织FPN1蛋白表达分析 Western Blot显示,再灌注1h后IRI组大鼠肾组织FPN1蛋白表达量与对照组比较差异无统计学意义(P>0.05),再灌注4~24h IRI组FPN1蛋白的表达量低于对照组 (P<0.05)。随再灌注时间延长,IRI组肾组织FPN1蛋白的表达量逐渐下降,其中再灌注16h~24h FPN1蛋白的表达基本停止了继续下降的趋势(图 3)。免疫组化结果也显示,再灌注4~24h IRI组肾组织FPN1蛋白的IOD值低于对照组(P<0.05),且随再灌注时间延长IOD值逐渐下降(图4)。
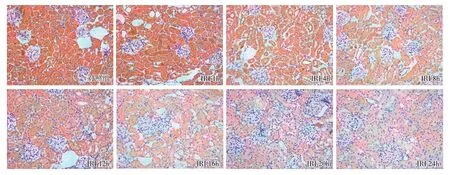
图4 各组大鼠肾组织FPN1蛋白表达(IH,×200)IRI:缺血-再灌注损伤;FPN1:膜转铁蛋白1
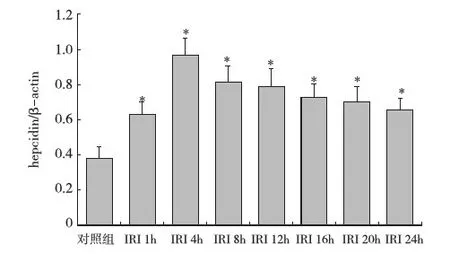
图1 各组大鼠肝组织铁调素 mRNA 表达(RT-PCR)IRI:缺血-再灌注损伤; hepcidin:铁调素;*:与对照组比较,P<0.05
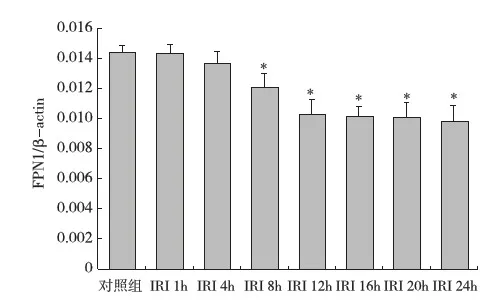
图2 各组大鼠肾组织FPN1 mRNA 表达(RT-PCR)IRI:缺血-再灌注损伤;FPN1:膜转铁蛋白1;*:与对照组比较,P<0.05
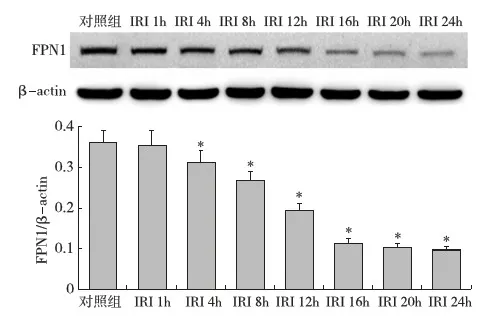
图3 各组大鼠肾组织FPN1蛋白表达(Western Blot)IRI:缺血-再灌注损伤;FPN1:膜转铁蛋白1;*:与对照组比较,P<0.05
讨 论
肾脏是一个高灌注器官,能表达多种铁代谢相关蛋白,在维持机体的铁平衡中发挥重要作用,易受IRI的损害。本研究中我们发现,IRI后肾组织铁含量升高伴组织损害,其原因可能是IRI后肾组织细胞发生了铁代谢紊乱、铁沉积增多,铁经直接和间接作用导致组织的进一步损伤[3-4,8]。有研究者针对脑缺血再灌注损伤的研究发现,脑损伤4h后即出现铁染色增强,并随损伤时间的延长而增多,脑总铁含量升高[9]。但缺血再灌注后铁代谢紊乱的机制尚不明确,有研究认为组织缺血缺氧后膜Na+-K+-ATP泵功能障碍导致溶酶体破坏释放蛋白水解酶破坏细胞,使胞浆中不稳定的低分子铁释放出来;再灌注诱导内皮细胞产生过量氮氧化物和超氧化物,形成过氧化氮,引起蛋白质结合铁的释放;另外,缺血缺氧时无氧代谢产生大量的NADPH,使Fe3+还原为Fe2+而从铁蛋白上释放出来[10]。铁离子的释放催化了自由基的产生,加剧了氧化应激的发生和铁代谢的紊乱。近年研究发现,铁螯合剂及降低铁相关氧化应激的抗氧化剂能一定程度改善IRI后的肾功能[11-12],间接说明了IRI发生了铁代谢紊乱及铁可导致组织细胞的损伤。
肾脏具有滤过和重吸收铁的功能,结合了转铁蛋白的铁被肾小球滤过后,经由膜铁转运蛋白辅助蛋白的帮助,通过FPN1返回血液循环系统,从而实现铁的重吸收[2,13]。FPN1是一种跨膜的铁输出蛋白,广泛分布于机体各组织中,在肾脏中主要定位于近端小管靠近基膜和顶部的胞质内,髓质小管也有FPN1的表达,是细胞铁释放的唯一通路[14-16]。在本研究中,IRI组大鼠血清铁水平和铁蛋白出现升高,原因可能是IRI后发生铁代谢紊乱,铁经肾脏FPN1转移到血液循环增多,且缺血缺氧时,血PH值降低使铁从转铁蛋白中释放并产生自由基,自由基促使更多的铁从转铁蛋白中释放[17],导致循环中铁的增加。但也有研究认为缺血缺氧可诱导转铁蛋白受体的表达增加从而引起循环铁增加[18],其确切机制尚不明确。
铁调素是近年发现的调控机体铁代谢的关键因素,在机体铁平衡中发挥重要作用[19]。研究证实,铁负荷超载可刺激铁调素的表达,缺铁可抑制铁调素的表达,这是机体维持铁稳态重要的负反馈机制[20]。我们发现,血清铁在IRI早期即明显增多,肝脏铁调素 mRNA表达水平在IRI早期也迅速上升;随再灌注时间的延长,血清铁缓慢下降,肝脏铁调素 mRNA的表达也缓慢下降,血清铁水平与肝脏铁调素 mRNA表达水平两者的变化趋势存在一致性,与Pigeon等[21]和韩巍等[22]的研究结论相似。尽管诸多研究证实了血清铁与肝脏铁调素 mRNA之间的关系,但两者间互相影响的机制尚不清楚。Babitt等[23]认为铁调节铁调素的表达与骨形态发生蛋白(BMP)、铁调素调节蛋白(HJV)有关,铁可能通过激活BMP6-HJV-SMAD信号传导通路诱导肝脏铁调素的表达,但也有研究者提出可能与HFE、TfR2、TfRl等因子的作用有关[24],其确切机制还需进一步研究。
FPN1是铁调素的靶分子,铁调素主要通过抑制FPN1mRNA的表达、与FPN1蛋白直接结合并起FPN1的内化和降解来减少铁从铁输出体组织流向血浆来实现对机体铁稳态的调控[5-6]。在本研究中,随再灌注时间的延长,大鼠肝脏铁调素 mRNA表达水平升高,分泌到血中的铁调素增多,而肾脏FPN1 mRNA和FPN1 蛋白的表达均明显下降,原因可能是IRI发生后,升高的血清铁调素水平下调了FPN1mRNA和FPN1 蛋白的表达,从而减少铁经肾脏进入循环系统。另一方面,铁调素对网状内皮组织的巨噬细胞铁的储存起正调控作用[13],升高的铁调素使网状内皮系统对循环铁的摄取增加,在以上两个因素共同作用下,最终使血清铁水平下降,以减轻铁对机体组织及肾脏的进一步损害。
我们还发现,大鼠血清铁调素水平在再灌注早期逐渐升高,并于再灌注20h后开始下降,但再灌注24h时仍明显高于对照组,而肾脏FPN1 mRNA和FPN1蛋白的表达水平分别于再灌注12h和16h后基本停止了继续下降的趋势,维持在较低的表达状态。有研究认为铁调素对FPN1 mRNA和FPN1 蛋白表达的调节作用是有限度的[22],铁调素不能完全阻止FPN1mRNA的表达,也不能完全使FPN1蛋白降解。在本研究中肾脏FPN1的变化可能是IRI发生后机体维持铁稳态的一种自我调节机制,血铁调素升高后肾脏FPN1仍能维持低程度的表达水平,从而维持铁经肾脏返回循环系统的功能,防止经肾脏滤过的铁丢失过多导致缺铁的发生。
总之,本研究结果初步表明,肾脏IRI伴有铁代谢的紊乱,表现为肾组织铁含量、血清铁、铁蛋白的系列变化,肝脏铁调素表达水平升高和血清铁调素的增加,以及肾脏FPN1表达的下降,提示铁调素和肾脏FPN1 可能参与了IRI过程中铁稳态的调控。肾脏IRI后铁调素及铁代谢的变化可能是机体为减轻IRI带来损害的一种保护作用,为进一步研究缺血再灌注急性肾损伤的防治提供了新思路。
1 Thurman JM.Triggers of inflammation after renal ischemia/reperfusion.Clin Immunol,2007,123(1):7-13.
2 Smith CP,Thévenod F.Iron transport and the kidney.Biochim Biophys Acta,2009,1790(7): 724-730.
3 Zager RA,Schimpf BA,Bredl CR,et al.Inorganic iron effects on in vitro hypoxic proximal renal tubular cell injury.J Clin Invest,1993,91(2): 702-708.
4 van Eijk LT,Heemskerk S,van der Pluijm RW,et al.The effect of iron loading and iron chelation on the innate immune response and subclinical organ injury during human endotoxemia: a randomized trail.Haematologica,2014,99(3):579-587.
5 Nemeth E,Tuttle MS,Powelson J,et al.Hepcidin regulates iron efflux by binding to ferroportin and inducing its internalization.Science,2004,306(5704):2090-2093.
6 Nemeth E,Rivera S,Gabayan V,et al.IL-6 mediates hypoferremia of inflammation by inducing the synthesis of the Iron regulatory hormone hepcidin.J Clin Invest,2004,113(9): 1271-1276.
7 Forbes JM,Hewitson TD,Becker GJ,et al.Ischemic acute renal failure: long-term histology of cell and matrix changes in the rat.Kidney Int,2000,57(6):2375-2385.
8 Liu H,Lo CR,Czaja MJ.NF-kappaB inhibition sensitizes hepatocytes to TNF-induced apoptosis through a sustained activation of JNK and c-Jun.Hepatology,2002,35(4):772-778.
9 Chi SI,Wang CK,Chen JJ,et al.Different regulation of H- and L-ferritin messenger RNA subunits,ferritin protein and iron following focal cerebral ischemia-reperfusion.Neuroscience,2000,100(3):475-484.
10 Kontos HA.Oxygen radicals in cerebral ischemia: the 2001 Willis lecture.Stroke,2001,32(11):2712-2716.
11 Al-Ismaili Z,Piccioni M,Zappitelli M.Rhabdomyolysis: pathogenesis of renal injury and management.Pediatr Nephrol,2011,26(10):1781-1788.
12 Walker VJ,Agarwal A.Targeting Iron Homeostasis in Acute Kidney Injury.Semin Nephrol,2016,36(1):62-70.
13 Yanatori I,Richardson DR,Imada K,et al.Iron Export through the Transporter Ferroportin 1 Is Modulated by the Iron Chaperone PCBP2.J Biol Chem,2016,291(33):17303-17318.
14 Abboud S,Haile DJ.A novel mammalian iron-regulated protein involved in intracellular iron metabolism.J Biol Chem,2000,275(26):19906-19912.
15 Veuthey T,D′Anna MC,Roque ME.Role of the kidney in iron homeostasis: renal expression of Prohepcidin,Ferroportin,and DMT1 in anemic mice.Am J Physiol Renal Physiol,2008,295(4):F1213-1221.
16 Nicolas G,Chauvet C,Viatte L,et al.The gene encoding the iron regulatory peptide hepcidin is regulated by anemia,hypoxia,and inflammation.J Clin Invest,2002,110(7):1037-1044.
17 Bracci R,Perrone S,Buonocore G.Red blood cell involvement in fetal/neonatal hypoxia.Biol Neonate,200l,79(3-4):210-212.
18 Bishop GM,Robinson SR.Quantitative analysis of cell death and ferritin expression in response to cortical iron:implplications for hypoxia-ischemia and stroke.Brain Res,2001,907(1-2):175-187.
19 Ganz T,Nemeth E.Iron Balance and the Role of Hepcidin in Chronic Kidney Disease.Semin Nephrol,2016,36(2):87-93.
20 Nicolas G,Bennoun M,Devaux I, et al.Lack of hepcidin gene expression and severe tissue iron overload in upstream stimulatory factor 2 (USF2) knockout mice.Proc Natl Acad Sci USA,2001,98(15):8780-8785.
21 Pigeon C,Ilyin G,Courselaud B,et al.A new mouse 1iver specific gene,encoding a protein homologous to human anlimicrobial peptide hepcidin,is over expressed during iron overload.J Biol Chem,2001,276(11):7811-7819.
22 韩巍,王朝旭,苏畅,等.高铁饲料对大鼠铁水平及hepcidinmRNA表达的影响.卫生研究,2014,37(4):474-476.
23 Babitt JL,Huang FW,Wrighting DM,et al.Bone morphogenetic protein signaling by hemojuvelin regulates hepcidin expression.Nat Genet,2006,38(5):53l-539.
24 Gao J,Chen J,Kramer M,et al.Interaction of the hereditary hemochromatosis protein HFE with transferrin receptor 2 is required for transferrin induced hepcidin expression.Cell Metab,2009,9(3):217-227.
(本文编辑 青 松)
Change of iron metabolism in rat after renal ischemia-reperfusion injury
XIEGuangliang,ZHULin,ZHANGYanmin,ZHANGQiannan,YUQing
DepartmentofNephrology,ShanghaiGeneralHospital,ShanghaiJiaotongUniversitySchoolofMedicine,Shanghai200080,China
Correspondingauthor:YUQing(E-mail:yuqingsl0618@163.com)
T Objective:To investigate iron metabolism in rat after renal ischemia-reperfusion injury (IRI), and probe into the change and significance of iron metabolism after renal IRI in rat. Methodology:A total of 48 Sprague-Dawley rats were randomly divided into IRI group (n=42) and control group (n=6).The rats in IRI group were also divided into seven subgroups (n=6 each):IRI 1h, IRI 4 h, IRI 8 h, IRI 12 h, IRI 16 h, IRI 20 h, and IRI 24 h. After the IRI model was established successfully, the blood biochemical and iron metabolism indexes, the expression level of hepcidin mRNA in the liver and ferroportin 1 (FPN1) mRNA and protein in the kidney were measured and analyzed. Results:Serum creatinine and blood urea nitrogen were time-dependent increased in the IRI group than those in the control group (P<0.05). Compared with the control group, renal iron content, serum iron and serum ferritin in the IRI group were increased early after renal ischemia reperfusion (P<0.05), and then declined. The expression level of hepcidin mRNA in the liver was significantly increased early after renal reperfusion, and the serum concentrations of hepcidin increased obviously since 8h after renal ischemia reperfusion in the IRI group (P<0.05). The expression level of FPN1 mRNA and FPN1 protein in the kidney was declined obviously after renal ischemia reperfusion in the IRI group (P<0.05). Conclusion:Iron metabolism disorder exists in rats during renal IRI, hepcidin in the liver and FPN1 in the kidney may participate in the regulation of iron homeostasis during renal IRI.
hepcidin iron metabolism ferroportin ischemia reperfusion acute kidney injury
10.3969/cndt.j.issn.1006-298X.2016.05.008
上海市科学技术委员会医学引导项目(14411963300)
上海交通大学附属第一人民医院肾内科(上海,200080)
于 青(E-mail:yuqingsl0618@163.com)
2016-07-11
ⓒ 2016年版权归《肾脏病与透析肾移植杂志》编辑部所有
