沙利度胺联合地塞米松治疗系统性轻链型淀粉样变性的临床观察
2016-06-01黄湘华任贵生王庆文陈文萃刘志红
赵 亮 黄湘华 李 婷 任贵生 王庆文 陈文萃 刘志红
沙利度胺联合地塞米松治疗系统性轻链型淀粉样变性的临床观察
赵 亮1黄湘华1李 婷2任贵生1王庆文1陈文萃1刘志红1
目的:评估沙利度胺联合地塞米松化疗方案对初次治疗的系统性轻链型(AL)淀粉样变性患者的疗效和安全性。 方法:回顾性分析2009年4月至2014年12月在南京军区南京总医院肾脏科确诊并采用沙利度胺联合地塞米松(TD)作为初次治疗方案的AL型淀粉样变性患者的临床及随访资料。应用Kaplan-Meier法计算患者生存时间,COX风险比例模型分析预后危险因素。 结果:本研究共纳入患者63例,男女比例为1.52∶ 1,中位年龄为57岁,中位治疗周期为19月(4~78月)。38例患者(60.3%)心脏受累,38例(60.3%)患者两个或以上的器官受累。37例患者取得血液学反应,总体血液学缓解率为58.7%,中位缓解时间为4月,其中18例(28.6%)达到完全缓解,中位缓解时间为3月,10例(15.9%)达到非常好的部分缓解,中位缓解时间为5.5月,9例(14.3%)达到部分缓解,中位缓解时间为5月。23例(36.5%)患者获得器官缓解,肾脏缓解和心脏缓解分别为23例(36.5%)和10例(15.9%),中位缓解时间分别为8.5月和18.8月。有3例患者病情复发,中位复发时间为7月(3~19月)。中位随访时间为28月,2年生存率为78.5%,K-M曲线估计的中位生存时间尚未达到。达到血液学缓解的患者组相比未达到血液学缓解的患者组预后更好(3年生存率87.5%vs36.3%,P<0.01) 心脏受累的患者组相比于无心脏受累患者组预后更差(3年生存率52.4%vs87.0%,P<0.01)。常见不良反应包括外周神经病变(23.8%)、胃肠道反应(17.4%)、乏力(11.1%)、皮疹(6.3%)等。9例患者因不良反应和治疗无效停药,12例患者沙利度胺减量,22例患者地塞米松减量。 结论:TD方案对初次治疗的AL淀粉样变性患者有一定的疗效,且耐受性较好,长期疗效有待进一步观察。
系统性轻链型淀粉样变性 沙利度胺 地塞米松 疗效 毒副作用
系统性轻链型(AL)淀粉样变性是最常见的一种系统性淀粉样变性,其发病是由于异常的单克隆浆细胞产生的游离轻链聚集形成淀粉样纤维沉积于多个组织与器官所致[1]。该病预后差,未经治疗的患者中位生存期仅为13月,约40%患者在确诊1年内死于严重器官受累[2-4]。接受化疗和(或)干细胞移植可明显提高患者生存率[5]。大剂量马法兰联合干细胞移植(HDM/ASCT)是最有效的治疗方案之一,接受治疗的患者总生存期为6.3年[6-8]。但仅有20%~25%的患者符合移植标准[9]。常用的联合化疗方案包括以烷化剂、蛋白酶体抑制剂和免疫调节剂为基础的方案。马法兰联合地塞米松(MD)方案曾被作为治疗AL淀粉样变性的标准方案[10-11]。以硼替佐米为代表的蛋白酶体抑制剂已成为一线治疗方案[12]。
沙利度胺是首个用于治疗AL淀粉样变性的免疫调节剂,有研究表明沙利度胺联合地塞米松(TD)方案治疗反应率48%,但毒副反应较大,且均用于治疗复发和难治性患者[13-14]。目前国内外缺乏TD方案初次治疗的疗效和毒副反应的报道。本研究回顾性分析63例初次治疗采用TD方案的AL淀粉样变性患者的相关资料,旨在探讨该方案的疗效和安全性。
对象和方法
研究对象 回顾性分析2009年4月至2014年12月在南京总医院肾脏科确诊并采用TD方案为初次治疗方案的AL型淀粉样变性患者63例,所有患者均以肾脏受累为首发表现,并通过肾活检和(或)皮肤脂肪活检、直肠黏膜活检确诊为AL型系统性淀粉样变性,器官受累评定依据文献[15]。
治疗方案 所有患者均为确诊后首次接受治疗,沙利度胺起始剂量为50 mg/晚,1周后未见不良反应加量至100 mg/晚,以此类推,最高剂量为200 mg/晚。地塞米松起始剂量为40 mg/周,28d为1个治疗周期。如果发生2级或2级以上的不良反应,则沙利度胺及地塞米松减量或停用。所有患者均采用该方案治疗4个疗程及以上,排除同时采用其他方案治疗的患者。
观察指标 确诊时所有患者均需检测血清肌酐、血清尿素氮、尿酸、白蛋白、碱性磷酸酶、血红蛋白(Hb)、24h尿蛋白定量、免疫固定电泳、血清游离轻链、N端前脑钠肽(NT-proBNP)、肌钙蛋白T(TnT)、肝脏右肋下最大斜径、室间隔厚度、左室射血分数、骨髓浆细胞比例等指标。心脏受累患者需定期检查心脏超声、NT-proBNP和TnT。
疗效及不良反应判定 缓解依据文献分为血液学缓解及器官缓解[16]。不良反应依据不良反应常见术语标准(CTCAE v4.0)。
统计学方法 采用SPSS 18.0统计学软件进行数据分析。正态分布的计量资料用均数±标准差描述,非正态分布的计量资料用中位数(四分位间距)描述,分类变量以率表示。利用Kaplan-Meier法计算患者的生存时间,组间对比采用Log-rank检验,采用单因素COX回归模型计算各个因素的风险比值(HR),并将单因素分析有显著差异的变量纳入多因素COX回归模型分析,进一步明确独立的预后因素。所有检验均为双侧检验,P<0.05为差异有统计学意义。
结 果
一般情况 本研究共纳入患者63例,其中男性38例,男女比例为1.52∶ 1,中位年龄为57岁(33~76岁)。其中κ型患者有10例,λ型53例,49.2%患者血清免疫固定电泳检出M蛋白,以λ型IgG和λ型IgA多见。患者均有肾脏受累,59例临床表现为肾病综合征,心脏受累38例(60.3%),肝脏受累1例,两个以上器官受累患者38例(60.3%)(表1),患者Mayo分级:1级11例(28.9%),2级9例(23.7%),3级18例(47.4%)。心脏相关指标:心脏射血分数65%(36%~77%),NT-proBNP 548 pg/ml (29~19 580 pg/ml),TnT 0.039 ng/ml (0.006~1.71 ng/ml),心脏室间隔厚度11.7 mm(11.7±3.1 mm)。
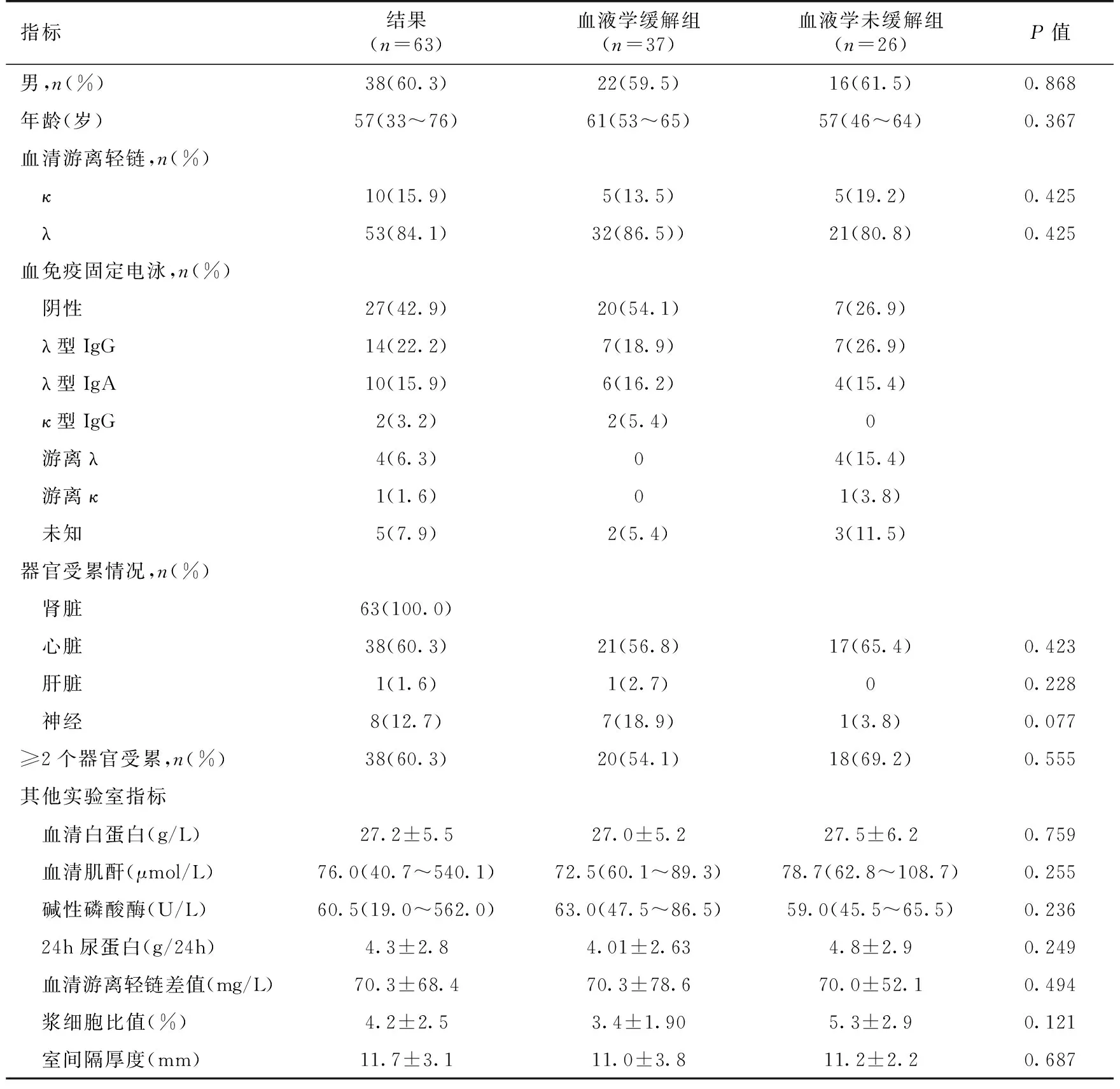
表1 63例患者的主要临床资料
疗效 37例患者达到不同程度血液学缓解,总体缓解率为58.7%,总体中位缓解时间为4月,其中18例(28.6%)达到完全缓解,中位缓解时间为3月,10例(15.9%)达到非常好的部分缓解,中位缓解时间为5.5月,9例(14.3%)达到部分缓解,中位缓解时间为5月。23例(35.5%)获得肾脏缓解,中位缓解时间为8.5月。10例(15.9%)获得心脏缓解,中位缓解时间为18.8月。Mayo分期1级、2级和3级血液学缓解率分别为72.7%(8/11),55.6%(5/9),38.9%(7/18),完全缓解率分别为18.2%(2/11),11.1%(1/9),16.7%(3/18)。血清肌酐、尿蛋白、轻链类型、白蛋白等基线资料在血液学缓解组和未缓解组组间对比中均没有显著意义。
预后 63例患者中位随访时间为28月,K-M曲线估计的中位生存时间尚未达到,2年生存率为78.5%。随访过程中死亡17例(27.0%),4例在TD方案治疗期间死亡,2例死于心功能不全(均有心脏淀粉样变性受累)、1例患有肝脏淀粉样变性、1例死亡原因不明;13例在停用TD方案治疗后死亡,8例死于心脏相关并发症(包括心律失常、心脏衰竭、低血压)、1例死于恶液质、1例因为原发病进展、3例死亡原因不明。心脏受累组较无心脏受累患者组预后差(P<0.01)(图1),两组估计3年生存率达分别为52.4%和87.0%(P<0.01)。血液学缓解组预后优于未达到血液学缓解组(P<0.01)(图1),两组估计3年生存率分别为87.5%和36.3%(P<0.01)。3例患者复发,中位复发时间为7月(3~19月)。

图1 A:总体生存曲线;B:总体无进展生存曲线;C:心脏受累组与心脏未受累组生存曲线;D:血液学缓解组与血液学未缓解组生存曲线
单因素分析表明心脏受累、NT-proBNP≥1 800 pg/ml与患者预后相关(表2),多因素分析表明NT-proBNP≥1 800 pg/ml(HR 7.941;95%CI 1.334~47.27,P=0.023)是患者不良预后的独立危险因素。
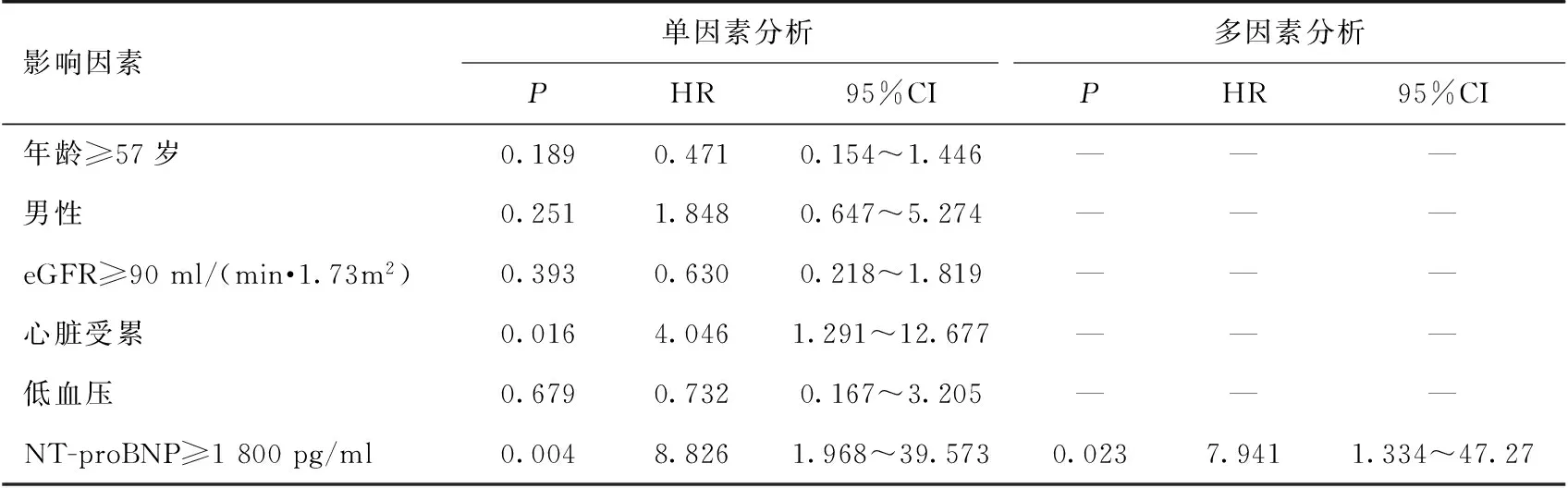
表2 生存预后影响因素分析
eGFR:估算的肾小球滤过率;NT-proBNP:N端前脑钠肽;低血压定义:收缩压<90 mmHg和或舒张压<60 mmHg
不良反应患者中位治疗周期为19月(4~78月)。37例(58.7%)出现不同程度的不良反应(表3),主要不良反应包括感觉神经病变15例(23.8%)及胃肠道反应11例(17.4%)。1级不良反应26例(41.3%),2级不良反应26例(41.3%),3级不良反应11例(17.4%),未见4级及以上不良反应(表3)。其中有9例因不良反应和(或)治疗无效停药,12例予沙利度胺减量,11例减量至50 mg/晚,1例减量至25 mg/晚, 22例予地塞米松减量,18例地塞米松减量至20 mg/周,6例地塞米松减量至10 mg/周。
讨 论
AL型淀粉样变性的发病是由于异常浆细胞克隆产生的轻链错折叠并沉积于组织和器官所致,因此,其治疗目标是快速、深度、持久地抑制异常浆细胞克隆,同时尽量减少治疗相关毒副作用,并通过支持治疗保护器官功能。其治疗方法由多发性骨髓瘤的治疗方案演变而来,包括HDM/ASCT和联合药物化疗。
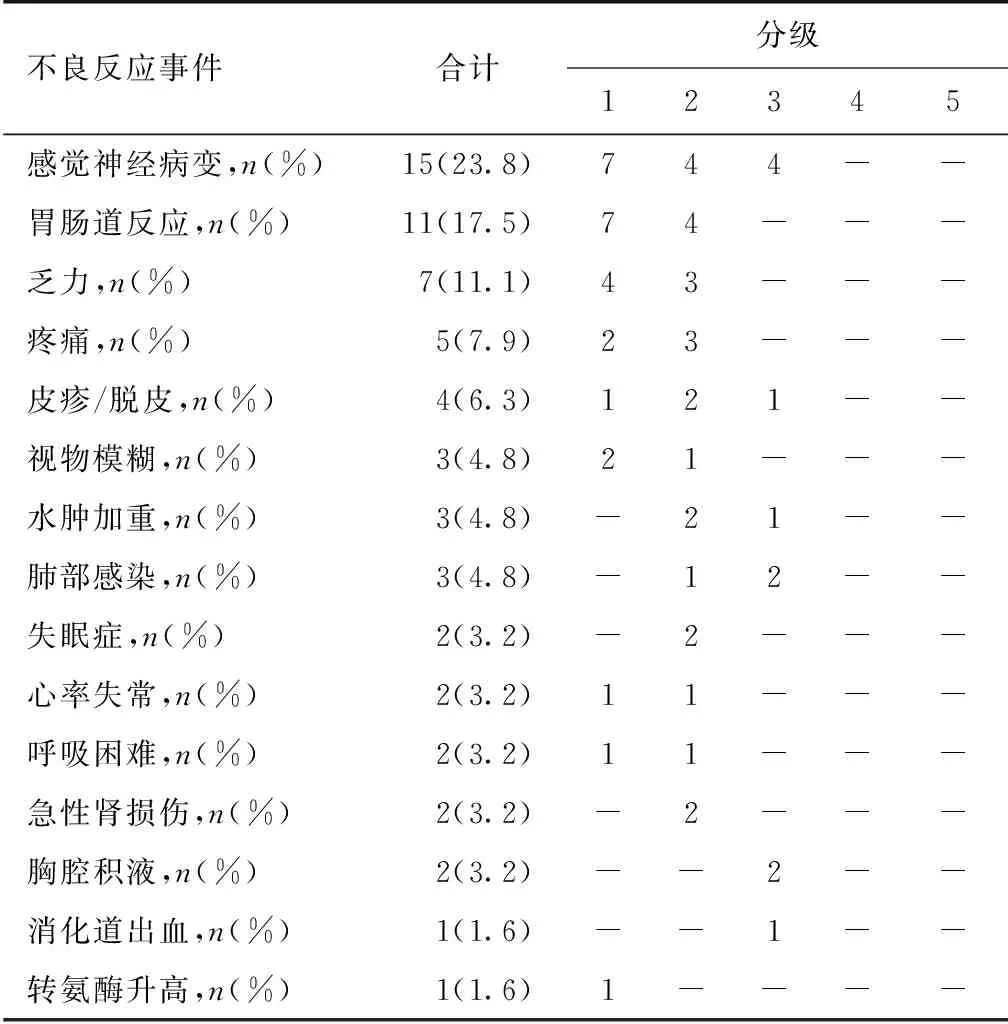
表3 沙利度胺联合地松方案化疗期间的主要不良反应
传统的口服马法兰联合泼尼松化疗方案(MP),总缓解率仅为28%,且起效时间长。马法兰联合地塞米松的化疗方案(MD),血液学缓解率达38%[10]。新药蛋白酶体抑制剂硼替佐米联合地塞米松的化疗方案(BD)取得不错的疗效,成为AL淀粉样变性的一线治疗方案,而BD联合自体外周血干细胞移植治疗能够进一步提高患者生存率[17]。本中心报道的72例患者采用BD方案化疗,3月的血液学缓解率达到75%,中位缓解时间为2月,神经毒性及胃肠道不良反应率与本组研究相当,血液学相关不良反应较本组研究较高,但BD方案治疗费用较高,部分患者经济条件无法耐受,所以在本中心治疗时选择TD方案[18]。
沙利度胺具有抗血管生成和促进浆细胞凋亡的作用。1999年,Singhal等[19]发现沙利度胺在用于治疗难治性及复发性多发性骨髓瘤中,治疗缓解率达30%,联合使用地塞米松化疗,进一步提高多发性骨髓瘤的缓解率[20],目前以沙利度胺为基础的治疗方案已被NCCN指南推荐作为治疗MM的备选方案之一[21]。
沙利度胺用于治疗AL淀粉样变性研究报道较少,且多作为二线治疗方案,治疗剂量尚无统一标准。本研究首次报道了TD方案用于AL淀粉样变性患者的初始治疗,总体缓解率高于Dispenzieri[13]、Palladini等[14]的报道。本研究缓解率高于文献报道的可能原因包括:(1)本研究的患者均为初次治疗患者,而国外研究多为一线治疗方案失败或者复发的患者。(2)本研究疗程较长,Dispenzieri等[13]研究中仅50%的患者治疗时间超过3月,Palladini等[14]报道的中位治疗时间仅为5.7月,而本组患者的中位治疗时间达到19月。本研究中绝大多数患者在6月之内获得血液学缓解,但也有9例患者在延长治疗时间(10~19月)取得血液学缓解,提示延长疗程可能提高缓解率。本组患者疗程较长的原因可能与沙利度胺单次用药剂量较低有关,本研究沙利度胺的最大剂量为200 mg/晚,而国外文献报道的最大剂量为400 mg/晚,导致部分患者无法耐受而在治疗的早期因不良反应减量或停药,影响缓解率。(3)在多发性骨髓瘤治疗中,TD方案相比沙利度胺单药方案的缓解率更高。本研究方案地塞米松中位剂量为40 mg/周,剂量多于Palladini等人研究[14],也是本组患者有效率提高的原因之一。
本研究单因素风险分析中,心脏受累和NT-proBNP≥1 800 pg/ml是影响预后的两个因素,而在多因素风险分析中,NT-proBNP≥1 800 pg/ml是唯一影响预后的独立危险因素,所以心脏受累严重性将严重影响患者预后,这与文献报道一致。
不良反应中感觉神经病变的发生率要高于Palladini等[14]的研究报道,其原因可能与人种差异以及治疗前部分患者已经存在外周神经病变相关,同时本组研究沙利度胺治疗时间长,累计剂量较大,亦可导致更多感觉神经病变。胃肠道、乏力等不良反应与Dispenzieri[13]和Palladini等[14]的报道的比例相近,本研究严重的不良反应人数明显较少,尤其是深静脉血栓并发症在本组研究中并未出现,可能与单次服用沙利度胺剂量较低(中位治疗量100 mg/d)以及预防性口服阿司匹林抗凝治疗相关。
本研究仍存在不足之处,(1)本研究为回顾性单中心研究,一些随访资料不完善的患者未纳入研究,存在一定的选择偏倚;(2)本研究的样本量较小,对危险因素分析结果可能存在影响;(3)所有患者均为门诊治疗,不良反应的记录可能被低估,且用药剂量调整依赖于定期随访,可能存在剂量调整不及时的情况。所以本方案的疗效及耐受性仍有待前瞻性多中心的研究进一步验证。
小结:TD方案对AL淀粉样变性的初次治疗有一定疗效。相对于自体外周血干细胞移植及其他化疗方案,费用较低,在经济压力较大的患者更易于接受,且口服给药方式有助于提高患者依从性。虽存在一定的不良反应,但绝大部分患者均能耐受,可作为不能行HDM/ASCT及BD方案化疗患者的备选方案。
1 Merlini G,Stone MJ.Dangerous small B-cell clones.Blood 2006,108(8):2520-2530.
2 Kyle RA,Gertz MA.Primary systemic amyloidosis—clinical and laboratory features in 474 cases.Semin Hematol,1995,32(1):45-59.
3 Haider S,Ahmad N,Anaissie E,et al.Future directions in the clinical management of amyloid light-chain amyloidosis.Leuk Lymphoma,2014,55(10):2241-2251.
4 Rosenzweig M,Giralt S,Landau H.Light-chain amyloidosis: SCT,novel agents and beyond.Bone Marrow Transplant,2013,48(8):1022-1027.
5 黄湘华,蒋松,史明君,等.原发性系统性淀粉样变性的预后及危险因素分析.肾脏病与透析肾移植杂志,2012,21(4):304-310.
6 Cibeira MT,Sanchorawala V,Seldin DC,et al.Outcome of AL amyloidosis after high-dose melphalan and autologous stem cell transplantation: long-term results in a series of 421 patients.Blood,2011,118(16):4346-4352.
7 黄湘华,王庆文,史明君,等.自体外周血干细胞移植治疗原发性系统性淀粉样变性.肾脏病与透析肾移植杂志,2011,20(4):312-318.
8 Mahmood S,Palladini G,Sanchorawala V,et al.Update on treatment of light chain amyloidosis.Haematologica,2014,99(2):209-221.
9 Gertz MA.Immunoglobulin light chain amyloidosis: 2014 update on diagnosis,prognosis,and treatment.Am J Hematol,2014,89(12):1132-1140.
10 Sanchorawala V,Seldin DC,Berk JL,et al.Oral Cyclic Melphalan and Dexamethasone for Patients With AL Amyloidosis.Clin Lymphoma Myeloma Leuk,2010,10(6):469-472.
11 Palladini G,Russo P,Nuvolone M,et al.Treatment with oral melphalan plus dexamethasone produces long-term remissions in AL amyloidosis.Blood,2007,110(2):787-788.
12 Kastritis E,Wechalekar AD,Dimopoulos MA,et al.Bortezomib with or without dexamethasone in primary systemic (light chain) amyloidosis.J Clin Oncol,2010,28(6):1031-1037.
13 Dispenzieri A,Lacy MQ,Rajkumar SV,et al.Poor tolerance to high doses of thalidomide in patients with primary systemic amyloidosis.Amyloid,2003,10(4):257-261.
14 Palladini G,Perfetti V,Perlini S,et al.The combination of thalidomide and intermediate-dose dexamethasone is an effective but toxic treatment for patients with primary amyloidosis (AL).Blood,2005,105(7):2949-2951.
15 Comenzo RL,Reece D,Palladini G,et al.Consensus guidelines for the conduct and reporting of clinical trials in systemic light-chain amyloidosis.Leukemia,2012,26(11):2317-2325.
16 Gillmore JD,Wechalekar A,Bird J,et al.Guidelines on the diagnosis and investigation of AL amyloidosis.Br J Haematol,2015,168(2):207-218.
17 Huang X,Wang Q,Chen W,et al.Induction therapy with bortezomib and dexamethasone followed by autologous stem cell transplantation versus autologous stem cell transplantation alone in the treatment of renal AL amyloidosis: a randomized controlled trial.BMC Med,2014,12:2.
18 Huang X,Wang Q,Chen W,et al.Bortezomib with dexamethasone as first-line treatment for AL amyloidosis with renal involvement.Amyloid,2016,23(1):51-57.
19 Singhal S,Mehta J,Desikan R,et al.Antitumor activity of thalidomide in refractory multiple myeloma.N Engl J Med,1999,341(21):1565-1571.
20 Dimopoulos MA,Anagnostopoulos A.Thalidomide in relapsed/refractory multiple myeloma: pivotal trials conducted outside the United States.Semin Hematol,2003,40(4 Suppl 4):8-16.
21 Anderson KC,Alsina M,Bensinger W,et al.Multiple myeloma,version 1.2013.J Natl Compr Canc Netw,2013,11(1):11-17.
(本文编辑 莫 非 凡 心)
Efficiency and safety of thalidomide combined with dexamethasone in patients with primary systemic amyloidosis
ZHAOLiang1,HUANGXianghua1,LITing2,RENGuisheng1,WANGQingwen1,CHENWencui1,LIUZhihong1
1NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China2SoutheastUniversitySchoolofMedicine,Nanjing210009,China
Correspondingauthor:LIUZhihong(E-mail:liuzhihong@nju.edu.cn)
T Objective:To evaluate the efficiency and safety of the regiment of thalidomide combined with dexamethasone in untreated primary systemic (AL) amyloidosis patients. Methodology:The clinical data of 63 patients diagnosed AL amyloidosis were retrospectively analyzed from April 2009 to December 2014. All of them were taken the regiment of thalidomide combined with dexamethasone as the first line treatment. Survival curves were constructed according to the Kaplan-Meier method. The relation of clinical factors to all-cause mortality was assessed using proportional hazards regression. Results:They were 38 males and 25 females with a median age of 57 ys. The cycle of treatment was 19 (4~78). 38 patients had heart involved, and 38 patients had also two more organs involved. In total, 37 patients (58.7%) achieve different hematological response, median time of response was 4 months; in which 18 patients (28.6%) achieve complete response, median time of response was 3 months; 10 patients (15.9%) achieve very good partial response, median time of response was 5.5 months; and 9 patients (14.3%) achieve partial response, median time of response was 5 months. There were 23 patients (36.5%) obtaining organ response, in which mainly was renal response, median time to organ response was 8.5 months, heart response rate were 15.9%, median time to organ response was 18.8 months. 3 patients had a relapse, median time to relapse was 7 months (3~19 months).The median follow-up period was 28 months, the survival rate at two years was 78.5%, and the median overall survival time did not reach. Compared to the non-hematological response group, the hematological response group has a better prognosis, prognosis of the heart involvement group was worse comparing to the non-heart involved group. Common adverse reaction was sensory neuropathy (23.8%), digestive tract reaction (17.4%), asthenia (11.1%), rash (6.3%) and so on, without treatment related mortality. 9 patients ended treatment for the adverse effects, dose of thalidomide was decreased in 12 patients, and dose of dexamethasone was decreased in 22 patients. Conclusion:The regiment of thalidomide combined with dexamethasone seems to be an effective and tolerant approach for the firstline treatment of AL amyloidosis, long-term efficacy is still needed to be observed.
AL amyloidosis thalidomide dexamethasone efficiency of treatment adverse reaction
10.3969/cndt.j.issn.1006-298X.2016.05.002
国家科技支撑计划课题(2013BAI09B04,2015BAI12B05),江苏省临床医学中心(BL2012007)
1南京大学医学院附属金陵医院(南京军区南京总医院)肾脏科 硕士研究生(赵 亮) 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016);2东南大学医学院
刘志红(E-mail:liuzhihong@nju.edu.cn)
2016-07-26
ⓒ 2016年版权归《肾脏病与透析肾移植杂志》编辑部所有
