肾脏科重症监护室患者中心静脉导管相关血流感染的临床特征与危险因素
2016-06-01成水芹许书添郭锦洲何群鹏李爱娟黄丽璇刘志红李世军
成水芹 许书添 郭锦洲 何群鹏 李爱娟 黄丽璇 刘志红 李世军
肾脏科重症监护室患者中心静脉导管相关血流感染的临床特征与危险因素
成水芹 许书添 郭锦洲 何群鹏 李爱娟 黄丽璇 刘志红 李世军
目的:了解肾脏科重症监护室(ICU)患者发生中心静脉导管相关血流感染(CRBSI)的临床特征与危险因素。 方法:收集南京军区南京总医院肾脏科ICU自2010年4月至2015年5月接受中心静脉置管连续性血液净化治疗(CRRT)的1 523例患者临床资料,分析CRBSI患者感染的流行病学和病原学特征。按1∶ 2比例随机选取非感染患者作为对照组,并进行危险因素分析。 结果:共有57例CRBSI患者纳入研究,感染发生率为3.7%,导管感染率为3.9/千日,中位导管留置日为14 d(7~30 d),发生CRBSI患者血培养检出的微生物以革兰阳性菌为主(50.9%),其次为革兰阴性菌(36.8%),其中最常见的为金黄色葡萄球菌(10例),阴沟肠杆菌(10例)和表皮葡萄球菌(9例)。置管部位为颈内静脉(33例)及股静脉(24例),分别占所有颈内静脉置管(1 140例)及股静脉置管(383例)的2.9%和6.3%。春、夏、秋、冬各个季节感染患者分别为16例(28.1%)、20例(35.1%)、7例(12.3%)、14例(24.6%)。感染时最常见的临床表现为寒战(68.4%)、发热(100%)及脓毒症休克(49.1%)。感染时中位CD4+淋巴细胞186(99~388)个/μl,APACHE Ⅱ评分20.4±5.11分。57例患者中最终有2例患者因脓毒症休克而死亡,余55例患者根据药敏结果合理选择抗生素体温在2d(1~3d)降至正常。感染组与对照组行危险因素分析结果提示:股静脉置管、导管留置时间长、CD4+淋巴细胞低、高APACHE Ⅱ评分为CRBSI的独立危险因素。 结论:我院肾脏科ICU患者CRBSI发生率3.7%,致病菌以革兰阳性球菌为主,但阴性杆菌有增加的趋势。导管感染夏季发生率最高,CRBSI与患者股静脉置管、导管留置时间长、免疫功能低下及高APACHE Ⅱ评分相关。了解CRBSI的常见病原菌及危险因素有助于CRBSI的预防与治疗。
中心静脉导管相关血流感染 流行病学特征 病原菌 危险因素
中心静脉留置导管在肾脏科重症监护室(ICU)患者中应用十分广泛,尤其对接受连续性血液净化治疗(CRRT)患者更是不可或缺,但伴随的导管相关血流感染(CRBSI)已成为临床上不可忽视的问题。随着导管防护意识的提高,CRBSI的发生率呈逐年下降的趋势[1],但仍是ICU患者院内血流感染的首要原因。中心静脉CRBSI显著增加患者的住院费用、延长住院时间及增加病死率[2],必须引起ICU医护人员的重视。有关中心静脉CRBSI临床研究不多,且样本量较小[3]。本研究观察南京军区南京总医院肾脏科ICU住院患者接受CRRT发生中心静脉CRBSI的病原学特征和危险因素,从而加深对中心静脉CRBSI的认识,提高防治水平。
对象和方法
研究对象 收集2010-04-01至2015-05-31在南京军区南京总医院肾脏科ICU接受中心静脉置管的CRRT患者的临床资料,中心静脉CRBSI组需符合下列标准[4-5]:(1)带有中心静脉内导管的患者出现菌血症或真菌血症,发热(>38℃)、寒战、伴/不伴低血压等感染表现;(2)除血管导管外没有其他明确的感染源;(3)实验室微生物学检查显示外周静脉血培养细菌或真菌阳性,或者从导管段和外周血培养出相同种类、相同药敏结果的致病菌。此外,按1∶ 2比例随机选取非感染组患者作为对照组。
临床资料 包括性别、年龄、临床表现、身高、体重、血压、原发病、季节、血糖、APACHE Ⅱ评分、CD4+细胞、IgG、ICU住院时间、导管留置时间、置管部位、是否外院置管、是否使用免疫抑制剂、是否接受血浆置换或双重血浆滤过治疗、是否死亡等。
观察指标定义 平均动脉压(MAP)=(收缩压-舒张压)/3+舒张压;体质量指数(BMI,kg/m2)=体重(kg)/身高2(m2);急性生理与慢性健康评估(APACHE) Ⅱ评分[6]:由急性生理学评分(APS)、年龄评分以及慢性健康状况评分(CPS)三部分组成,总分0~71分,得分越高,患者的病情就越重。
统计学方法 应用SPSS 17.0统计学软件进行数据分析,正态分布连续变量采用均数±标准差表示,组间比较采用t检验或方差分析;非正态分布连续变量采用中位数(四分位数间距)表示,组间比较采用Man-Whitney、Kruskal-Wallis检验;分类变量以率表示,组间比较采用Pearson卡方检验或Fisher精确概率检验。对相关危险因素采用单因素和多因素Logistic回归分析。P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
患者一般资料 本研究共纳入中心静脉留置导管患者1 523例,其中有57例患者确诊CRBSI,感染发生率为3.7%,导管感染率为3.9/千日,导管留置时间为7~30d不等,中位导管留置时间为14d,发生CRBSI患者血培养检出的微生物以革兰阳性菌为主,共29例(50.9%),革兰阴性菌21例(36.8%),真菌3例,革兰阳性合并阴性菌3例,革兰阴性菌合并真菌1例,其中最常见的病原菌为金黄色葡萄球菌(10例),阴沟肠杆菌(10例)和表皮葡萄球菌(9例),分别占17.5%、17.5%和15.8%(表1)。导管感染患者以男性居多,男性导管感染发生率为4.7%,女性导管感染发生率为2.68%。感染的平均年龄为(41±17.6)岁,置管部位为颈内静脉及股静脉,其中颈内静脉导管感染33例,占所有颈内静脉置管的2.9%,股静脉导管感染24例,占所有股静脉置管的6.3%。外院置管有28例,其中14例为股静脉留置导管,外院置管中有17例患者因CRBSI入院。春、夏、秋、冬各个季节感染患者分别为16例、20例、7例、14例,分别占28.1%、35.1%、12.3%、24.6%(表2、3)。

表1 CRBSI患者病原菌检测结果
CRBSI:导管相关血流感染
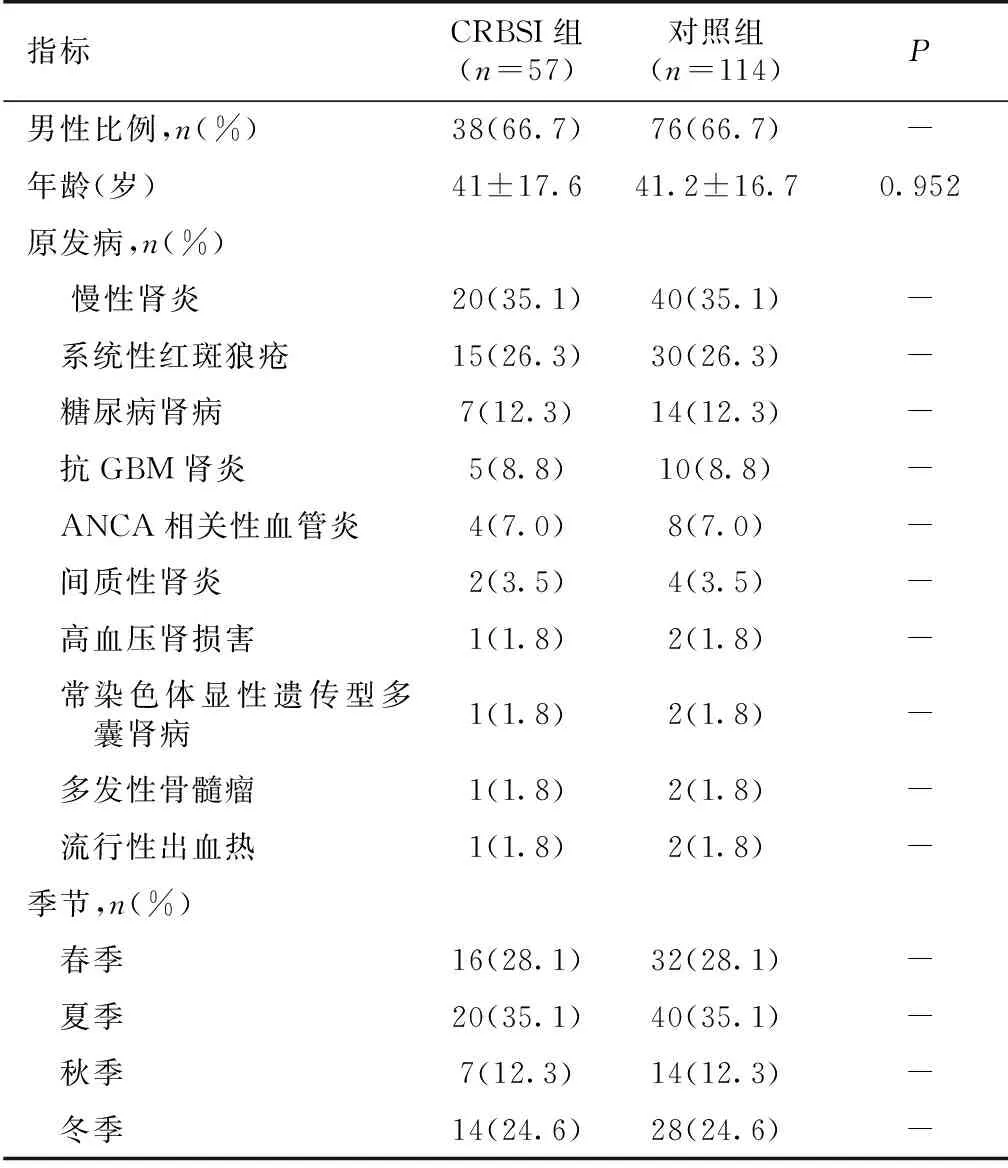
表2 CRBSI患者的一般资料
CRBSI:导管相关血流感染;GBM:肾小球基膜;ANCA:抗中性粒细胞胞质抗体
临床表现 57例CRBSI患者中41例患者在血液净化开始1h(0.5~2h)后出现感染症状,余16例患者在透析间期出现症状,感染时最常见的临床表现为寒战(68.4%)、发热(100%)及脓毒症休克(49.1%),体温(38.9±0.7)℃,MAP(83.4±22.2) mmHg,中位降钙素原21 mg/L(3.7~100 mg/L)。按1∶ 2比例随机选取114例非感染组作为对照组,使两组患者的年龄、性别、原发病及置管季节相匹配(表2),CRBSI组与对照组相比外院置管率高,股静脉置管率高,APACHE Ⅱ评分高,CD4+细胞低,MAP及BMI低,ICU住院时间长,两组死亡率并无显著性差异(表3)。
发生中心静脉CRBSI的危险因素 我们将表3中有统计学差异的因素用Logistic回归分析,单因素及多因素分析均可见股静脉置管、导管留置时间长、CD4+细胞低下、高APACHE Ⅱ评分为发生中心静脉留置CRBSI的危险因素(表4)。
治疗及转归 57例CRBSI组患者中45例患者在感染时立即拔除中心静脉导管,9例患者在感染后2.9±1.1天拔除导管,3例患者未拔管。所有患者均行血培养检查(导管血与外周血)及导管培养,根据药敏结果选择抗菌药物,以碳青霉烯类和喹诺酮类抗生素治疗为主。经积极对症及抗感染治疗后55例患者(包括3例未拔管的患者)感染症状均消失,体温在2d(1~3d)降至正常,2例患者最终因脓毒症休克死亡,其中1例患者为鲍曼不动杆菌感染,原发病为抗中性粒细胞胞质抗体(ANCA)相关性血管炎,另1例患者为金黄色葡萄球菌合并铜绿假单胞菌感染,原发病为系统性红斑狼疮,2例均为股静脉留置导管的男性患者,考虑死亡原因为CRBSI未控制,2例患者均在感染前使用大剂量免疫抑制剂,CD4+细胞低下。
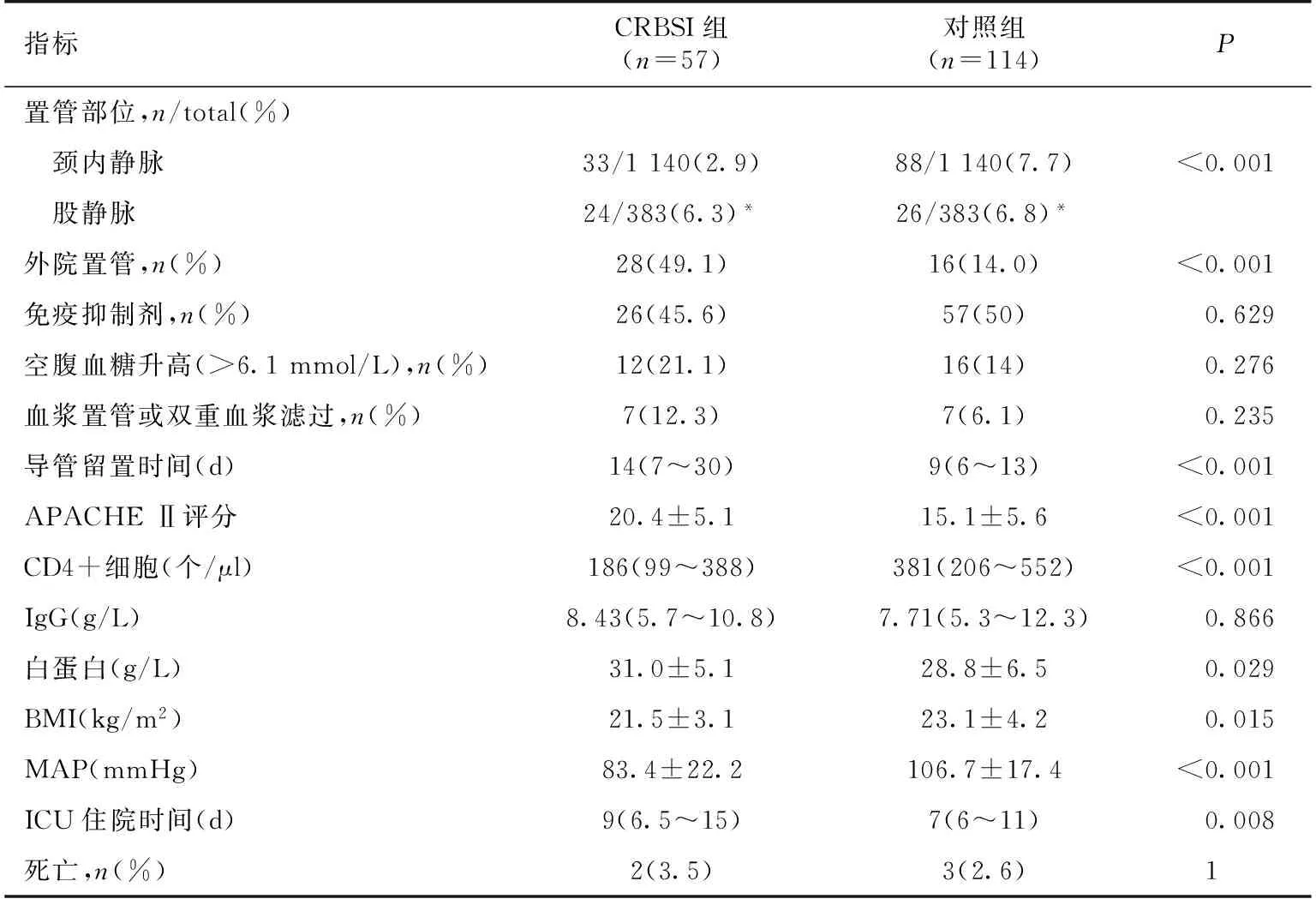
表3 留置CRBSI组与对照组患者一般资料的比较
CRBSI:导管相关性血流感染;APACHE Ⅱ:急性生理与慢性健康评估Ⅱ评分;BMI:体质量指数;MAP:中心静 脉压;ICU:重症监护室;*:股静脉置管与颈内静脉置管相比,P<0.001

表4 发生CRBSI的危险因素分析
CRBSI:导管相关血流感染;APACHE Ⅱ:急性生理与慢性健康评估Ⅱ评分
讨 论
中心静脉留置导管技术因其操作简单、安全、有效、创伤小、费用低等优势,现已成为肾脏科ICU必不可少的诊疗手段,尤其应用在需要CRRT的患者中,但随之而来的CRBSI已成为肾脏科ICU院内血流感染的首要原因,我中心肾脏科ICU中心静脉留置CRBSI感染发生率为3.7%,导管感染率为3.9/千日,显著低于Peng等[3]报道的11/千日和Rosenthal等[7]报道的6.8/千日,但与发达国家的0.27~1.65/千日仍有一定的差距[8-9]。
病原学分析显示,我中心CRBSI患者致病菌以革兰阳性菌为主,革兰阴性菌次之,真菌最为少见,与文献报道的相似[10-11]。近年来CRBSI患者的革兰阴性菌感染率呈逐年上升的趋势,甚至有超过革兰阳性菌的报道[12]。所有患者根据药敏结果合理选择抗菌药物,最终以碳青霉烯类和喹诺酮类抗生素抗感染为主,与Strasheim等[13]报道的相似。了解中心静脉CRBSI的病原菌分布及抗菌谱有助于早期诊治,尤其是在患者出现感染症状的早期阶段。
本研究中CRBSI组患者与对照组患者相比,在留置导管部位、导管留置时间、CD4+细胞和APACHE Ⅱ评分具有统计学差异,进一步风险回归分析证实上述指标为发生CRBSI的危险因素,多因素分析证实股静脉留置导管、导管留置时间较长、低CD4+细胞、高APACHE Ⅱ评分为发生中心静脉留置CRBSI的独立危险因素。中心静脉CRBSI更易发生在留置导管时间较长的患者中[3,14],Tao等[15]研究表明中心静脉导管留置时间超过14天为发生CRBSI的危险因素,与本研究结果一致。CRBSI的发生与患者的置管部位密切相关,既往研究均显示股静脉最易发生CRBSI[16-17],其次为颈内静脉,锁骨下静脉发生感染几率最小,股静脉易发生CRBSI的原因被认为是会阴部皮肤的定植菌较多,因此会阴部皮肤的清洁非常重要。Declercq等[18]研究表明HIV患者CD4+细胞<200个/μl更易发生CRBSI。Yehia等[19]分析显示CD4+细胞低下为HIV患者发生CRBSI的危险因素。APACHE Ⅱ评分反映患者疾病的严重程度,为发生中心静脉CRBSI的独立危险因素,因此,对免疫功能低下及危重症患者更需要加强预防,以减少感染发生率。
此外,应重视季节因素对中心静脉CRBSI的影响,本研究中夏季发生感染的几率最高,在该季节尤其是炎热出汗时,需注意加强置管部位皮肤消毒、清洁及干燥。临床工作中,发生中心静脉CRBSI后绝大多数患者立即拔除导管,但Schiffer等[20]研究表明未拔除导管的患者在积极抗感染后治疗有效,认为感染源并非明确为中心静脉留置导管,建议先积极抗感染治疗,如治疗无效再考虑拔除导管。我们在临床中尤其在血液净化过程中高度考虑患者为中心静脉CRBSI,有脓毒症休克症状时倡导立即拔除导管,如患者体温38℃~39℃,无明显寒战及低血压症状的CRBSI患者可暂时观察,待抗感染治疗后再决定是否拔除导管。
我院肾脏科ICU患者中心静脉CRBSI患者经积极抗感染治疗预后相对较好,住院死亡率仅3.5%,显著低于Hajjej等[21]报道的21.8%。Daniel等[22]总结了美国自1996年到2008年发生CRBSI约25万例患者的死亡率从7.6%降至5.9%。近年来随着操作技术的规范、导管材料的革新、避免肠外营养、及时拔管及合理使用抗生素等,感染死亡率逐渐下降,我中心严格按照上述要求,故感染死亡率较低,与对照组死亡率无统计学差异。
西班牙的学者Lorente 等[23]总结了氯己定-磺胺嘧啶银盐或利福平-咪康唑浸渍过的导管可使CRBSI感染率降至0%,使感染控制理念及行为有重大转变,Zacharioudakis等[24]Meta分析了23项关于抗生素封管预防中心静脉CRBSI的RCT研究,得出可使感染率降至1.15/千日以下。故CRBSI重在预防,我中心虽严格无菌操作、选择合适的导管材料、及时拔管等,但并未常规使用抗生素封管或抗生素浸渍导管等方法,可在今后临床工作中进行实践及观察,以实现中心静脉CRBSI的零感染率。
本研究为肾脏科ICU患者接受中心静脉置管行CRRT治疗的CRBSI流行病学及危险因素分析,而较多文献为外科ICU患者中心静脉置管,其不单单行血液净化治疗,相当一部分的患者行肠外营养治疗[3,25],且肠外营养相关的CRBSI感染率偏高。此外,其他ICU尤其是外科ICU患者的病情一般较重,常合并其他部位的感染,感染控制率与肾脏科ICU患者相比可能偏低。肾脏科ICU患者的一大特殊之处在于较多患者接受免疫抑制治疗,淋巴细胞偏低,我们分析得出CD4+细胞低下为中心静脉CRBSI的独立危险因素,而其他ICU尤其是外科ICU接受免疫抑制剂治疗的患者相对较少,且免疫抑制剂的剂量较小。目前尚无文献比较肾脏科ICU及其他ICU患者CRBSI的不同之处,可以在今后的临床实验中进行总结。
总之,我中心肾脏科ICU患者发生中心静脉CRBSI率为3.74%,致病菌以革兰阳性球菌为主。导管感染夏季发生率最高,且与患者置管部位、留置导管时间延长,免疫功能低下及高APACHE Ⅱ评分密切相关,中心静脉CRBSI经积极抗感染治疗预后相对较好。
1 Gahlot R,Nigam C,Kumar V,et al.Catheter-related bloodstream infections.Int J Crit Illn Inj Sci,2014,4(2):162-167.
2 Frasca D,Dahyot-Fizelier C,Mimoz O.Prevention of central venous catheter-related infection in the intensive care unit.Crit Care,2010,14(2):212.
3 Peng S,Lu Y.Clinical epidemiology of central venous catheter-related bloodstream infections in an intensive care unit in China.J Crit Care,2013,28(3):277-283.
4 O′Grady NP,Alexander M,Burns LA,et al.Guidelines for the prevention of intravascular catheter-related infections.Am J Infect Control,2011,39(4 Suppl 1):S1-34.
5 Parienti JJ,Mongardon N,Mégarbane B,et al.Intravascular Complications of Central Venous Catheterization by Insertion Site.N Engl J Med,2015,373(13):1220-1229.
6 Knaus WA,Draper EA,Wagner DP,et al.APACHE Ⅱ:a severity of disease classification system.Crit Care Med,1985,13(10):818-829.
7 Rosenthal VD,Bijie H,Maki DG,et al.International Nosocomial Infection Control Consortium (INICC) report,data summary of 36 countries,for 2004-2009.Am J Infect Control,2012,40(5):396-407.
9 Hammarskjöld F,Berg S,Hanberger H,et al.Sustained low incidence of central venous catheter-related infections over six years in a Swedish hospital with an active central venous catheter team.Am J Infect Control,2014,42(2):122-128.
10 Dreesen M,Foulon V,Spriet I,et al.Epidemiology of catheter-related infections in adult patients receiving home parenteral nutrition:a systematic review.Clin Nutr,2013,32(1):16-26.
11 Parameswaran R,Sherchan JB,Varma D M, et al.Intravascular catheter-related infections in an Indian tertiary care hospital.J Infect Dev Ctries ,2011,5(6):452-458.
12 Braun E,Hussein K,Geffen Y,et al.Predominance of Gram-negative bacilli among patients with catheter-related bloodstream infections.Clin Microbiol Infect, 2014,20(10):O627-629.
13 Strasheim W,Kock MM,Ueckermann V,et al.Surveillance of catheter-related infections:the supplementary role of the microbiology laboratory.BMC Infect Dis,2015,15:5.
14 Hosoglu S,Akalin S,Kidir V,et al.Prospective surveillance study for risk factors of central venous catheter-related bloodstream infections.Am J Infect Control,2004,32(3):131-134.
15 Tao F,Jiang R,Chen Y,et al.Risk factors for early onset of catheter-related bloodstream infection in an intensive care unit in China:a retrospective study.Med Sci Monit,2015,21:550-556.
16 Mermel LA,McCormick RD,Springman SR,et al.The pathogenesis and epidemiology of catheter-related infection with pulmonary artery Swan-Ganz catheters:a prospective study utilizing molecular subtyping.Am J Med,1991,91(3B):197S-205S.
17 Merrer J,De Jonghe B,Golliot F,et al.Complications of femoral and subclavian venous catheterization in critically ill patients:a randomized controlled trial.JAMA,2001,286(6):700-707.
18 Declercq S,De Munter P,Derdelinckx I,et al.Characteristics,causes,and outcome of 54 episodes of bloodstream infections in a cohort of HIV patients.Infect Dis (Lond),2015,47(9):611-617.
19 Yehia BR,Fleishman JA,Wilson L,et al.Incidence of and risk factors for bacteraemia in HIV-infected adults in the era of highly active antiretroviral therapy.HIV Med,2011,12(9):535-543.
20 Schiffer CA,Mangu PB,Wade JC,et al.Central venous catheter care for the patient with cancer:American Society of Clinical Oncology clinical practice guideline.J Clin Oncol ,2013,31(10):1357-1370.
21 Hajjej Z,Nasri M,Sellami W, et al.Incidence,risk factors and microbiology of central vascular catheter-related bloodstream infection in an intensive care unit.J Infect Chemother,2014,20(3):163-168.
22 Daniels KR,Frei CR.The United States′ progress toward eliminating catheter-related bloodstream infections:incidence,mortality,and hospital length of stay from 1996 to 2008.Am J Infect Control,2013,41(2):118-121.
23 Lorente L,Lecuona M,Jiménez A,et al.Chlorhexidine-silver sulfadiazine- or rifampicin-miconazole-impregnated venous catheters decrease the risk of catheter-related bloodstream infection similarly.Am J Infect Control,2016,44(1):50-53.
24 Zacharioudakis IM,Zervou FN,Arvanitis M,et al.Antimicrobial lock solutions as a method to prevent central line-associated bloodstream infections:a meta-analysis of randomized controlled trials.Clin Infect Dis,2014,59(12):1741-1749.
25 O′Connor A,Hanly AM,Francis E,et al.Catheter associated blood stream infections in patients receiving parenteral nutrition:a prospective study of 850 patients.J Clin Med Res,2013,5(1):18-21.
(本文编辑 书 实 凡 心)
Clinical characteristics and risk factor of central venous catheter-related bloodstream infection in renal ICU patients
CHENGShuiqin,XUShutian,GUOJinzhou,HEQunpeng,LIAijuan,HUANGLixuan,LIUZhihong,LIShijun
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
Correspondingauthor:LIShijun(E-mail:lisj8855@163.com)
T Objective:To analyze clinical characteristics and risk factor of central venous catheter-related bloodstream infection (CRBSI) in renal intensive care unit (ICU) patients. Methodology:One thousand five hundred and twenty three patients, who had central venous indwelling catheter for continuous renal replacement therapy from April 2010 to May 2015 in our center, were enrolled in this retrospective study. The clinical features and pathogens of CRBSI patients were investigated. The patients who also had CRRT of renal ICU hospitalization without CRBSI were enrolled in a 1∶ 2 ratio as control. The risk factors of the CRBSI were analyzed. Results:A total of 57 patients had central venous CRBSI, the incidence of infection was 3.7%, the mean rate of CRBSI was 3.9 per 1 000 catheter days, and the catheter indwelling time was 14 (7-30) days. The most common pathogens were Gram-positive bacteria, which had 29 cases (50.9%), followed by Gram-negative bacteria (36.8%). The commonest pathogens causing CRBSI were staphylococcus aureus (10 cases) and sewer enterobacteriaceae (10 cases), followed by epidermis staphylococcus (9 cases). Central venous catheter (CVC) insertion sites included the internal jugular (33 cases) and the femoral vein (24 cases), accounting for 2.9% of the internal jugular vein catheterization (1 140 cases) and 6.27 % of the femoral vein catheterization (383 cases), respectively. The cases of CRBSI were 16, 20, 7, and 14 in the seasons of spring, summer, autumn and winter, accounting for 28.1%, 35.1%, 12.3%, and 24.6% respectively. The most common infectious manifestations were chills fever(100%), (68.4%), and sepsis shock(49.1%). Only 2 patients died of sepsis shock, the other 55 patients’ infections were controlled eventually using intravenous antibiotics according to the results of drug susceptibility, and the temperature dropped to normal in 2 (1-3) days. Multivariate analysis showed that catheterization of femoral vein, the long catheter indwelling time, low CD4+ lymphocytes and high APACHE II score were independent factors associated with CRBSI. Conclusion:The incidence of CRBSI in our renal ICU was 3.74%, the pathogens showed that gram-positive bacteria were predominant, but gram-negative bacteria had a tendency to increase. Summer had a high prevalence of CRBSI. Central venous CRBSI was associated with catheterization of femoral vein, the long catheter indwelling time, compromised immune function and high APACHE II score. Understanding pathogens and risk factors of central venous CRBSI in renal ICU can help clinical doctors prevent and treat CRBSI earlier.
central venous catheter-related bloodstream infection epidemiologic feature pathogen risk factor
10.3969/cndt.j.issn.1006-298X.2016.05.006
国家自然科学基金(81270799)
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
李世军(E-mail:lisj8855@163.com)
2015-12-14
ⓒ 2016年版权归《肾脏病与透析肾移植杂志》编辑部所有
