膜性肾病合并新月体形成患者的临床及病理分析
2016-06-01王淑伟张丝雨马健飞王力宁栗霄立
王淑伟 张丝雨 刘 楠 陈 莹 马健飞 王力宁 栗霄立
膜性肾病合并新月体形成患者的临床及病理分析
王淑伟 张丝雨 刘 楠 陈 莹 马健飞 王力宁 栗霄立
目的:膜性肾病(MN)合并新月体形成的患者相对少见,除外继发性因素后更少有报道。本文将探讨此类患者的临床、病理特征和预后特点。 方法:回顾性分析我院肾活检提示MN且伴新月体形成患者,除外继发性因素,并在同期无新月体形成的特发性膜性肾病(IMN)患者中随机选取60例为对照组,比较两组患者临床和病理特征,并对观察组患者进行随访。 结果:15例MN伴新月体形成患者24h尿蛋白定量、肾功能不全比例、肾活检时血清肌酐水平、间质纤维化/小管萎缩(IFTA)及间质炎症细胞浸润程度均高于对照组,估算的肾小球滤过率(eGFR)、血红蛋白水平低于对照组,肾组织病理分期较对照组分期晚(P<0.05),3例患者在随访中发现继发因素。 结论:MN伴新月体形成是一类特殊的病理现象,临床和病理表现更为严重,需要在长期随访观察中排除全身系统性疾病的可能。
膜性肾病 新月体 临床病理
膜性肾病(MN)是常见的肾脏病理类型之一,既可为特发性,也可继发于自身免疫性疾病、感染、肿瘤、药物和重金属等其他疾病[1-2]。典型临床表现为大量蛋白尿,70%~80%患者为肾病综合征。MN预后差别较大,约1/3的患者可自发缓解,约1/3患者逐渐进展至终末期肾病(ESRD)[3-4]。典型的病理特征为肾小球基膜(GBM)上皮侧广泛免疫复合物沉积,足突融合,GBM增厚。
毛细血管内皮细胞增生、新月体和毛细血管袢坏死等病变在特发性膜性肾病(IMN)中极为少见。新月体是肾小囊腔内出现的细胞或其他有形成分,并挤压毛细血管袢[5],可见于各种病因导致的肾小球毛细血管壁严重损伤和断裂[6]。IMN与新月体等增殖性病变共存的现象临床相对少见,多见于MN合并抗中性粒细胞胞质抗体(ANCA)相关性血管炎、抗GBM肾炎以及与IgA肾病重叠发病时[7-13]。本研究筛选纳入15例该类患者,分析其临床表现特征、病理特点和预后,并与类似报道进行了比较分析。
对象和方法
研究对象 回顾性分析2009年8月至2015年10月于中国医科大学附属第一医院肾内科行肾活检,病理提示为MN的1 081例患者。入选标准:(1)肾活检病理提示MN同时可见新月体形成。(2)已除外引起继发性MN病因:自身免疫性疾病、病毒性肝炎、慢性感染、肿瘤、药物及重金属中毒等。(3)抗GBM抗体和ANCA阴性。符合以上标准的患者共15例(1.4%)。随机选取同期无新月体形成肾组织磷脂酶A2受体(PLA2R)阳性的IMN患者60例为对照组。
研究方法
临床资料与实验室指标 统计患者性别、年龄、肾功能、血清肌酐、血清白蛋白、ANCA、抗GBM、ANA、补体、24h尿蛋白定量、尿沉渣红细胞计数、尿N-乙酰-β-D-氨基葡萄糖苷酶(NAG)。根据CKD-EPI公式评估肾小球滤过率(eGFR)。
病理检查 超声引导下经皮肾活检,光镜组织经10%甲醛固定、石蜡包埋,连续切片。常规行HE、PAS、PASM和Masson染色。免疫荧光组织采用直接法行IgG、IgG亚型、IgA、IgM、C3、C4、 Clq、Fibrin染色。间接法行肾组织PLA2R和THSD7A染色。强度分级采用0~3+。肾组织肾间质纤维化/小管萎缩(IFTA)和肾间质炎症细胞浸润评分采用半定量法。
相关定义 肾病范围蛋白尿:尿蛋白定量>3.5 g/24h。血尿:尿沉渣显微镜检查红细胞>3个/高倍镜视野。低白蛋白血症:血清白蛋白<30 g/L。肾病综合征:肾病范围蛋白尿,低白蛋白血症。完全缓解:尿蛋白定量≤0.3 g/24h。部分缓解定义:24h尿蛋白定量较基线下降≥50%,但绝对值>0.3 g/24h。肾功能不全:eGFR<60 mL/(min·1.73 m2)。终末期肾病(ESRD):eGFR<15 mL/(min·1.73m2) 或需要持续性肾替代治疗。
统计学方法 使用SPSS 17. 0对相关数据进行统计学分析。正态分布计量资料以均数±标准差表示,采用t检验;非正态分布数据以中位数(范围)表示,非正态分布计量资料和等级资料采用秩和检验。样本率比较采用χ2检验,频数<1时或>20%理论频数<5采用Fisher确切概率法。P<0.05为差异有统计学意义。
结 果
临床和实验室特征 纳入研究的15例MN合并新月体患者中,男8例、女7例,均表现为蛋白尿,尿蛋白定量高于对照组。肾病范围蛋白尿14例(93.3%),低白蛋白患者13例(86.7%),肾病综合征12例(80.0%)。所有患者均伴有血尿,其中1例表现为肉眼血尿,但与对照组比较差异无统计学意义(P=0.29)。肾活检时合并肾功能不全比例、血清肌酐均高于对照组。血红蛋白、eGFR低于对照组。两组血白蛋白、尿NAG和尿氨基酸比较无差异(表1)。
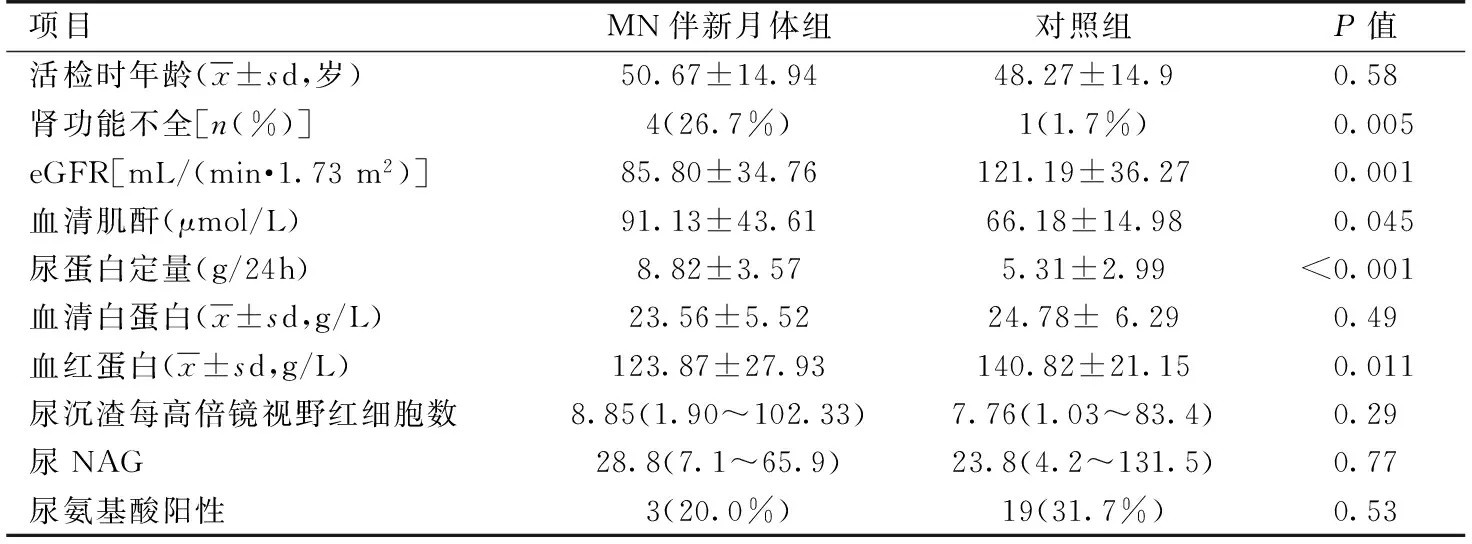
表1 膜性肾病伴新月体形成患者与对照组实验室指标比较
eGFR:估算的肾小球滤过率;NAG:N-乙酰-β-D-氨基葡萄糖苷酶
病理特征 观察组光镜组织平均肾小球数(15.13±5.13)个,均表现GBM弥漫钉突状形成,可见链环状改变4例。新月体形成肾小球比例中位数为7%(4%~38%)。未见GBM断裂,1例患者见纤维素样坏死。4例(27%)患者可见系膜细胞及系膜基质轻度增生。未见内皮细胞增生。13例肾组织PLA2R染色阳性。对照组肾组织PLA2R染色均为阳性。IFTA和间质炎症细胞浸润程度均高于对照组(P<0.001)。免疫荧光以IgG(100%)和C3(87%)沉积为主,11例(73%)以IgG4沉积为主。组织病理分期较对照组分期晚(P=0.005)(表2,图1、2)。
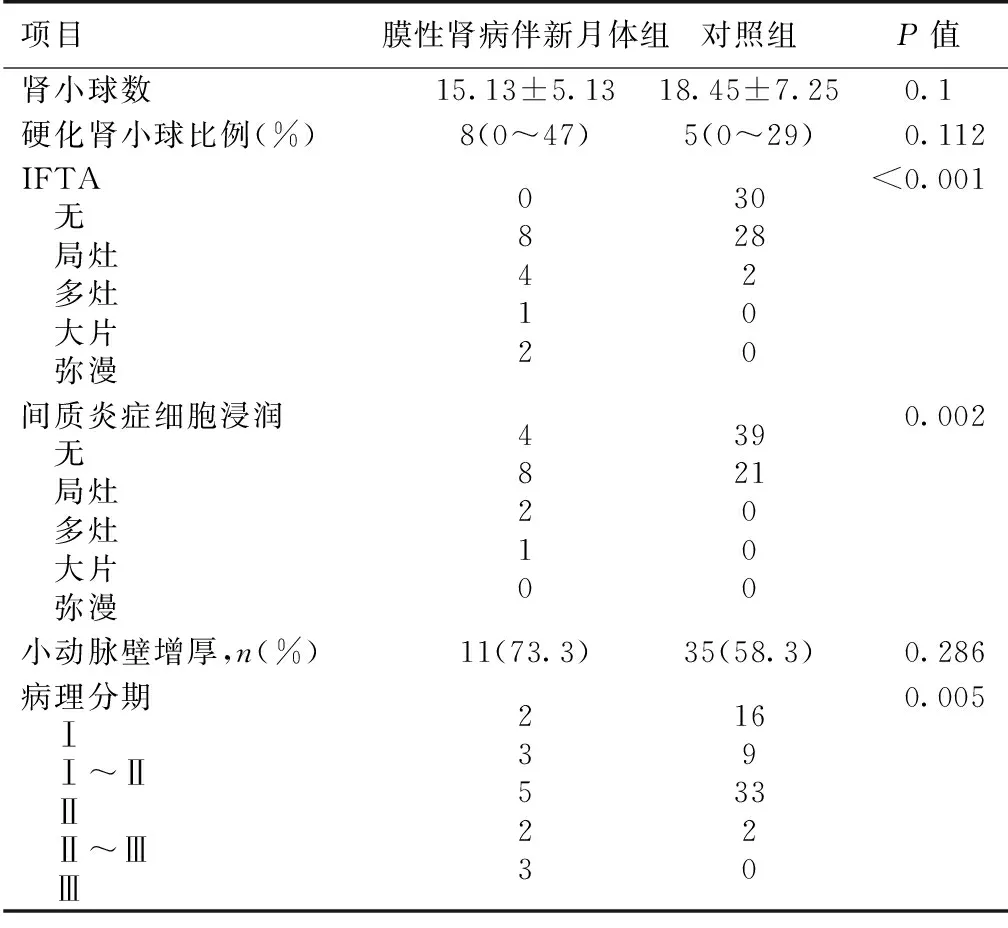
表2 膜性肾病伴新月体形成患者与对照组病理比较
IFTA:间质纤维化/小管萎缩
治疗与随访 观察组患者随访中位数为11个月(1~62个月)。应用强的松联合环磷酰胺静脉冲击治疗8例,联合吗替麦考酚酯3例,联合他克莫司1例,联合雷公藤1例。1例单用激素,1例单用雷公藤治疗。12个月完全缓解2例,部分缓解7例。11例患者尿蛋白定量仍>1 g/24h。2例肾功能恶化并进展至ESRD。例4应用强的松联合环磷酰胺静脉冲击治疗7个月无缓解后改用小剂量强的松联合他克莫司口服,2个月后达到完全缓解,肾功能维持正常范围。例15在环磷酰胺2g后出现严重肝损害(谷丙转氨酶700 IU/L)停药。例6和例9发现下肢血栓。例12在肾活检1年后出现脑梗塞,左侧肢体活动受限。
例12患者在随访中出现关节疼痛,口干、眼干,ANA 1:80,抗ds-DNA阴性,偶有抗SSA阳性,临床上不能除外系统性红斑狼疮。例10在肾活检3年后确诊肝癌。例14在肾活检(PLA2R++)1个月后怀疑消化道肿瘤,且出现pANCA阳性,ANA 1:80阳性,抗SSA阳性,出现肾功能急性恶化,严重心力衰竭,行血液透析治疗。余12例患者随访中暂未发现继发病因。
讨 论
MN典型病理特征为GBM上皮侧免疫复合物沉积,足突融合消失,伴GBM增厚。新月体是肾小球增殖性病变之一,见于ANCA相关性血管炎、抗GBM急进性肾炎、免疫复合物性新月体肾炎及系统性红斑狼疮等。

图1 病例1肾组织病理A: 肾小球基膜增厚,上皮侧见钉突形成,细胞性大新月体形成(PAS,×200);B: IgG(+++)沿肾小球毛细血管壁细颗粒状沉积(IF,×200);C: IgG4(+++)沿肾小球毛细血管壁呈细颗粒状沉积(IF,×200);D: PLA2R(++)沿肾小球毛细血管壁细颗粒状沉积(IF,×200)

图2 病例14患者肾组织病理A: 肾小球基膜弥漫性增厚,弥漫钉突形成,细胞纤维性新月体形成(PAS,200);B: 肾小球基膜上皮侧嗜复红蛋白沉积,细胞纤维性新月体形成(Masson,×200);C: IgG(+++)沿肾小球毛细血管壁细颗粒状沉积(IF,×200);D: PLA2R(++)沿肾小球毛细血管壁细颗粒状沉积(IF,×200)
由于病理形成机制的不同,IMN中罕见新月体形成。当在MN患者肾活检病理出现新月体性病变时首先应考虑是否为Ⅴ型或者Ⅲ+Ⅴ、Ⅳ+Ⅴ型狼疮性肾炎[10]。除外系统性红斑狼疮,少数文献报道了MN合并各种类型新月体性肾小球肾炎的情况[7-9,11-12]。
本研究中15例伴新月体形成的MN,在住院期间通过追溯病史和全面检查,均排除了继发性MN的常见原因。与对照组比较,患者24h尿蛋白定量、肾活检时血清肌酐值及肾功能不全比例均高于对照组。血红蛋白、eGFR低于对照组。组织病理分期较对照组分期晚,IFTA、间质炎症细胞浸润较对照组明显,表明该患者患者的临床和病理表现更为严重。
Rodriguez等[14]报道的19例MN合并新月体形成患者,临床上表现为明显的蛋白尿,均有血尿,84%患者活检时即有肾功能损伤。新月体肾小球比例25%,7例系膜细胞轻度增生,IFTA轻度15例,中度4例,重度1例,间质炎症细胞浸润不明显。MN-Ⅱ期及以上者例16例(84%),4例患者在肾活检后9个月内进展至ESRD。本研究结果与其报道的研究结果类似。不同的是本研究目前共只有2例患者进展至ESRD,预后相对较好[2/15(13%)vs4/19(21%),可能与本组患者新月体肾小球比例中位数为7%(4%~38%),明显低于Rodriguez等[14]报道的新月体肾小球比例,以及本组患者随访时间相对较短有关。
PLA2R是表达于足细胞表面的特异性抗原,在IMN肾组织中敏感性75% (95%CI 65%~84%),特异性83% (95% CI 72%~90%)[15],目前已作为IMN标志性受体。而IgG4与IMN的发病机制和病理损害密切相关[16],文献报道IMN中IgG1及IgG4均可表达,但lgG4表达明显高于IgGl[17-18]。管音[19]等报道肾小球IgG4亚型诊断IMN的灵敏度89.8%,特异度52.3%;PLA2R与IgG4亚型共阳性的灵敏度59.3%,特异度100%。本研究MN伴新月体形成患者肾组织PLA2R染色13例(13/15,87%)为阳性。以IgG4亚型为主11(73%)例。随访中12(80%)例患者均未发现继发病因。Rodriguez等[14]报道的病例中38%PLA2R阳性,随访中16(84%)例患者未发现继发病因。
IMN病程进展相对缓慢,有较高的自发缓解率,临床治疗方法在国内外仍存在不同观点[3]。我们观察的15例患者主要应用强的松或联合免疫抑制剂(环磷酰胺、他克莫司或吗替麦考酚酯)治疗。12个月内尿蛋白缓解率60%(9/15),大多数患者(13/15,87%)肾功能改善或无恶化。2例(13%)患者进展至ESRD。值得注意的是1例患者(例4)应用强的松联合环磷酰胺静脉冲击治疗7个月无缓解后改用小剂量强的松联合他克莫司口服,2个月后达到完全缓解。既往多篇文献报道他克莫司对MN尿蛋白缓解效果较好,对激素及环磷酰胺不敏感的病例仍有比较高的缓解率[20-22]。本研究也观察到类似结果。
值得关注的是,本研究中1例患者(例14)临床上为肾病综合征表现,病理提示MN,免疫荧光PLA2R(++),以IgG4亚型沉积为主,高度怀疑IMN。但是肾活检1个月后怀疑消化道肿瘤,且pANCA阳性,ANA 1:80阳性,抗SSA阳性,后出现急进性肾功能不全,最终进展至ESRD。1例患者(病例10)肾活检3年后发现肝癌。1例(例12)患者肾活检6个月后临床上不能除外系统性红斑狼疮。因此,对于该类患者应注意排查继发性因素或合并其他新月体性肾小球疾病的证据,并需长期随访关注可能的继发因素。管音等[19]观察到部分MN患者活检时即存在明确的继发性病因,但血清抗PLA2R抗体和肾小球IgG4又同时呈阳性。Larsen等[15]发现部分诊断为丙肝相关性MN、类肉瘤相关MN和肿瘤相关性MN患者肾组织PLA2R和IgG4均为阳性。因此,这类临床诊断为继发性MN的患者是否存在原发性MN合并其他疾病的可能,对于此类患者是以治疗继发因素为主还是按IMN治疗更好,这需要引起临床研究者注意。
综上所述,MN合并新月体患者蛋白尿和肾功能损害更明显,贫血较重。肾脏病理除了新月体形成,可见较严重的肾小管间质损伤及炎症细胞浸润,而且病理分期较晚。目前可以认为至少部分MN合并新月体形成的患者为IMN,可能是较特殊的一种病理类型。这类患者需要长期观察随访,排查继发因素。
1 Ronco P,Debiec H.Antigen identification in membranous nephropathy moves toward targeted monitoring and new therapy.J Am Soc Nephrol,2010,21(4):564-569.
2 Glassock RJ.The pathogenesis of membranous nephropathy:evolution and revolution.Curr Opin Nephrol Hypertens,2012,21(3):235-342.
3 Waldman M,Austin HA 3rd.Treatment of idiopathic membranous nephropathy.J Am Soc Nephrol,2012,23(10):1617-1630.
4 Polanco N,Gutiérrez E,Covarsí A,et al.Spontaneous remission of nephrotic syndrome in idiopathic membranous nephropathy.J Am Soc Nephrol,2010,21(4):697-704.
5 邹万忠.肾活检病理检查的常见病变//邹万忠.肾脏病理学(第2版).北京:北京大学医学出版社,2009:9.
6 王君,丁洁.肾脏疾病中新月体的形成及相关机制.中华肾脏病杂志,2006,22(9):583-586.
7 Nasr SH,Said SM,Valeri AM,et al.Membranous glomerulonephritis with ANCA-associated necrotizing and crescentic glomerulonephritis.Clin J Am Soc Nephrol,2009,4(2):299-308.
8 Nayak SG,Satish R.Crescentic transformation in primary membranous glomerulopathy:association with anti-GBM antibody.Saudi J Kidney Dis Transpl,2007,18(4):599-602.
9 Tse WY,Howie AJ,Adu D,et al.Association of vasculitic glomerulonephritis with membranous nephropathy:a report of 10 cases.Nephrol Dial Transplant,1997,12(5):1017-1027.
10 唐政,吴燕,王庆文,等.各类新月体肾炎的临床特点.肾脏病与透析肾移植杂志,2001,10(2):110-113.
11 Kanodia K,Vanikar A,Patel R,et al.Membranous Nephropathy With MPO-ANCA-Associated Crescentic GN.Nephrourol Mon,2014,6(6):e20701.
12 Kim YH,Kim HR,Ham YR,et al.A Case of Membranous Glomerulonephritis with Superimposed Anti-Neutrophil Cytoplasmic Antibody-Associated Rapidly Progressive Crescentic Glomerulonephritis.Chonnam Med J,2015,51(2):102-105.
13 王素霞,邹万忠,杨莉,等.膜性肾病合并 IgA 肾病的临床病理特点.中华病理学杂志,2007,36(3):171-174.
14 Rodriguez EF,Nasr SH,Larsen CP,et al.Membranous nephropathy with crescents:a series of 19 cases.Am J Kidney Dis,2014,64(1):66-73.
15 Larsen CP,Messias NC,Silva FG,et al.Determination of primary versus secondary membranous glomerulopathy utilizing phospholipase A2 receptor staining in renal biopsies.Mod Pathol,2013,26(5):709-715.
16 Oliveira DB.Membranous nephropathy:an IgG4-mediated disease.Lancet,1998,351(9103):670-671.
17 吴义超,刘志红,苏健,等.特发性膜性肾病的分子病理特征.肾脏病与透析肾移植杂志,2003,12(2):153-155.
18 何志军,杨琪,潘涛,等.IgG亚型在乙型肝炎病毒相关性膜性肾病与特发性膜性肾病肾小球中沉积特点的研究.诊断病理学杂志,2007,14(6):464-465.
19 管音,李航,段琳,等.血清抗PLA2R抗体和肾小球IgG4联合检测在膜性肾病诊断中的应用.中华肾脏病学杂志,2015,31(3):198-202.
20 Cattran DC,Appel GB,Hebert LA,et al.Cyclosporine in patients with steroid-resistant membranous nephropathy:a randomized trial.Kidney Int,2001,59(4):1484-1490.
21 Naumovic R,Jovanovic D,Pavlovic S,et al.Cyclosporine versus azathioprine therapy in high-risk idiopathic membranous nephropathy patients:A 3-year prospective study.Biomed Pharmacother,2011,65(2):105-110.
22 Lai WL,Yeh TH,Chen PM,et al.Membranous nephropathy:a review on the pathogenesis,diagnosis,and treatment.J Formos Med Assoc,2015,114(2):102-111.
(本文编辑 青 松 加 则)
Clinicopathologic characteristics in membranous nephropathy with crescent formation
WANGShuwei,ZHANGSiyu,LIUNan,CHENYing,MAJianfei,WANGLining,LIXiaoli
DepartmentofNephrology,TheFirstAffiliatedHospitalofChinaMedicalUniversity,ChinaMedicalUniversity,Shenyang110001,China
Correspondingauthor:LIXiaoli(E-mail:lixl@cmu1h.com)
T Objective:To investigate the clinicopathologic characteristics in membranous nephropathy (MN) patients with crescent formation. Methodology:Seventy five patients who were biopsy-proven idiopathic MN with crescent formation in the absence of systemic autoimmune disease or other etiologic factors were enrolled into this retrospective study. According to whether or not histological crescent formation they were divided into two groups: 15 patients with crescent formation and 60 patients without crescents as controls. The clinicopathological and laboratory data of the two groups were collected.Treatment and follow-up of patients with crescentic MN were analyzed. Results:Significantly higher serum creatinine and percentages of renal failure in the MN with crescents group than that in the controls, with especially severe proteinuria and decreased hemoglobin (P<0.05). Remarkably higher rates of interstitial fibrosis /tubular atrophy ( IFTA) and the infiltration of inflammatory cell in the MN with crescents group than those in the controls (P<0.05). The stage of the crescents MN group is posterior to that of the controls (P<0.05). Conclusion:Membranous nephropathy with crescents is a distinctive combination, which presents heavy clinical manifestations and serious pathological changes. Long-term follow-up should be conducted to exclude further secondary etiologic factors.
membranous nephropathy crescent clinicopathological
10.3969/cndt.j.issn.1006-298X.2016.05.003
辽宁省科研基金(201202254)
中国医科大学硕士研究生(王淑伟),中国医科大学附属第一医院肾内科(沈阳,110001)
栗霄立(E-mail:lixl@cmu1h.com)
2016-05-20
ⓒ 2016年版权归《肾脏病与透析肾移植杂志》编辑部所有
