乌司他丁对大鼠脑缺血再灌注后大脑皮质内质网应激相关分子表达的影响
2016-06-01邓玉萍黄焕森连肖强
邓玉萍 黄焕森 连肖强
乌司他丁对大鼠脑缺血再灌注后大脑皮质内质网应激相关分子表达的影响
邓玉萍 黄焕森 连肖强
目的 观察乌司他丁对大鼠脑缺血再灌注后大脑皮质内质网应激(endoplasmic reticulum stress, ERS)相关分子表达的影响。方法 健康SD大鼠90只,随机分为3组,假手术组(S组,n=30),脑缺血再灌注组(I/R组,n=30),乌司他丁处理组(U组,n=30)。采用线栓法制备大脑中动脉缺血再灌注模型,缺血2 h,再灌注24 h。HE染色观察大鼠脑组织病理改变,神经功能缺陷评分评价脑损伤程度,2,3,5-氯化三苯基四氮唑(TTC)染色法检测脑梗死体积,末端标记法(TUNEL)法检测细胞凋亡;采用western blot法检测缺血侧大脑皮层GRP78、CHOP、caspase-12蛋白表达情况。结果 与S组比较,I/R组和U组大鼠脑缺血再灌注后的神经功能学评分(NDS)升高(P<0.05),脑梗死体积增大(P<0.05),细胞凋亡数明显增加(P<0.05),I/R组和U组再灌注24h缺血侧大脑皮质GRP78、CHOP和caspase-12蛋白均表达上调(P<0.05);与I/R组比较,U组大鼠脑缺血再灌注后的神经功能缺损明显改善(P<0.05),脑梗死体积减少(P<0.05),细胞凋亡数明显减少(P<0.05);U组缺血侧大脑皮质GRP78表达上调幅度明显大于I/R组、CHOP和caspase-12蛋白表达上调幅度明显小于I/R组(P<0.05)。结论 乌司他丁可明显减轻大鼠脑缺血再灌注损伤,其机制可能与增加GRP78蛋白表达、拮抗CHOP和caspase-12蛋白表达,阻断内质网应激(ERS)启动的凋亡通路有关。
乌司他丁; 内质网应激; 脑缺血再灌注
【Author′s address】 The Second Hospital Affiliated to Guangzhou Medical University,Guangdong Provice. Guangzhou 510260,China
乌司他丁是从健康的成年男性尿液中提取的能抑制多种蛋白水解酶活力的蛋白酶抑制剂[1],其具有抑制氧自由基的释放、稳定细胞膜和溶酶体膜、抑制炎性介质释放、改善免疫功能等作用。现已被广泛应用于临床中,如休克、心肺复苏术后、器官移植及重症急性胰腺炎等。缺血再灌注损伤是急性脑梗死再通后常见的病理生理过程,有多项研究表明,乌司他丁能减轻脑缺血再灌注导致的细胞凋亡,减轻细胞损伤等作用[2-4]。本研究采用大鼠脑缺血再灌注模型,观察乌司他丁是否通过对缺血再灌注组织中GRP-78、CHOP和caspase-12蛋白表达的影响而减轻脑缺血再灌注损伤,进一步探讨乌司他丁的脑保护作用机制。
1 材料与方法
1.1 实验动物及试剂
选用健康成年雄性Sprague-Dawley大鼠90只,体重220~250 g,动物由广东省医学科学院实验动物中心提供。乌司他丁批号:031409063,规格每瓶50 000 U。
1.2 分组及给药方法
将大鼠随机分为3组:假手术组(S组,n=30):大鼠只做手术处理,不行缺血处理;缺血再灌注组(I/R组,n=30):大鼠行脑缺血后2 h再灌注24 h;乌司他丁处理组 (U组,n=30):大鼠在再灌注后即刻行尾静脉注射乌司他丁20万U/kg;S组和I/R组于再灌注后注射等容量生理盐水。
1.3 动物模型的建立
采用线栓法[5]行大鼠右侧大脑中动脉栓塞(MCAO)制备局灶性脑缺血再灌注模型,缺血2 h再灌注。10%水合氯醛(50 mg/kg)麻醉后,仰卧位固定,备皮、酒精消毒,取颈正中切口,分离右侧颈总动脉、颈内动脉及颈外动脉,结扎颈总动脉近心端和颈外动脉,在颈总动脉距离分叉口约5 cm处剪一切口,将顶端包有石蜡直径约0.24 mm的尼龙线插入颈内动脉,调整鱼线深度,插入深度约18~20 mm后固定鱼线并缝合,将右侧大脑中动脉起始端阻塞,以完全阻断血供。结扎入口处,此时为缺血开始时间。阻断血流2 h后,拔除线栓记为再灌注开始时间。S 组只分离颈总动脉,不插入栓线,其余步骤相同。I/R组和U组大鼠行脑缺血后2 h再灌注24 h,98 U组大鼠在缺血再灌注即刻行尾静脉注射乌司他丁20万U/kg;S组和I/R组于缺血再灌注后注射等容量生理盐水。
1.4 神经功能(NDS)评分
每组取10只大鼠在缺血再灌注后24 h,观察大鼠行为学改变,进行神经功能缺陷评分(NDS)。0分:无症状,活动正常;1分:对侧前肢不能完全伸直;2分:行走时向对侧旋转;3分:行走时向对侧倾倒;4分:无自发活动,意识丧失。动物模型入选标准:NDS评分2-3分为模型成功,入组。未达到上述标准者视为模型制作失败,不计入实验组。神经缺陷评分后进行HE染色和脑含水量测定。
1.5 HE染色
每组取5只大鼠于缺血再灌注24 h后断头取脑组织,切片常规脱蜡,酒精脱水,苏木伊及伊红染色,梯度酒精脱水,二甲苯透明,中性树胶封片,光镜下观察病理结果。
1.6 大鼠脑梗死体积的测定
采用2,3,5-三苯基氯化四氮唑(2,3,5-triphenyl-2H-tetrazolium chloride,TTC)法测定大鼠脑梗塞体积。在脑缺血再灌注后24 h各组分别随机取5只大鼠,腹腔注射10%水合氯醛麻醉下,迅速断头取脑。-20℃冰箱内冰冻30 min后去除嗅球、小脑及脑干等组织,大脑放于脑模具上切成5片,切片厚度为2 mm,将大脑切片置于2%红四氮唑(TTC)溶液中,于水浴恒温37 ℃恒温避光染色20 min,正常脑组织染成红色,梗死灶呈白色。期间每5 min翻面1次,再以4%多聚甲醛固定15 min,采用V3.7图像分析系统测定脑梗死体积,计算各组大鼠脑梗死灶的体积比。
1.7 TUNEL检测细胞凋亡
切片常规脱蜡至水,按照试剂盒步骤操作,常规封片,显微镜下观察细胞凋亡情况。胞核呈棕黄色颗粒为阳性细胞,每张切片在400倍下随机选取不重叠的6个高倍视野,计数TUNEL阳性细胞(阳性细胞数/计数细胞总数)×100%。
1.8 western blot 检测蛋白的表达
分别在缺血再灌注24 h取大鼠缺血侧半暗带区大脑皮层,western blot检测缺血侧大脑皮层GRP78、CHOP、caspase-12蛋白空间表达情况。每组分别取15只大鼠,每个蛋白取5只大鼠进行测定。缺血后再灌注24h后取缺血侧大脑皮质,用RIPA细胞蛋白裂解液提取蛋白,BCA法测定蛋白浓度。SDS-PAGE变性凝胶电泳,电泳完毕后湿转至PVDF膜上,BSA封闭,GRP78、CHOP和caspase-12抗体(1∶1 000,Santa cruz)4 ℃孵育过夜,二抗室温孵育2 h,PBS洗涤三次,ECL显色。
1.9 数据处理
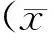
2 结果
2.1 大鼠的神经功能缺陷评分结果
S组未见神经功能缺陷。在缺血再灌注24 h,I/R组和U组大鼠均出现对侧前肢不能伸直,行走时向左侧旋转或倾倒等行为学改变,神经功能缺陷(NDS)评分均高于S组(P<0.05);与I/R组比较,U组再灌注24 h的NDS评分显著降低(P<0.05)。见表1。

表1 三组大鼠神经功能缺陷评分比较 (分,±s)
注:与S组比较,1)P<0.05;与I/R组比较,2)P<0.05
2.2 HE染色结果
S组大鼠大脑皮质神经细胞结构基本正常,细胞排列紧密,胞质丰富,核仁清晰,无变形水肿;I/R组缺血侧皮质区神经细胞结构稀疏,排列紊乱,出现大量红色神经细胞,胞核固缩深染,胞体缩小变形,核仁消失,间质疏松水肿,胞质嗜酸性明显增强;U组大鼠缺血侧大脑皮质区神经细胞较密集,胞体轻微肿胀,细胞间隙较小,失去极性细胞,红色神经细胞较I/R组减少,神经细胞损伤较轻。
2.3 大鼠脑梗塞体积结果
S组未见脑梗死灶,TTC被线粒体过氧化氢酶还原,诱发产生深红色产物而使正常组织染成红色。在缺血再灌注24 h,I/R组和U组均可见不同程度的脑梗死灶,与S组比较,I/R组和U组脑梗死体积增大(P<0.05),与I/R组比较,U组再灌注24h的脑梗死体积显著减少(P<0.05),见表2。

表2 三组大鼠缺血再灌注24 h脑梗死体积比的比较±s)
注:与S组比较,1)P<0.05;与I/R组比较,2)P<0.05
2.4 TUNEL法检测细胞凋亡结果
S组凋亡细胞几乎无表达,I/R组凋亡细胞表达较S组明显增加(P<0.05),U组凋亡细胞数较I/R组明显减少(P<0.05),见表4。

表3 三组大鼠在缺血再灌注24 h后神经细胞凋亡的影响 ±s)
注:与S组比较,1)P<0.05;与I/R组比较,2)P<0.05
2.5 western blot结果
与S组比较,I/R组和U组再灌注24h缺血侧大脑皮质GRP78、CHOP和caspase-12蛋白表达上调(P<0.05),与I/R组比较,U组缺血侧大脑皮质GRP78上调明显而CHOP和caspase-12蛋白表达明显下调(P<0.05),见表3。
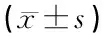

组别NGRP78CHOPCaspase-12S组51.87±0.341.59±0.411.75±0.22I/R组53.44±0.191)12.593±0.611)9.59±0.351)U组58.24±0.181)2)6.89±0.121)2)3.65±0.391)2)
注:与S组比较,1)P<0.05;与I/R组比较,2)P<0.05
3 讨论
既往研究证实,能量代谢障碍、钙超载、兴奋性氨基酸毒性、炎症反应、微血管新生影响因素、细胞凋亡等均参与了脑缺血再灌注损伤[6]。其中,细胞凋亡是近年来研究的热点,内质网应激(ERS)介导的细胞凋亡是一种不同于死亡受体途径和线粒体途径的一种新的细胞凋亡途径[7]。ERS是机体对外界反应的一种自我保护机制,一定程度的ERS可增强内质网应激能力,促进内质网功能恢复,维持内质网的稳态,保持细胞生存。但内质网应激过强或持续时间过长则可诱导内质网相关性细胞凋亡(ERAD),造成组织损伤[8-9]。
本实验研究发现,与I/R组比较,应用乌司他丁后,脑缺血再灌注大鼠神经功能缺损明显改善,脑梗死体积减少,细胞凋亡数明显减少,提示乌司他丁对脑缺血再灌注损伤具有保护作用。实验研究中GRP78和CHOP表达上调提示缺血再灌注启动了ERS过程。GRP78是一种位于内质网中的葡萄糖调节蛋白,属于热休克蛋白70系统成员之一,参与蛋白质在内质网中的糖基化修饰,对蛋白质的折叠、装配和运输具有重要的作用[10]。组织器官缺血、缺氧、钙失衡等应激状态下,可导致内质网大量错误蛋白蓄积,通过激活信号通路促使GRP78早期大量表达,引发UPR,以恢复蛋白质的正确构象,维持内环境稳定[11]。当ERS时间过长,内质网功能失代偿,GRP78表达下降,通过启动细胞内质网相关凋亡程序,导致细胞死亡。ERS引发的细胞凋亡可通过激活下游的凋亡信号分子产生,包括CHOP和caspase-12[12-13]。CHOP是内质网相关促凋亡蛋白,生理状态下以很低的表达水平存在于胞浆中,在ERS时被活化转位至细胞核,并且表达大大增加,过度表达的CHOP可能通过下调Bcl-2表达而促进细胞凋亡[14]。张红菊等[15]研究发现,大鼠纹状体缺血后可能通过GRP78表达升高启动内质网自稳调节系统。宋小燕[16]等研究发现,脑缺血再灌注可启动ERS,前期(12h)以GRP78表达上调为主,后期(24h)逐渐下降;CHOP则在后期大量表达。本实验研究发现,缺血再灌注24小时后,乌司他丁组GRP78表达上升幅度明显大于I/R组,而CHOP表达上升幅度明显低于I/R组,提示乌司他丁可能在缺血再灌注后期通过增加GRP78的表达,拮抗CHOP的表达,促进保护性和损害性因子的表达平衡,维持内质网的稳态,从而起到脑保护作用。
ERS引发细胞凋亡的另一个重要途径是caspase-12途径。Caspase-12定位于内质网外膜,是ERS导致凋亡的特异性介质,使ERS能够独立诱导凋亡而不依赖于其他通路。caspase-12主要通过激活caspase-9,caspase-3而诱导细胞凋亡[17]。吴倩佳等研究发现乌司他丁可明显降低脑缺血再灌注中脑组织caspase-3蛋白的表达[18],而本研究结果则发现,乌司他丁组可明显降低脑缺血再灌注后脑组织中caspase-12蛋白表达,减少脑细胞凋亡,推测乌司他丁的脑保护作用机制之一是通过抑制caspase-12途径,进而降低caspase-3蛋白表达,从而减少脑细胞凋亡的发生率,也即通过减轻ERS反应来达到减轻缺血再灌注损伤
综上所述,乌司他丁可能通过上调GRP78、下调CHOP和Caspase-12的蛋白水平,减轻ERS反应从而抑制细胞凋亡,达到减轻缺血再灌注损伤的目的,起到神经保护的作用。本研究为乌司他丁临床治疗脑缺血再灌注损伤提供了又一有力的理论依据,但有关乌司他丁在炎症、细胞凋亡等方面对脑缺血再灌注损伤的确切机制还有待进一步的深入研究。
[1] 潘 成,虞惠康,罗月娥. 注射用乌司他丁[J]. 中国新药杂志,2000,9(2):123-124.
[2] 薛继红,余唯琪. 乌司他丁对缺氧缺血性新生鼠的脑保护作用[J]. 中国新生儿科杂志,2007,22(1):24-26.
[3] KOGA Y, FUJITA M, TSURUTA R, et al.Urinary trypsin inhibitor suppresses excessive superoxide anion radical generation in blood, oxidative stress, early inflammation, and endothelial injury in forebrain ischemia/reperfusion rats[J]. J Neurol Res,201048(3):256-265.
[4] YAW T, ANRAKU S, NAKAYAMA R, et al. Neuroprotive effect of orinary trypoin inhibitor against facal cerebral ischemia-reperfusion in rats[J]. Anestheiology, 2003,98(2):465-473.
[5] LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. stroke, 1989, 20(1): 84-91.
[6] 韩江全,吴俊熊. 脑缺血再灌注损伤机制的研究进展[J]. 内科,2011,12(6):523-525.
[7] RAORV,HERMEL E, CASTRO-OBREGON S et al. Coupling endoplasmic reticulum stress in the cell death program. Mechanism of caspase activation[J]. J Biol Chem, 2001,276(36):33869-33874.
[8] RASHEVA V I, DOMINGOS P M. Cellular responses to endoplasmic reticulum stress and apoptosis[J]. Apoptosis,2009,14(8):996-1007.
[9] KIM L, XU W, REED J C. Cell death and endoplasmic reticulum stress: disease relevance and therapeutic opportunities[J]. Nat Rev Drug Discov,2008,7(12):1013-1030.
[10]GETHING M J, SAMBROOK J. Protein folding in the cell[J]. Nature,1992,355(6355):33-45.
[11]缪亦锋,邱永明,张晓华. 缺血预处理通过减轻内质网应激保护全脑缺血大鼠[J]. 国际脑血管病杂志,2013,21(8):618-623.
[12]陈 静,秦红芳,朱 斌,等. APP/PSI双转基因AD小鼠早期内质网应激诱导的凋亡[J]. 解剖学研究,2012,34(1):12-15.
[13]胡跃强,唐 农,雷龙鸣. 大鼠局灶性脑缺血预处理后蛋白激酶及葡萄糖调节蛋白78表达的变化[J]. 中华神经科杂志,2012,45(1):45-50.
[14]DAIZO K, M ASAHIKO A, AKIOSHI K, et al. Arkadia amplifies TGF-β superfamily signaling through degradation of Smad 7[J]. EMBO J, 2003,22(24):6458-6470.
[15]张红菊,赵忠新,夏 斌. 大鼠脑缺血后内质网伴侣蛋白GRP78和GRP94及胱冬酶12表达的改变[J]. 中国脑血管病杂志,2006,3(4):163-167.
[16]宋小燕,赵永波,周晓琳,等. 大鼠脑缺血再灌注后GRP78和GADD153的表达变化研究[J]. 中风与神经疾病杂志,2008,25(2):139-141.
[17]SCHIER A F. Nodal signaling in verteb rate development[J]. Annu Rev Cell Dev Biol, 1999,1(8):472-476.
[18]吴倩佳,李光来. 乌司他丁对大鼠局灶性脑缺血再灌注损伤caspase-3表达的影响[J]. 中西医结合心脑血管病杂志,2011,5(9):580-581.
The Effect of Ulinastatin on Endoplasmic Reticulum Stress Associated Molecules Expressions in Rat Cerebral Cortex After Cerebral Ischemia Reperfusion
DENGYuping,HUANGHuangsen,LIANXiaoqiang
Objective To investigate the protective effects of ulinastatin on express of GRP78、CHOP and caspase-12, the molecules related to endoplasmic reticulum stress(ERS),after ischemia reperfusion injury in rats. Methods Ninety rats were equally randomized into 3 groups(n=30): Sham group (S group,n=30), Ischemia-reperfusion group (I/R group,n=30), Ulinastatin group (U group,n=30). Focal transient cerebral ischemia model was established with intraluminal occlusion fo left meddle cerebral artery. Made through 2 hours of temporary middle cerebral artery occlusion, followed with 24 hours of reperfusion.The pathological results were investigated by HE staining and the cerebral injury situation was evaluated by neurological deficit scores. Infract volume was measured by TTC staining, apoptosis was detected by TdT-mediated dUTP and nick end labeling(TUNEL), and expression of GRP78, CHOP and caspase-12 were meastured by western blot. Results Compared with the S group, the number of apoptotic cells were significantly increase in I/R group and U group (P<0.05); infarct volume and expression of GRP-78, CHOP and caspase-12 were significantly increased in I/R group and U group (P<0.05). The infarct volume and the number of apoptotic cells were significantly less in U group than in I/R group (P<0.05). GRP78 expression was higher in U group than in I/R group (P<0.05), however CHOP and caspase-12 expression was less in U group than in I/R group (P<0.05). Conclusion Ulinastatin has a protective effect on cerebral ischemia reperfusion injury, which may related to increased GRP78, decreased CHOP and caspase-12 expression and to inhibition of the ERS-induced apoptosis pathway.
Ulinastatin; endoplasmic reticulum stress; ischemia reperfusion
广东省科技计划项目(编号:2014A020212334); 广州市医药卫生科技一般引导项目(编号:20141A011086)
R589, R363
A
10.3969/j.issn.1671-332X.2016.10.005
邓玉萍 黄焕森 连肖强 : 广州医科大学附属第二医院 广东广州510260
