微透析法研究环维黄杨星D透皮贴剂透皮吸收行为
2016-06-01刘新国杨全伟
刘新国, 程 璐, 杨全伟, 张 耕
(武汉市第一医院,湖北武汉430022)
微透析法研究环维黄杨星D透皮贴剂透皮吸收行为
刘新国, 程璐, 杨全伟, 张耕*
(武汉市第一医院,湖北武汉430022)
摘要:目的 采用微透析法研究环维黄杨星D透皮贴剂经皮给药后的药物动力学行为。方法 线性微透析探针植入Wistar大鼠真皮在线取样。液相色谱串联质谱(LC-MS/MS)法测定透析液中环维黄杨星D的回收率与其体内稳定性。结果 环维黄杨星D在0.1~90 ng/mL范围内线性关系良好(r=0.999 34),定量限为10 pg/mL。透皮贴剂的皮肤局部药物动力学行为符合单室模型,药物平均滞留时间在12 h以上。基质药物质量浓度越高,单位时间透皮量越大,但不呈比例增加。结论 经皮微透析在微创条件下,可满足环维黄杨星D透皮贴剂连续取样及动态分析的要求。
关键词:环维黄杨星D;透皮贴剂;透皮吸收;药物动力学;微透析;LC-MS/MS
黄杨宁系从黄杨科植物中国小叶黄杨Buxus microPhylla Sieb. et Zucc. var. sinica Rehd. et Wils.及其同属植物中提取得到的生物碱[1],其主要有效成分环维黄杨星D(CVB-D)是《中国药典》2000年版一部的新增品种,具有行气活血,通络止痛的功效,临床用于治疗气滞血瘀所致的胸痹心痛、脉结代、冠心病、心律失常等[2]。但其静注后组织亲和力强,摄取快,药物在组织中的潴留时间久,排泄缓慢,导致多次给药时各脏器出现蓄积现象。根据环维黄杨星D的理化性质、药理特性、药动学参数及心血管系统疾病需长期用药的特点[3],前期将其研制成经皮给药贴剂,发现其黏性适中,皮肤相容性好,具有良好的体外释药性和平稳的经皮渗透速率[4]。鉴于微透析采样技术可在基本不干扰生物体内正常生理的情况下,进行在体、实时、在线取样和检测,国外利用该技术进行化学单体药物的体内代谢动力学研究[5-6],而国内主要针对局部组织的药物动力学进行[7-8]。本实验利用微透析线性探针骨性半透膜来模拟皮下毛细血管,联合使用液相色谱串联质谱(LC-MS/MS)技术,对环维黄杨星D经皮给药后的药物动力学进行研究。
1 试药、仪器与动物
1.1 药品与试剂 环维黄杨星D对照品(批号888-200001)、多萘哌齐(批号100650-200301)对照品(中国食品药品检定研究院)。甲醇为色谱纯(德国Merck公司);醋酸铵为色谱纯(美国Dikma公司);其他试剂均为分析纯;纯净水(Purlab classic纯水系统制备)。
环维黄杨星D透皮贴剂(自制,批号20081206,规格0.1、0.5、1.0 mg/cm2)。制备方法为精密称取Eudragit E100适量,加入琥珀酸(交联剂)和无水乙醇,静置密闭过夜以使其充分溶解、交联,再加入癸二酸二丁酯(增塑剂)和氮酮(促渗剂),混合均匀。精密称取环维黄杨星D原料药适量,无水乙醇溶解,与上述交联改性的压敏胶液混合,搅拌均匀,静置一段时间以使气泡消失,涂布于防黏纸上,80℃固化10 min后转移至背衬层,切割,制成不同载药量的单层贴剂。
1.2 仪器 Thermo Finnigan TSQ Quantum Ultra型三重四极杆串联质谱仪,配备Finnigan Surveyor自动进样器、电喷雾电离源(ESI源)、Xcalibur 1.3系统控制及数据处理软件(美国Thermo Fisher Scientific公司);微透析设备,配备MD-2000线性微透析探针(10 mm)、MD 1001灌注器推进泵、MD-0100灌注器(1 mL)、MD 1002灌注器支架、MD-1000流速控制器(美国BAS公司);高速冷冻离心机(美国Sigma公司);Precisa XR205SM-DR电子天平(十万分之一,瑞士普利赛斯公司)。
1.3 试验动物 健康成年Sprague-Dawley大鼠,体质量(200±20)g,由广州中医药大学实验动物中心提供,合格证号SCXK(粤)2009-0001。
2 LC-MS/MS法测定环维黄杨星D的质量浓度
2.1 色谱与质谱条件[9]
2.1.1 色谱条件 Agilent Elipse plus C18色谱柱(100 mm×2.1 mm,3.5 μm);流动相60%甲醇(含0.15%甲酸、2 mmol/L乙酸铵);体积流量0.2 mL/min;柱温22℃。
2.1.2 质谱条件 大气压电喷雾离子(APC-ESI)源,源电压4.0 kV;加热毛细管温度320℃;鞘气(N2)压力138 kPa;辅助气(N2)体积流量5 mL/min;正离子模式检测,扫描方式为选择反应监测(SRM);用于定量的离子分别为环维黄杨星D m/z403(母离子)→372(子离子)、多萘哌齐(内标)m/z 380(母离子)→243(子离子);扫描时间0.5 s。
2.2 专属性考察 在“2.2.1”项色谱条件下,环维黄杨星D的出峰时间在1.20 min左右,而内标峰在1.63 min左右。两者峰形良好,无杂质峰干扰,基线平稳,见图1~3。由此表明,该方法具有较高的特异性,能准确测定微透析样品中环维黄杨星D的质量浓度,灵敏度高。
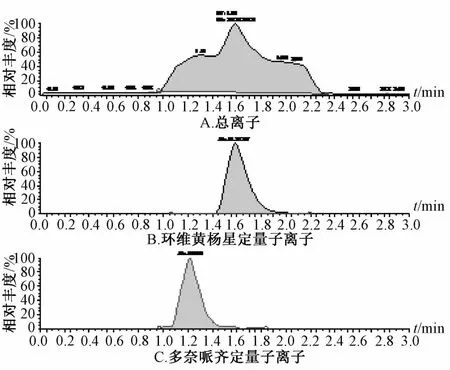
图1 空白微透析液加入环维黄杨星D的质谱图Fig.1 M ass spectrograms of blanKm icrodialysates added w ith cyclovirobuxine D
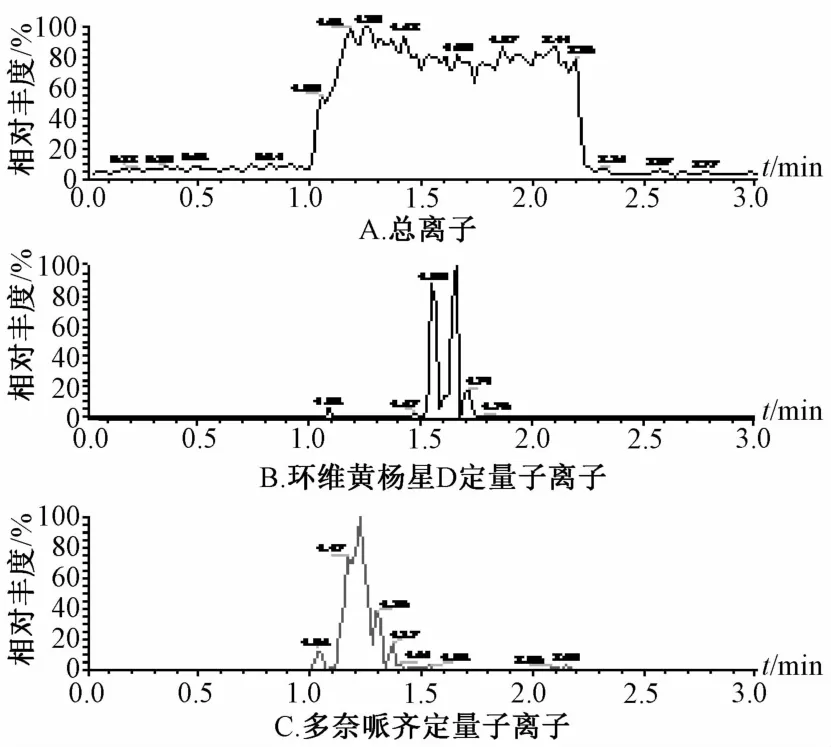
图2 空白微透析液的质谱图Fig.2 M ass spectrogram s of b lanKm icrodialysates
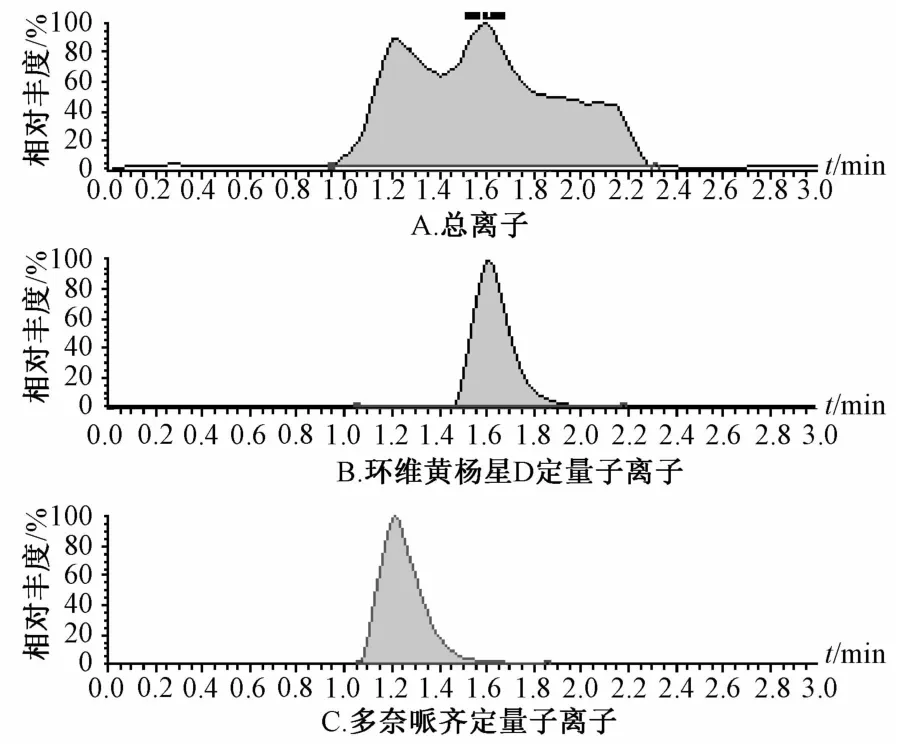
图3 未知微透析液的质谱图Fig.3 M ass spectrograms of unKnown m icrodialysates
2.3 贮备液的配制
2.3.1 环维黄杨星D对照品贮备液的配制 精密称取环维黄杨星D对照品适量,置于100 mL量瓶中,用流动相配成50 μg/mL的溶液,置于4℃冰箱中保存,即得。使用时,用流动相稀释至所需质量浓度。
2.3.2 内标贮备液的配制 精密称取多萘哌齐对照品适量,置于100 mL量瓶中,用流动相配成50 μg/mL的溶液,置于4℃冰箱中保存,即得。使用时,用流动相稀释至所需质量浓度。
2.4 供试品溶液制备 取透析液60 μL,分别加入10 ng/mL内标溶液100 μL,1.2 mol/L氢氧化钠溶液60 μL,涡旋混匀30 s。再加叔丁基甲醚-二氯甲烷(2∶1)300 μL,涡旋混匀1 min,振荡10 min,12 000 r/min离心10 min,吸取上层萃取液200 μL,40℃水浴N2吹干,残渣用60 μL流动相溶解。
2.5 标准曲线制备 取1.5 mL玻璃离心管若干支,分别精密加入环维黄杨星D对照品及空白透析液适量,涡旋混匀,配成0.1、1、5、10、30、50、90 ng/mL系列样品,按“2.4”项下方法操作,进样5 μL分析。以环维黄杨星D与内标峰的面积比(Ai/As)对环维黄杨星D的质量浓度(C)回归,得回归方程C=13.813 3Ai/As-0.909 70,r=0.999 34,表明环维黄杨星D在0.1~90 ng/mL范围内线性关系良好,定量限为10 pg/mL。
2.6 方法回收率及精密度 用空白透析液配制含低、中、高质量浓度(0.5、5、50 ng/mL)环维黄杨星D的微透析溶液5份,精密吸取60 μL,按“2.4”项下方法操作,进样测定,记录环维黄杨星D和多萘哌齐的峰面积。再配置含3种质量浓度环维黄杨星D的甲醇溶液,40℃水浴氮气吹干,残渣用60 μL流动相溶解,进样5 μL,记录两者峰面积。比较两种溶液的峰面积,计算环维黄杨星D回收率和日内RSD。连续测定3 d,测得日间RSD,结果见表1。
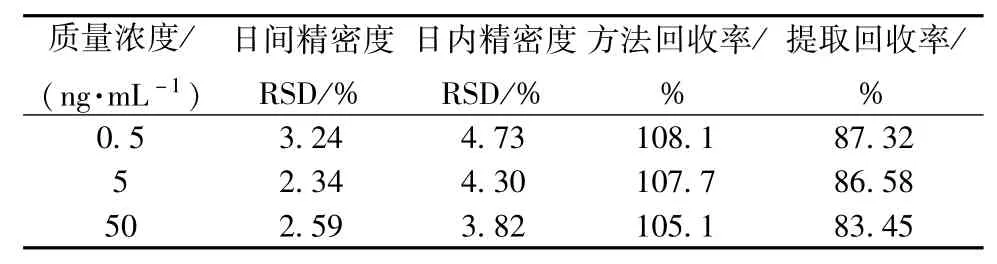
表1 精密度试验结果Tab.1 Results of precision tests
3 皮肤微透析试验
3.1 实验动物 健康成年雄性Sprague-Dawley大鼠,体质量180~220 g。实验前适应环境7 d以上,生活在洁净环境中,自由饮水,房间温度保持在(22±1)℃,相对湿度保持在35%~50%。
3.2 皮肤微透析样品采集 取大鼠12只,剪去背部绒毛,脱毛膏脱毛后饲养6 d(确保皮肤表面无破损和红斑水肿)。实验前,注射25%乌拉坦(0.4 mL/100 g体质量)麻醉,固定于保温隔垫上,使其体温保持在37.5℃左右。用特制引导针将线性微透析探针平刺植入皮肤真皮层中(图4和图5,平均深度[350±42]μm),引导针抽回,微透析探针膜管留于大鼠皮肤组织中,再将线性微透析探针与微透析装置相连(图6)。先以空白灌流液平衡3.0 h后接样,作为空白透析液。将环维黄杨星D透皮贴剂(含药量分别为0.1、0.5、1.0 mg/cm2,给药面积4 cm×2.5 cm)局部贴敷于探针上部脱毛皮肤,聚乙烯薄膜覆盖,给药后1、2、3、4、5、6、7、8、10、11、12、14、16、18、20、22、24、26、28、30 h收集透析液,LC-MS/MS法测定透析液样品中环维黄杨星D质量浓度。

图4 探针植入皮肤组织图(100倍)Fig.4 Figure of probe implanted into sKin issue(×100)
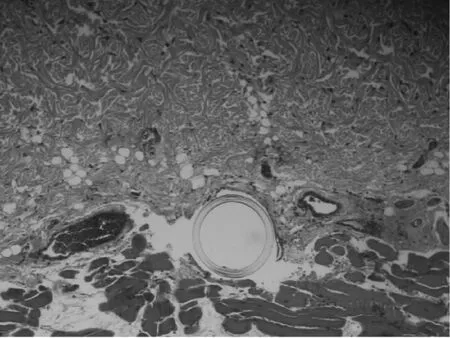
图5 探针植入皮肤组织图(200倍)Fig.5 Figure of p robe im p lanted into sKin issue(×200)
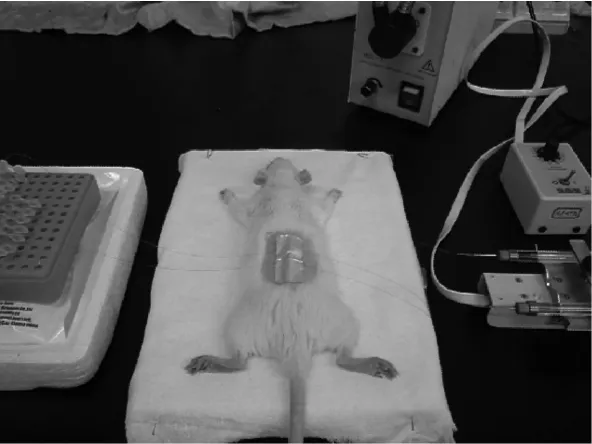
图6 经皮微透析照片Fig.6 Photograph of percutaneousm icrodialysis
3.3 探针体内相对回收率稳定性考察 药物动力学研究通常需要较长时间,同一根微透析探针的体内回收率如果在采样过程中不能保持相对稳定,则预测的相对回收率不能用来校正“真实浓度”。因此,实验前必须对探针体内相对回收率的稳定性进行考察。
按“3.2”项下方法操作,采用含药30%乙醇-林格氏液(100 ng/mL),以1 μL/min的体积流量灌注探针。稳定60 min后,以60 min为间隔接收透析液,LC-MS/MS法测定环维黄杨星D质量浓度,按公式计算体内相对损失率(RL),结果见图7。
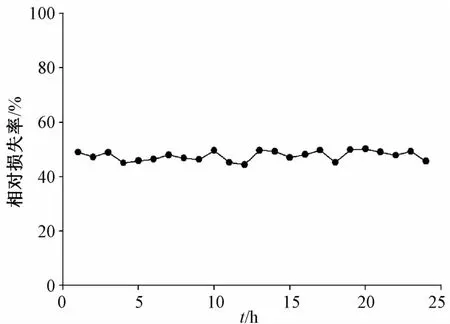
图7 相对回收率稳定性Fig.7 Stability of relative recoveries
由图可知,体内探针相对损失率在24 h内保持稳定(RSD=3.82%),满足药物动力学研究的要求。但探针体内外相对损失率并不相等,体内(47.66%)小于体外(49.77%)。
3.4 皮肤局部药动学参数及结果分析 按“3.2项”下方法进行皮肤微透析实验,LC-MS/MS法测定透析液中环维黄杨星D质量浓度,以当天的标准曲线计算而得,并同时测定质控样本。然后,以体内相对回收率校正得到真实值,计算公式如下。
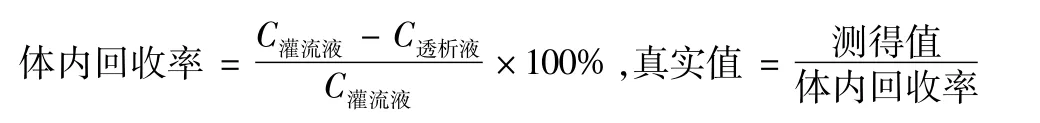
透皮贴剂皮肤给药后,计算各时间点皮下环维黄杨星D质量浓度,药物动力学曲线见图8。

图8 浓度-时间曲线Fig.8 Concentration-time curves
药物动力学参数通过Winnonlin软件计算,曲线下面积(AUC)采用梯形面积法计算,以AIC最小值为隔室模型判断标准,环维黄杨星D透皮贴剂皮肤局部药物动力学过程符合单室模型,权重为uniform weight,参数见表2,结果见表3。

表2 房室模型拟合的药物动力学参数Tab.2 PharmacoKinetic parameters fitted w ith com partmentmodel
从表可知,环维黄杨星D透皮贴剂的药物平均滞留时间在12 h以上,透皮效果持久。药物透皮量可用AUClast来反映,而单位时间内平均透皮量可用AUClast/MRTlast表示,基质药物质量浓度越高,单位时间内透皮量越大,但不呈等比例增加。因此,压敏胶中药物质量浓度并非是决定贴剂透皮速率的唯一因素,包括制剂处方因素在内,影响贴剂中药物释放各因素之间的相互作用可能才是决定药物透皮效果的关键环节。

表3 非房室模型拟合的药物动力学参数Tab.3 PharmacoKinetic parameters fitted w ithout compartmentmodel
4 讨论
微透析探针有很多种,本实验采用线性微透析探针,其探头包括双层管,外周裹着一层油性管,中间部分有个“窗口半透膜”,有着增加探针稳定性、保证半透膜进入或退出组织等作用。探针的入口处有一个Luer Lock连接器,以链接匹配的注射器或链接微蠕动泵输入透析液,另一端则用于接收含药透析液。
探针整体模拟皮下毛细血管时,仅允许小于半透膜膜孔的分子进入或输出。故需要用一个引导针植入真皮层,然后缓慢输入(0.5~4.0 μL/min)灌流液来与外周组织液产生输入-输出的动态平衡,用于交换小于半透膜截断值的物质。物质的质量浓度梯度交换基于Fick's第二法则,而平衡速度则与药物的扩散率及质量浓度梯度大小有关[10]。
综上所述,环维黄杨星D透皮贴剂的皮下药物动力学行为与体外透皮结果之间存在一定相关性[4]。经皮微透析能在微创的条件下,满足定性、定量、定位、连续取样及动态分析的研究要求,可为经皮给药的药物动力学研究,以及相关药物的质量评价提供可靠和全新的手段[11]。
参考文献:
[1] 梁秉文,邓晨安,王学斌,等.黄杨木生物碱Ⅰ,Ⅱ,Ⅲ,Ⅳ的分离与结构研究[J].药学通报,1981,16 (4):3.
[2] 国家药典委员会.中国人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:1065.
[3] 魏 敏.黄杨宁经皮给药系统的研究[D].广州:广州中医药大学,2005.
[4] 刘新国,周莉玲,邹吉利,等.BP神经网络模拟环维黄杨星D经皮渗透行为的研究[J].中成药,2012,34(8):56-60.
[5] Gallardo E,Madrona A,Palma-Valdés R,et al.Effect of intracerebral hydroxytyrosol and its nitroderivatives on striatal dopaminemetabolism:A study by in vivo microdialysis[J].Life Sci,2015,134(8):30-35.
[6] Isaksson B,D'souza M A,Jersenius U,et al.Continuous assessment of intrahepatic metabolism bymicrodialysis during and after portal triad clamping[J].J Surg Res,2011,169(2):214-219.
[7] Zhang Q,Wu D,Wu J,et al.Improved blood-brain barrier distribution:effect of borneol on the brain pharmacokinetics of kaempferol in rats by in vivo microdialysis sampling[J].JEthnoPharmacol,2015,162(5):270-277.
[8] Lu CM,Hou M L,Lin L C,et al.Development of amicrodialysis system to monitor lamivudine in blood and liver for the pharmacokinetic application in herbal drug interaction and the gene expression in rats[J].J pharm Biomed Anal,2014,96 (8):231-240.
[9] 薛 杰,韩 荣,高 曙,等.注射用环维黄杨星D在人体中药代动力学研究[J].药物分析杂志,2008,28(12):2114-2117.
[10] 朱 林,朱家壁.微透析取样技术及其在药代动力学中的应用[J].国外医学:药学分册,2002,29(5):296-301.
[11] 朱晓亮,陈志良,李国峰,等.纳米乳经皮渗透的可视化定量分析研究[J].中国药房,2007,18(10):757-759.
Percutaneous absorption behavior of cyclovirobuxine D transdermal patch by m icrodialysis
LIU Xin-guo, CHENG Lu, YANG Quan-wei, ZHANG Geng*
(Wuhan MuniciPal No.1 HosPital,Wuhan 430022,China)
ABSTRACT:AIM To study the pharmacokinetic behavior of cyclovirobuxine D transdermal patch after percutaneous administration by microdialysis.M ETHODS A linearmicrodialysis probe was implanted into Wistar rats' dermis for continuous sampling.The recovery rate of cyclovirobuxine D in dialysate and its stability in vivo were determined by liquid chromatography-tandem mass spectrometry(LC-MS/MS).RESULTS Cyclovirobuxine D showed a good linear relationship within the range of 0.1 -90 ng/mL(r=0.999 34),whose limit of quantification was10 pg/mL.The pharmacokinetic behavior of transdermal patch in local skin accorded with single compartmentmodel,and the average residence time of drug wasmore than 12 h.The higher concentration ofmatrix drug permitted a greater percutaneous amount per unit time,but not proportionally.CONCLUSION Minimally invasive,subcutaneousmicrodialysis can satisfy the continuous sampling and dynamic analysis for cyclovirobuxine D transdermal patch.
KEY WORDS:cyclovirobuxine D;transdermal patch;percutaneous absorption;pharmacokinetics;microdialysis;LC-MS/MS
*通信作者:张 耕,男,硕士,主任药师,从事药物新制剂、新技术研究与医院药学管理工作。Tel:(027)61871268
作者简介:刘新国,男,博士,主管中药师,从事医院药物制剂的研究与开发。Tel:13628661063,E-mail:lxgdata@126.com
收稿日期:2015-10-19
doi:10.3969/j.issn.1001-1528.2016.05.009
中图分类号:R969.1
文献标志码:A
文章编号:1001-1528(2016)05-1006-05
