脂多糖干预时间与小胶质细胞生成IL-1β和TNF-α时效关系的研究
2016-05-31白玉娟李琦军周红艳张国亮
白玉娟,李琦军,周红艳,李 炎,张国亮
(河北省石家庄市第三医院,河北 石家庄 050011)
脂多糖干预时间与小胶质细胞生成IL-1β和TNF-α时效关系的研究
白玉娟,李琦军,周红艳,李炎,张国亮
(河北省石家庄市第三医院,河北 石家庄 050011)

[摘要]目的以原代培养的大鼠皮质小胶质细胞为研究对象,观察脂多糖(LPS)处理小胶质细胞时间与小胶质细胞生成白细胞介素-1β(IL-1β)和肿瘤坏死因子α(TNF-α)的时效关系,寻找能够使小胶质细胞产生大量IL-1β、TNF-α的LPS最佳干预时间,为建立最佳小胶质细胞炎症模型提供依据。方法培养原代大鼠皮质小胶质细胞,随机分为10组,5组为LPS组,以含LPS(终浓度为100 ng/mL)的无血清胶质细胞培养液分别孵育1 h、3 h、6 h、12 h、24 h;每个LPS组均设平行对照,对照组用无血清胶质细胞培养液孵育,孵育时间同LPS组。孵育结束后,ELISA方法检测各组培养液中IL-1β和TNF-α蛋白含量,RT-PCR方法检测小胶质细胞中IL-1β mRNA和TNF-α mRNA表达水平。结果孵育原代小胶质细胞1 h、3 h、6 h、12 h、24 h后,LPS组培养液中IL-1β和TNF-α蛋白含量及小胶质细胞中IL-1β mRNA和TNF-α mRNA表达水平均明显高于对照组(P均<0.05);LPS组培养液中IL-1β和TNF-α蛋白含量及小胶质细胞中IL-1β mRNA和TNF-α mRNA表达水平随着处理时间延长逐渐上升,IL-1β在3 h达到高峰,TNF-α在6h时达到高峰,二者在6 h均处于较高水平,以后随时间延长逐渐下降,相邻LPS处理组间比较差异均有统计学意义(P均<0.05)。结论LPS能够刺激小胶质细胞大量产生IL-1β和TNF-α,这种效应与LPS刺激时间相关,在刺激6 h时IL-1β和TNF-α均处于较高水平,LPS刺激6 h时是理想的小胶质细胞炎症模型。
[关键词]脂多糖;小神经胶质细胞;白细胞介素-1β;肿瘤坏死因子α
炎症反应是机体组织对各种损伤产生的防御反应,过度和长期的炎症反应可以引起组织损害,炎症与中枢神经系统疾病有着密切关系。小胶质细胞是一种广泛分布于中枢神经系统的巨噬细胞[1],其在中枢神经系统内有免疫监视功能,当脑组织出现病理改变时,小胶质细胞受刺激迅速变为活化状态,通过产生炎症因子,抗原提呈、细胞毒性发挥天然免疫作用,是神经系统疾病与免疫反应相联系的重要媒介[2]。小胶质细胞还是大脑中产生炎症因子的主要细胞之一,参与介导神经系统炎症反应[3-4],其受到刺激后,可释放白细胞介素-1β(IL-1β)、肿瘤坏死因子α(TNF-α)等细胞因子以及其他一些生物活性物质[5],而某些物质的过分释放会导致神经元损伤[6-7]。IL-1β和TNF-α是最常见的细胞因子,在中枢神经系统多种生理和病理过程中发挥着重要作用[8-9]。随着IL-1β和TNF-α在脑组织内浓度的增加,会对周围的神经元产生毒性作用。脂多糖(LPS)是一种磷脂,能够激活小胶质细胞,在小胶质细胞生物活性研究中常用LPS作为激活剂。LPS激活后的小胶质细胞会生成多种生物活性物质,这些物质在中枢神经系统炎症反应及病理损伤过程中起着关键作用[10-11],而被LPS激活的小胶质细胞产生的细胞因子与LPS干预时间的时效关系对于建立小胶质细胞炎症模型有着重要意义。本研究用体外培养的原代大鼠皮质小胶质细胞来验证LPS对小胶质细胞的激活作用以及小胶质细胞激活后产生IL-1β、TNF-α的量与LPS作用时间的关系,旨在寻找能够使小胶质细胞产生大量IL-1β、TNF-α的LPS最佳干预时间,为建立最佳的小胶质细胞炎症反应模型提供实验依据,现报道如下。
1实验资料
1.1动物24 h内新生SD大鼠30只,清洁级,河北医科大学实验动物中心提供,动物生产许可证号SCXK(冀)2013-1-03。
1.2主要试剂和仪器小鼠单克隆抗体IBA-1、LPS(美国Sigma公司),FITC标记的山羊抗小鼠IgG(美国Proteintech公司),胎牛血清、DMEM/F12培养液(美国Gibco公司),ELISA试剂盒(中国Bio-Swamp公司),GoldViewⅠ型核酸染料(美国Ameresco公司),Trizol(美国Invitrogen公司),RT-PCR逆转录试剂盒、RNA酶抑制剂(RNasin)、PCR扩增试剂盒、随机引物 ( Random primers)(美国Promega公司)。酶标仪(芬兰Theromo Labsystems公司),超净工作台(日本Sanyo公司), DMI3000B+DFC450C型荧光显微镜(德国Leica公司),实时定量PCR扩增仪(美国ABI公司),凝胶成像系统(GDS8000) (美国UVP公司),Mastercycler gradient PCR仪(德国Eppendorf公司)
1.3小胶质细胞培养参照Nakajima等[12]所述方法。24 h内新生大鼠无菌环境下开颅取脑,剥除脑膜及血管,取部分大脑皮质,剪碎后用0.125%胰蛋白酶37 ℃消化15 min后,反复吹打成悬液,1 000 r/min离心5 min后过滤,弃上清,在沉淀物中加入胶质细胞培养液(为含10%胎牛血清、1 IU/mL青霉素、100 μg/mL链霉素的DMEM/F12培养基制成细胞悬液),接种于250 mL培养瓶中,37 ℃、5%CO2培养。第2天全量换液1次,以后每3 d更换1/2体积培养液。培养至第14天,细胞充分分层生长后,置于37 ℃恒温摇床中180 r/min振摇2 h,收集细胞悬液,1 000 r/min离心5 min,去上清,用DMEM/F12全培养基吹打成细胞悬液,将细胞调至约1×108L-1,种植到预先铺好多聚赖氨酸的六孔板内,每孔3 mL。在恒温培养箱内静置30 min后完全换液1次,去除少突胶质细胞,加入 DMEM/F12完全培养基继续培养3~5 d。
1.4小胶质细胞形态学观察分离纯化好的小胶质细胞分别以1×104个细胞/皿接种于预先放置经多聚赖氨酸处理过的盖玻片的3.5 cm培养皿,24 h后取出盖玻片,以IBA-1为一抗,行免疫细胞化学染色,荧光显微镜下观察原代大鼠皮质小胶质细胞形态。
1.5小胶质细胞培养液中IL-1β、TNF-α蛋白的检测分离纯化好的小胶质细胞以5×105个细胞/孔接种于经多聚赖氨酸处理过的6孔培养板,培养2 d后,更换新鲜无血清胶质细胞培养液孵育细胞12 h,将6孔板各孔分为10组,每组3孔,5组作为LPS组,分别以含LPS(终浓度为100 ng/mL)的无血清胶质细胞培养液孵育1 h、3 h、6 h、12 h、24 h。各LPS处理组均设平行对照组,用无血清胶质细胞培养液孵育1 h、3 h、6 h、12 h、24 h。孵育结束后,取各组培养液,ELISA法检测培养液中IL-1β、TNF-α蛋白含量。
1.6小胶质细胞中TNF-α mRNA、IL-1β mRNA表达水平的检测将上述各组六孔板中的细胞培养液去除,向各孔加入Trizol(1 mL/孔),吹打后移至去核酶的离心管中,静置5 min。每管加入0.2 mL氯仿,剧烈震荡15 s,使其尽量混匀,静置5 min。12 000 r/min离心15 min,将上层无色液体移到新的离心管中,加入等体积的异丙醇,颠倒混匀。4 ℃ 12 000 r/min离心10 min,管底可见羽毛状白色沉淀物,完全弃去上清。加入1 mL 75%乙醇(DEPC水配置),洗涤沉淀。4 ℃ 7 500 r/min离心5 min,弃上清。静置晾干3~5 min,加入20~30 μL DEPC水充分溶解RNA。放置于-70 ℃冰箱备用。取3 μL上样缓冲液与上述DEPC水溶解好的RNA 5 μL充分混匀,加入含2%琼脂糖凝胶(含0.01% GlodviewⅠ核酸染料)的加样孔中进行电泳,电泳条件为:电压120 V,时间5 min。在紫外线下观察电泳条带,可见5 s条带不明显,18 s、28 s条带明亮清晰, 28 s条带的亮度和宽度约为18 s条带的2倍,未见大分子的DNA条带,说明提取的RNA完整性好,无DNA污染。RNA纯度测定采用紫外分光光度计检测法。上述DEPC水溶解好的RNA 2 μL溶于1 mL三蒸水中,测定其在260 nm和280 nm的吸光度值(OD值),计算OD260与OD280的比值;比值为1.81,说明提取的RNA有较高的纯度,无污染,可用于下一步的反转录反应。RNA含量根据公式A260×稀释倍数×40 μg计算,结果为1 540 g/mL。实时荧光定量PCR反应中反转录反应体系为:Total RNA 8 μL,Random Primer 1 μL,2×ES Reaction Mix 10 μL,RT/RI Enzyme Mix 1 μL。总体积20 μL。将反转录体系充分混匀,mini离心机瞬时离心。反应条件:25 ℃ 10 min,42 ℃ 50 min,85 ℃ 5 min。生成的CDNA稀释20倍,混匀后放入-20 ℃冰箱备用。大鼠IL-1β和TNF-α的引物序列(上海生工生物公司合成):IL-1β上游引物序列为5’-CTCCATGAGCTTTGTACAAGG-3’,下游引物序列为5’-TGCTGATGTACCAGTTGGGG-3’, 产物长度245 bp;TNF-α上游引物序列为5’-TGCCTCAGCCTCTTCTCATT-3’, 下游引物序列为5’-GCTTGGTGGTTTGCTACGAC-3’,产物长度208 bp;GAPDH上游引物序列为5’-TGAACGGGAAGCTCACTGG -3’,下游引物序列为5’-GCTTCACCACCTTCTTGATGTC -3’,产物长度120 bp。扩增体系为:2×UltraSYBR Mixture(with ROX)10 μL,Forward Primer(10 μmol/L)1 μL,Reverse Primer(10 μmol/L)1 μL,cDNA 8 μL。总体积20 μL。RT-PCR反应程序参数:预变性95 ℃ 10 min ,变性95 ℃ 15 s,退火58 ℃ 20 s,延伸72 ℃ 27 s,40个循环。扩增结束后,进入ABI 7300 Real-Time PCR System结果分析界面,检测并计算目的基因表达量与内参GAPDH基因比较的相对值(RQ值),用于统计分析。
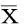
2结果
2.1原代小胶质细胞形态学表现分离纯化后的小胶质细胞,胞体较小,细胞上有细长突起(箭头),星形胶质细胞和神经元细胞已经很难看到,见图1。经IBA-1免疫细胞化学荧光染色后,可见IBA-1将胞体和突起染成红色,Hoechst 33258复染后将胞核染成蓝色,胞体可见呈分支状或者梭形,伴有细长的突起(箭头),经鉴定,小胶质细胞纯度大于95%,满足实验需要,见图2。
2.2不同孵育时间原代小胶质细胞培养液中IL-1β和TNF-α含量变化孵育原代小胶质细胞1 h、3 h、6 h、12 h、24 h后,LPS组培养液中IL-1β和TNF-α含量与相应对照组相比均显著增高(P均<0.05);且原代小胶质细胞生成IL-1β和TNF-α的量随LPS干预时间延长逐渐增加,分别在3 h和6 h达到高峰,随后随时间延长逐渐下降,各相邻LPS处理组间胶质细胞培养液中IL-1β和TNF-α含量比较差异均有统计学意义(P均<0.05)。对照组无此相应变化。见表1。
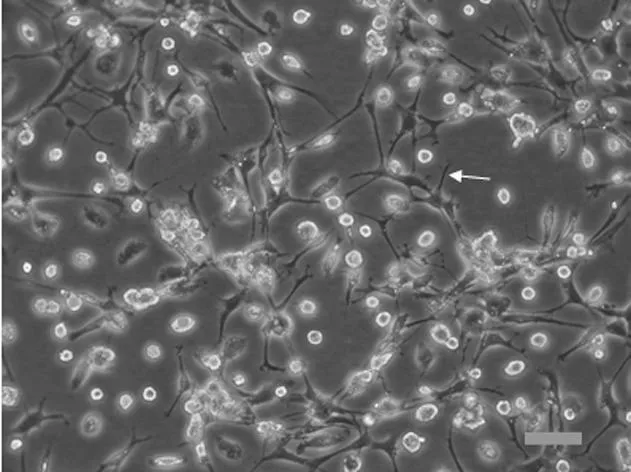
图1 原代培养的小胶质细胞形态表现 (×400)
图2 IBA-1免疫荧光染色后小胶质细胞形态表现(×600)
表1 不同孵育时间原代小胶质细胞培养液中IL-1β和TNF-α含量变化
注:①与对照组比较,P<0.05。
2.3不同孵育时间原代小胶质细胞中IL-1β mRNA和TNF-α mRNA表达量变化孵育原代小胶质细胞1 h、3 h、6 h、12 h、24 h后,LPS组小胶质细胞中IL-1β和TNF-α mRNA表达量与相应对照组相比均显著增高(P均<0.05);且LPS组小胶质细胞中IL-1β mRNA表达量在3 h、TNF-α mRNA表达量在6 h达到高峰,随后随时间延长逐渐下降。各相邻LPS处理组间小胶质细胞中IL-1β mRNA和TNF-α mRNA表达量比较差异均有统计学意义(P均<0.05)。对照组无此相应变化。见表2。
3讨论
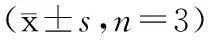
表2 不同孵育时间原代小胶质细胞中IL-1β mRNA和TNF-α mRNA表达量变化
注:①与对照组比较,P<0.05。
小胶质细胞广泛分布于中枢神经系统内,在成人中枢神经系统中,小胶质细胞约占胶质细胞总数的15%。小胶质细胞是脑内重要的免疫细胞,在介导免疫反应时起着主要作用。未被激活的小胶质细胞有细长的突起,成分支状,能够分泌少量生长因子,起到维持神经元存活的作用。当脑内内环境发生变化时,小胶质细胞迅速被激活,激活的小胶质细胞形态可从分支状变成圆形或阿米巴状,细胞内多种细胞因子的转录和表达也随之增高,释放各种生物活性物质,如细胞因子、趋化因子、活性氧、活性氮和前列腺素等。其中小胶质细胞产生的IL、TNF是现在研究比较多的与中枢神经系统功能关系密切的细胞因子。IL是一种重要的前炎症因子,能够参与中枢神经系统内的神经-免疫-内分泌系统之间的调控,起到调节神经系统功能的作用。研究表明,发生中枢神经系统损伤后,脑内IL-1β水平会明显升高,说明其与脑功能损伤有着密切联系[13-14]。Fukuda等[15]研究IL-1β在癫痫中的作用时,采用高温诱导大鼠惊厥的方法,观察到IL-1β能够促进高温诱导的大鼠惊厥的发生。IL-1Ra 是IL-1受体拮抗剂,当IL-1Ra基因缺失时,IL-1Ra生成受阻,对IL-1β抑制作用减弱,也易发生热性惊厥;脑内注射IL-1Ra后可以观察到明显的抗惊厥和保护神经元的作用[16]。但也有观点认为IL-1β有抗癫痫的作用,Oprica 等[17]认为IL-1β对神经元有保护作用,能够减弱海人藻酸(KA)所致的神经元损伤。由此可见,IL-1β对中枢神经系统的影响具有两面性,一方面加重中枢神经的损伤,另一方面能够通过促进神经营养因子产生起到保护神经元的作用,二者作用机制可能不同,可能在炎症反应发生的不同阶段通过不同途径发挥着不同的作用。有必要对炎症发生后不同时段IL-1β及其他炎症因子的产生规律进行研究,以明确其对神经元的作用机制。TNF-α是由小胶质细胞、星形胶质细胞分泌的一种重要的前炎症因子,其和IL-1β一样,也与中枢神经系统损伤有着密切关系[18]。
LPS是革兰阴性杆菌细胞壁的组成成分,其对神经元影响不大,很适合做小胶质细胞活性的研究。LPS产生的炎症反应是由Toll样受体4(TLR4)介导的,它可以促使小胶质细胞分泌多种炎症递质[19-20]。TLR4通过MyD88依赖和非依赖两条通路激活核转录因子,而激活后的核转录因子能够进入胞核,启动IL-1、IL-6、TNF-α等相关基因的表达和蛋白的合成,促进炎症因子的生成和释放,释放到体液中的炎症因子参与炎症反应[21-23]。当损伤因素出现时,TLR4信号通路被激活并产生各种炎性因子,这些炎症因子在中枢神经系统损伤过程中起着重要作用。用LPS诱导小胶质细胞炎症反应时,LPS的作用时间与炎症因子的产生密切相关,只有合理的LPS作用时间才能够建立最佳的炎症反应模型。
本实验结果表明,以LPS(100 ng/mL)处理小胶质细胞后,培养液中IL-1β、TNF-α蛋白含量及小胶质细胞中IL-1β mRNA和TNF-α mRNA表达量明显增高,增高程度与LPS干预时间有关,小胶质细胞被LPS激活1 h后,IL-1β、TNF-α蛋白含量和mRNA表达量便明显上升,在LPS处理3 h,IL-1β达到高峰,以后随时间增加逐渐降低。而TNF-α则是在LPS处理6 h达到峰值,以后随时间增加而降低,到24 h时培养液中的IL-1β、TNF-α的含量和小胶质细胞中IL-1β mRNA和TNF-α mRNA表达量仍明显高于对照组。在LPS处理6 h时,培养液中IL-1β、TNF-α蛋白含量及小胶质细胞中IL-1β mRNA和TNF-α mRNA表达量均处于较高水平。提示LPS能够促进小胶质细胞产生IL-1β、TNF-α,这种效应与LPS的作用时间相关。在LPS作用6 h时二者均处于较高水平,故认为LPS刺激6 h时是理想的小胶质细胞炎症模型。
[参考文献]
[1]Ginhoux F,Greter M,Leboeuf M,et al. Fate mapping analysis reveals that adult microglia derive from primitive macrophages[J]. Science,2010,330(6005):841-845
[2]Wirenfeldt M,Babcock AA,Vinters HV. Microglia-insights into immune system structure,function,and reactivity in the central nervous system[J]. Histol Histopathol,2011,26(4):519-530
[3]Rivest S. Regulation of innate immune responses in the brain[J]. Nat Rev Immunol,2009,9(6):429-439
[4]Kraft AD,Harry GJ. Features of microglia and neuroinflammation relevant to environmental exposure and neurotoxicity[J]. Int J Environ Res Public Health,2011,8(7):2980-3018
[5]Mayer AM,Clifford JA,Aldulescu M,et al. Cyanobacterial Microcystis aeruginosa lipopolysaccharide elicits release of superoxide anion,thromboxane B2,cytokines,chemokines,and matrix metalloproteinase-9 by rat microglia[J]. Toxicol Sci,2011,121(1):63-72
[6]Auvin S,Mazarati A,Shin D,et al. Inflammation enhances epileptogenesis in the developing rat brain[J]. Neuro Dis,2010,40(1):303-310
[7]Friedman A,Dingledine R. Molecular cascades that mediate the influence of inflammation on epilepsy[J]. Epilepsia,2011,52(s3):33-39
[8]Maroso M,Balosso S,Ravizza T,et al. Interleukin-1β biosynthesis inhibition reduces acute seizures and drug resistant chronic epileptic activity in mice[J]. Neurotherapeutics,2011,8(2):304-315
[9]Savard A,Lavoie K,Brochu ME,et al. Involvement of neuronal IL-1β in acquired brain lesions in a rat model of neonatal encephalopathy[J]. J Neuroinflammation,2013,10(1):110
[10] Kaur G,Han SJ,Yang I,et al. Microglia and central nervous system immunity[J]. Neurosurgery Clinics of North America,2010,21(1):43-51
[11] Hanisch UK. Microglia as a source and target of cytokines[J]. Glia,2002,40(2):140-155
[12] Nakajima K,Takemoto N,Kohsaka S. Retinoic acid enhances the secretion of plasminogen from cultured rat microglia[J]. FEBS Lett,1992,314(2):167-170
[13] 牛廷献,罗晓红,史智勇,等. 癫痫大鼠血清和脑组织IL-1β、IL-6和TNF-α水平变化[J]. 放射免疫学杂志,2005,18(4):256-259
[14] Rao RS,Prakash A,Medhi B. Role of different cytokines and seizure susceptibility:a new dimension toward epilepsy research[J]. Indian J Exp Biol,2009,47(8):625
[15] Fukuda M,Suzuki Y,Ishizaki Y,et al. Interleukin-1beta enhances susceptibility to hyperthermia-induced seizures in developing rats[J]. Seizure,2009,18(3):211-214
[16] Dubé C,Vezzani A,Behrens M,et al. Interleukin-1beta contributes to the generation of experimental febrile seizures[J]. Ann Neurol,2005,57(1):152-155
[17] Oprica M,Eriksson C,Schultzberg M. Inflammatory mechanisms associated with brain damage induced by kainic acid with special reference to the interleukin-1 system[J]. J Cell Mol Med,2003,7(2):127-140
[18] Savin C,Triesch J,Meyer-Hermann M. Epileptogenesis due to glia-mediated synaptic scaling[J]. J R Soc Interface,2009,6(37):655-668
[19] Ock J,Jeong J,Choi WS,et al. Regulation of Toll-like receptor 4 expression and its signaling by hypoxia in cultured microglia[J]. J Neurosci Res,2007,85(9):1989-1995
[20] Kim DC,Kim SH,Jeong MW,et al. Effect of rottlerin,a PKC-δ inhibitor,on TLR-4-dependent activation of murine microglia[J]. Biochem Biophys Res Commun,2005,337(1):110-115
[21] McGettrick AF,O’Neill LAJ. Regulators of TLR4 signaling by endotoxins[M]. Endotoxins: Structure,Function and Recognition. Springer Netherlands,2010:153-171
[22] An HZ,Qian C,Cao XT. Regulation of Toll-like receptor signaling in the innate immunity[J]. Science China Life Sciences,2010,53(1):34-43
[23] Buchanan MM,Hutchinson M,Watkins LR,et al. Toll-like receptor 4 in CNS pathologies[J]. J Neurochem,2010,114(1):13-27
Study on time-effect relationship of IL-1β and TNF-α coming from microglia treated with LPS
BAI Yujuan, LI Qijun, ZHOU Hongyan, LI Yan, ZHANG Guoliang
(The Third Hospital of Shijiazhuang, Shijiazhuang 050011, Hebei, China)
Abstract:Objective Primary cerebral cortical microglia of rat was cultured and treated with LPS to observe the time-effect relationship of IL-1β and TNF-α with treatment time of LPS, in order to find when microglia generate a large amount of IL-1β and TNF-α with the treatment to provide evidences for the establish of best microglia inflammatory models. Methods Primary cerebral cortical microglia of SD rat was cultured and divided into 10 groups randomly ,five groups were treated with serum-free medium included LPS(final concentration 100 ng/mL) for different time (1 h, 3 h, 6 h, 12 h, 24 h). Parallel control groups were arranged to each above groups and treated with serum-free medium for the same time. And then,the protein levels of IL-1β and TNF-α in the culture media were detected through ELISA and the expressions of IL-1β mRNA and TNF-α mRNA in the microglia cells were detected through RT-PCR. Results After 1 h, 3 h, 6 h, 12 h, 24 h of treatment by LPS, the protein levels of IL-1β and TNF-α in the culture media and mRNA expression levels of IL-1β and TNF-α in the microglia cells of LPS groups increased remarkably compared with the control groups (P<0.05); the time point of the highest expression of IL-1β was 3 h, the time point of the highest expression of TNF-α was 6 h, both of their amount stayed at higher status at 6 h, and then declined little by little with the extension of the time,and the differences were significant between every groups(P>0.05). Conclusion LPS can stimulate microglia cells to generate a large amount of IL-1β and TNF-α and this is time-depended , both of their amount stay at higher status at 6 h. It is better model of inflamation when microglia was treated with LPS for 6 h.
Key words:LPS; microglia; interleukin-1β; Tumor necrosis factor-α
[收稿日期]2015-10-30
[中图分类号]R-33
[文献标识码]A
[文章编号]1008-8849(2016)08-0828-05
doi:10.3969/j.issn.1008-8849.2016.08.009
[作者简介]白玉娟,女,主管护师,从事神经电测听工作。[通信作者]李琦军,E-mail:13832121438@163.com
