NB09方案治疗4期神经母细胞瘤患儿效果分析
2016-05-31钟本富赵强闫杰王景福李璋琳曹嫣娜李杰李忠元王会娟
钟本富,赵强,闫杰,王景福,李璋琳,曹嫣娜,李杰,李忠元,王会娟
NB09方案治疗4期神经母细胞瘤患儿效果分析
钟本富,赵强△,闫杰,王景福,李璋琳,曹嫣娜,李杰,李忠元,王会娟
摘要:目的探讨4期神经母细胞瘤(NB)患儿的综合治疗效果及预后。方法回顾性分析95例4期NB患儿,根据患儿接受的治疗方案,比较NB09方案及非NB09方案的疗效差别,并分析影响4期患儿预后的相关因素。全组患儿中位年龄48个月(4~136个月),中位随访时间21个月(4~179个月),NB09方案治疗患儿40例,非NB09方案治疗55例。结果NB09组患儿3年总生存率(OS)及无疾病进展生存率(PFS)情况均明显好于非NB09组(χ2分别为6.916和10.025,P<0.05)。对全组患儿预后行单因素分析,治疗方案、病理类型、骨髓受累>20%、NMYC扩增、手术范围、是否维甲酸诱导、乳酸脱氢酶(LDH)>1 000 U/L及短期疗效达非常好的部分缓解(VGPR)为影响全组患儿预后的因素。多因素分析显示,影响整组患儿预后的独立因素为骨髓受累>20%(P<0.05)。结论接受了NB09方案治疗的4期患儿预后较其他患儿好,骨髓受累>20%的4期患儿预后差,需加强治疗强度。
关键词:神经母细胞瘤;治疗;预后;儿童;NB09方案
△通讯作者E-mail: qiangzhao169@aliyun.com
神经母细胞瘤(neuroblastoma,NB)是一种儿童常见的实体肿瘤,以晚期预后差为其特点,国内报道晚期NB患儿5年生存率不足50%[1-4]。由于医疗水平及经验的差异,国内各单位4期NB患儿的治疗效果与美国、欧洲等发达国家存在较大差距。为规范国内NB诊疗以及探究适合国情的治疗方案,中国抗癌协会小儿肿瘤专业委员会(CCCG)于2009年讨论通过了国内相对统一的神经母细胞瘤诊疗方案——NB09方案。本研究通过评估NB09方案在4期NB患儿治疗中的疗效,探讨其与相关预后因素的关系,为NB的研究及临床治疗提供参考。
1 资料与方法
1.1一般资料分析1995年4月—2014年4月天津医科大学肿瘤医院儿童肿瘤科收治的4期NB患儿病例资料。入选标准:(1)4期NB诊断明确。(2)非初治的病例,仅在外院行穿刺活检或切检。(3)若属难治病例,在我院接受了4个疗程以上化疗治疗。(4)随访记录完整可靠。排除标准:(1)治疗反应良好但家属中途放弃的病例。(2)在外院接受化疗在4个疗程以上。(3)失访。符合上述条件的患儿共95例。本研究治疗前均取得每位患儿监护人的知情同意,并获得天津医科大学肿瘤医院伦理委员会的批准。95例中男59例,女36例,中位年龄48个月(4~136个月)。骨髓转移80例(84.2%),骨转移54例(56.8%),远处淋巴结转移34例(35.8%),球后转移5例(5.3%),肾脏2例(2.1%),肝脏3例(3.1%),合并骨、骨髓转移41例(43.2%)。原发情况:颈部5例(5.3%),后纵隔9例(9.5%),腹部(腹膜后28例,肾上腺50例)共78例(82.1%),盆腔3例(3.1%)。胸腹联合2例(2.1%)。共有28例患儿行N-MYC基因检测,其中扩增5例。
1.2诊断、分期及分组具备以下两者之一即可确诊:(1)肿瘤组织(穿刺活检或切检)光镜下获得肯定的病理学诊断。(2)骨髓抽吸涂片和活检发现特征性神经母细胞,并且伴有血清或尿中儿茶酚胺或其代谢产物升高。肿瘤分期参照国际神经母细胞瘤(INSS)分期系统[5]。本组患儿均存在远处转移,符合INSS 4期诊断。根据是否采用NB09方案治疗,将患儿分为NB09组(40例)及非NB09组(55例)。
1.3治疗入院后评估患儿全身及局部肿物情况,具有一期全切可能的,选择一期手术以获取病理学证据,术后继续给予辅助化疗。评估手术风险较大的患儿,给予术前辅助化疗,每2个疗程评估手术,术后继续给予辅助化疗,总疗程数不超过12个(早期不超过18个),术后化疗过程中评估具有自体骨髓干细胞移植(ABMT)指征的患儿,经家属同意后选择ABMT支持下的大剂量化疗。治疗后评估仍有肿瘤残留的、具有二次手术可能的患儿,行二次手术。结束化疗后,根据患儿个体手术情况给予适当剂量的瘤床放疗。放疗或化疗结束后,全顺维甲酸120~160 mg/m2,每个月给药14 d,共6个月。患儿在不同时间段接受的3个治疗方案见表1。
1.4疗效评估及随访治疗过程中每2~4个疗程、治疗结束后3年内每3~6个月行影像学复查。根据国际NB治疗反应标准(INRC)[7]进行疗效判定。完全缓解(CR):所有原发灶和转移灶消失,儿茶酚胺及代谢产物恢复到正常水平。非常好的部分缓解(VGPR):原发灶体积减少90%~99%,所有可测量转移灶消失,儿茶酚胺及代谢产物恢复到正常,但99Tc扫描骨骼病灶可以是阳性。部分缓解(PR):所有原发灶和可测量转移灶体积减少超过50%,骨骼阳性病灶的数目下降超过50%,不超过一处的骨髓阳性部位可以接受。混合性反应(MR):没有新病灶,任何一个或多个可测量的病灶体积下降超过50%,同时存在其他任何一个或多个病灶体积下降小于50%,任何存在的病灶体积增加小于25%。无反应(NR):没有新病灶,任何存在的病灶体积下降小于50%或增加小于25%。疾病进展(PD):出现新病灶,已存在可测量的病灶体积增加超过25%,骨髓由阴性转阳性。采用门诊、书信或电话随访。结束治疗后未满3年,但与医生失去联系大于6个月为失访。疾病进展定义为肿瘤原发灶进展、骨髓进展或新病灶出现。统计终点为疾病进展、复发、死亡或随访终点。末次随访时间为2015年4月。
1.5统计学方法应用SPSS 19.0统计软件分析所有数据。计量资料以±s表示,2组间比较采用t检验,多组间比较采用方差分析。计数资料以例(%)表示,行χ2检验。Ka⁃plan-Meier法分析患儿生存率,单因素分析采用Log-rank χ2检验,多因素分析采用Cox回归模型。P<0.05为差异有统计学意义。
2 结果
2.1生存分析全组中位随访时间21个月(4~179个月)。全组3年总生存率(OS)为33.6%(32/ 95),无疾病进展生存率(PFS)为30.5%(29/95)。NB09组患儿3年OS为56.3%,PFS为51.5%,均明显高于非NB09组的21.8%和18.2%,差异有统计学意义(χ2分别为6.916和10.025,P<0.05),见图1、2。全组患儿经治疗后达到VGPR+CR共59例(排除存活、但随访期未满24个月的病例),其中37例(62.7%)复发,复发部位以骨髓、原发灶、骨髓联合原发灶、骨髓联合颅内复发多见,复发时间为VGPR后2个月~2年多见,仅1例为结束治疗5年后复发。NB09组复发率明显低于非NB09组,差异有统计学意义(P<0.05),见表2。

Tab. 1 The different treatment protocols on stage 4 neuroblastomas表1 不同时间段4期NB患儿接受治疗情况
2.2预后分析不同治疗方案、病理类型、骨髓受累是否>20%(骨髓涂片镜下观察超过20%瘤细胞浸润)、N-MYC扩增情况、手术范围、是否维甲酸诱导、是否乳酸脱氢酶(LDH)>1 000 U/L(正常值参考范围:0~248 U/L)及是否达到VGPR以上的患者,PFS差异有统计学意义,见表3。分类变量具体赋值为:(1)非NB09组=0,NB09组=1;(2)NB=0,节细胞神经母细胞瘤(GNB)=1,不明确=2。(3)骨髓受累≤20%=0,>20%=1。(4)N-MYC扩增=0,不扩增=1,不明确=2。(5)手术全切=0,大部分切除=1,其他=2。(6)维甲酸诱导=0,非维甲酸诱导=1。(7)LDH≤1 000 U/L=0,LDH>1 000 U/L=1。(8)近期疗效达VGPR=0,近期疗效未达VGPR=1。多因素分析显示:仅骨髓受累>20%为4期NB患儿预后的独立影响因素,见表4。

Fig.1 The overall survival curves of two groups图1 2组总生存曲线比较

Fig. 2 The progress-free survival curves of two groups 图2 2组无疾病进展生存曲线比较
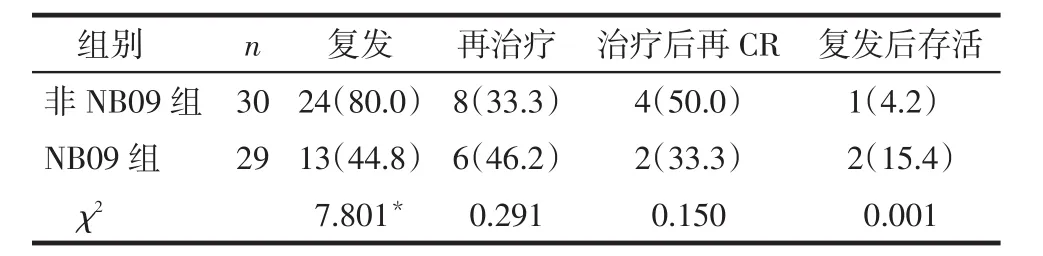
Tab.2 The recurrence and re-treatment of the two groups表2 2组患儿复发及再治疗情况 例(%)

Tab. 3 Comparison of PFS in three years betweendifferent factors表3 不同因素NB患儿3年PFS比较 例(%)
3 讨论
NB虽是儿童的第三大恶性肿瘤,其发病率却很低,成立多中心协作组为大样本基础研究、临床经验积累、临床试验的进行及临床数据的统计分析等提供了很好的平台。2004年成立的国际神经母细胞瘤危险度协作组(INRG)[8]是目前世界上最大的NB协作组织,为NB患儿提供了最有效的诊疗意见,但限于医疗资源及水平的差异,国内各中心均不能完全参照其意见进行诊疗,因此,2009年CCCG讨论通过了国内相对统一的NB09方案,并在志愿加入的中心(如上海儿童医学中心、天津医科大学肿瘤医院及南京儿童医院等)实施。从本研究中可发现,接受NB09方案治疗的患儿,不论是3年OS或3年PFS均明显高于非NB09方案组患儿,肯定了NB09方案对4期NB患儿的积极疗效。另外,从2组患儿的复发情况亦可看出,NB09组患儿复发率明显降低,提示这可能与部分耐药性肿瘤细胞对新方案的重新敏感及新方案对骨髓转移更加敏感有关。结合复发患儿大部分发生于治疗后2年内的特点可以推测,接受NB09方案治疗的患儿将会较非NB09组获得一个明显好的5年生存结果。但值得注意的是,虽然2组患儿短期治疗效果均较好,但患儿2年内复发比例均较高,分别为80.0%(非NB09组)、44.8%(NB09组),即获得VGPR以上的NB09组患儿2年内仍有近半数的患儿复发,提示NB09方案只能提高部分患儿的预后,即单纯地通过增加化疗强度并不能进一步有效地提高4期NB患儿的预后,需要引入更加特异性、敏感性的治疗手段如免疫治疗[9-10]、131I-MIGB放疗[11]等。
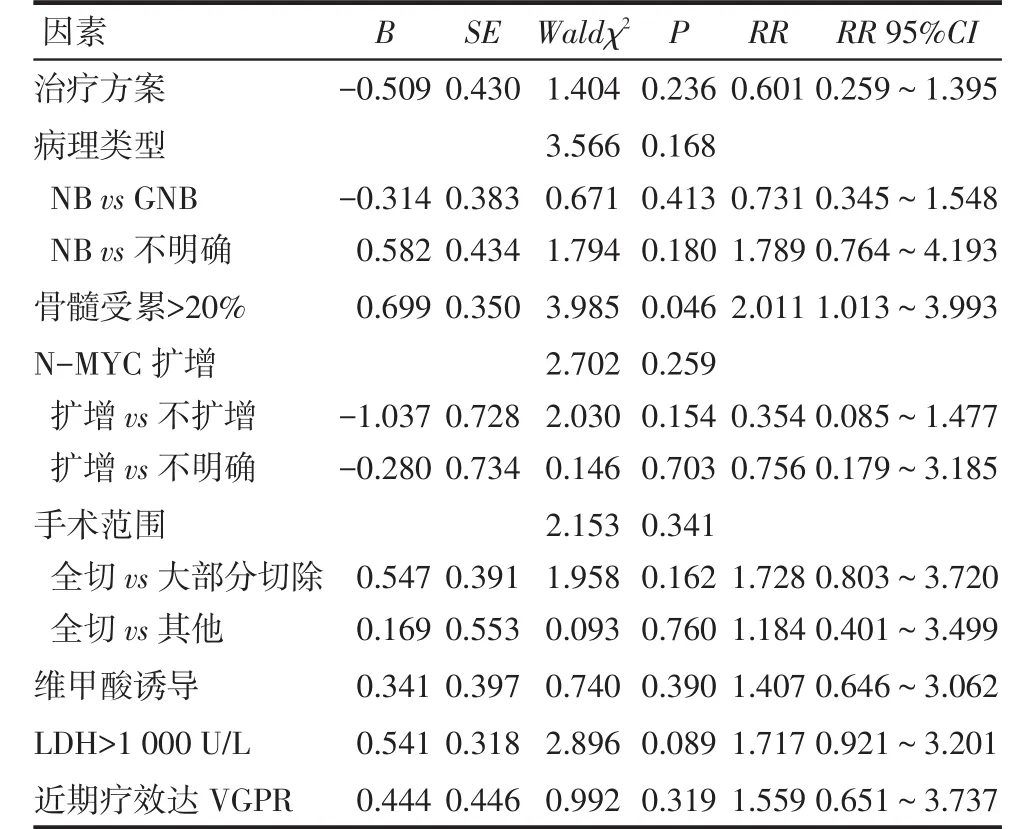
Tab. 4 The multivariate analysis of prognostic factors for 95 children with stage 4 neuroblasomas表4 95例4期NB患儿多因素回归模型预后分析
本研究分析影响4期患儿的预后因素,发现年龄是否小于1.5岁并不影响患儿预后,与张安安等[1]报道不一致,考虑与本组小于1.5岁的患儿比例不高(14/95)有关。另外,腹部原发及N-MYC扩增并不是整组患儿预后的独立影响因素,可能与腹部原发患儿在本组患儿中占的比例较高及检测N-MYC患儿的例数太少有关。在本研究中,5例N-MYC扩增患儿均在治疗过程中因疾病进展或复发而死亡,而N-MYC不扩增的23例患儿3年PFS为73.9%,明显高于整组患儿的3年PFS,说明N-MYC仍是重要的预后影响指标。Log-rank检验结果显示骨髓受累>20%(骨髓涂片)为影响整组患儿预后的危险因素。提醒医生:针对这类患儿给予更强、更特异的治疗如ABMT支持下的清髓化疗、免疫治疗等可能有助于改善患儿预后。
在治疗上,发现放疗并没改善4期患儿的预后,而维甲酸诱导治疗在4期患儿的预后分析中为影响4期患儿的因素,提示:(1)减少不适当的瘤床放疗,避免放疗给患儿带来的不良反应。(2)对4期患儿结束放化疗后都应常规应用维甲酸诱导分化治疗。但是,原发灶手术切除范围与4期患儿预后的关系一直不明确[12-14]。本研究发现,手术切除是4期NB患儿的重要治疗手段,为4期患儿的预后影响因素,但肉眼全切与大部分切除患儿的3年PFS差异无统计学意义,与李鹏飞等[2]研究结果一致。因此,在避免严重手术并发症和减少术后恢复时间的原则下,对4期患儿行原发灶的尽可能大范围切除对患儿的预后是有益的,但应避免行激进全切手术。另外,NB09方案借鉴国外经验,将干细胞移植支持下的清髓化疗纳入综合治疗中,本研究提示ABMT治疗并未明显提高4期患儿的预后,与国内报道[1-2, 15]一致,但本结果为单中心研究结果,接受ABMT治疗的患儿例数较少,其临床实际疗效仍需进一步观察。
参考文献
[1] Zhang AA, Pan C, Ye QD, et al. Long-term follow-ups of compre⁃hensive therapies for stage 4 neuroblastoma[J].Natl Med J China, 2014,94(20):1547-1552. [张安安,潘慈,叶启东,等. 4期神经母细胞瘤综合治疗的远期随访观察[J].中华医学杂志, 2014, 94 (20):1547-1552]. doi:10.3760/cma.j.issn.0376-2491.2014.20.008.
[2] Li PF, Liu JC, Zhen ZJ, et al. Effect of excision extension of primary tumors on local control and survival of stage IV neuroblastoma[J].Chin J Clin Oncol,2014, 41(24):1568-1572. [李鹏飞,刘均澄,甄子俊,等. 4期神经母细胞瘤手术切除范围对预后的影响[J].中国肿瘤临床, 2014, 41(24): 1568-1572]. doi:10.3969/j.issn.1000-8179.20141222.
[3] Li ZY, Zhao Q, Wang JF, et al. Clinical and Prognostic Analysis of 100 Patients with Neuroblastoma[J]. Chin J Clin Oncol, 2011, 38(3): 155-158. [李忠元,赵强,王景福,等. 100例神经母细胞瘤临床预后分析[J].中国肿瘤临床, 2011, 38(3): 155-158]. doi:10.3969/j. issn.1000-8179.2011.03.009.
[4] Yang HY, Wang YN, Gao J, et al. Clinical analysis of neuroblasto⁃ma in children[J].Chin J Pediatr Surg, 2014, 35(2):100-103.[杨合英,王艳娜,高建,等.小儿神经母细胞瘤的临床分析[J].中华小儿外科杂志, 2014, 35(2):100-103]. doi:10.3760/cma.j.issn.0253-3006.2014.02.006.
[5] Brodeur GM, Pritchard J, Berthold F, et al. Revisions of the interna⁃tional criteria for neuroblastoma diagnosis, staging, and response to treatment[J]. J Clin Oncol, 1993, 11(8): 1466-1477.
[6] Wei CJ, Zhao Q, Yan J, et al. Short term curative effect of NB09 pro⁃tocol on high-risk and ultra-high-risk neuroblastoma[J]. Tianjin Med J, 2015, 43(2): 189-192. [魏婵娟,赵强,闫杰,等. NB09方案治疗高危和极高危神经母细胞瘤近期疗效观察[J].天津医药, 2015, 43(2): 189-192]. doi:10.11958/j.issn.0253-9896.2015.02.020.
[7] Brodeur GM, Pritchard J, Berthold F, et al. Revisions of the interna⁃tional criteria for neuroblastoma diagnosis, staging and response to treatment[J]. Prog Clin Biol Res, 1994, 385:363-369.
[8] Cohn SL, Pearson AD, London WB, et al. The International Neuro⁃blastoma Risk Group (INRG) classification system: an INRG Task Force report[J]. J Clin Oncol, 2009, 27(2): 289-297. doi: 10.1200/ JCO.2008.16.6785.
[9] Cheung NK, Cheung IY, Kushner BH, et al. Murine anti- GD2 monoclonal antibody 3F8 combined with granulocyte-macrophage colony-stimulating factor and 13-cis-retinoic acid in high-risk pa⁃tients with stage 4 neuroblastoma in first remission[J]. J Clin Oncol, 2012,30(26):3264-3270.doi: 10.1200/JCO.2011.41.3807.
[10] Parsons K, Bernhardt B, Strickland B. Targeted immunotherapy for high- risk neuroblastoma-- the role of monoclonal antibodies[J]. Ann Pharmacother, 2013, 47(2): 210-218. doi: 10.1345/aph.1R353.
[11] Hamidieh AA, Beiki D, Paragomi P, et al. The potential role of pre⁃transplant MIBG diagnostic scintigraphy in targeted administration of 131I-MIBG accompanied by ASCT for high-risk and relapsed neuroblastoma: a pilot study[J]. Pediatr Transplant, 2014, 18(5): 510-517. doi: 10.1111/petr.12271.
[12] Kuroda T, Saeki M, Honna T, et al. Clinical significance of inten⁃sive surgery with intraoperative radiation for advanced neuroblasto⁃ma: does it really make sense[J]? J Pediatr Surg, 2003, 38(12): 1735-1738. doi:10.1016/j.jpedsurg.2003.08.043.
[13] Adkins ES, Sawin R, Gerbing RB, et al. Efficacy of complete resec⁃ tion for high-risk neuroblastoma: a Children′s Cancer Group study [J]. J Pediatr Surg, 2004, 39(6): 931- 936. doi:10.1016/j.jped⁃surg.2004.02.041.
[14] Zwaveling S, Tytgat GA, van der Zee DC, et al. Is complete surgical resection of stage 4 neuroblastoma a prerequisite for optimal survival or may >95% tumour resection suffice[J]? Pediatr Surg Int, 2012, 28 (10):953-959. doi:10.1007/s00383-012-3109-3.
[15] Tang SQ, Huang DS, Wang JW, et al. Long-term effect of high dose chemotherapy combined with stem cell transplantation on stageⅣneuroblastoma in children[J]. Chin J Contemp Pediatr, 2006, 8(2):93-96. [唐锁勤,黄东生,王建文,等.大剂量化疗造血干细胞移植治疗Ⅳ期神经母细胞瘤的长期疗效研究[J].中国当代儿科杂志, 2006, 8(2):93-96]. doi:10.3969/j.issn.1008-8830.2006.02.003.
(2015-06-08收稿2015-10-13修回)
(本文编辑魏杰)
作者单位:天津医科大学肿瘤医院儿童肿瘤科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室(邮编300060)
Analysis of curative effect of the NB09 protocol based on 95 children with stage 4 neuroblastomas
ZHONG Benfu, ZHAO Qiang△, YAN Jie, WANG Jingfu, LI Zhanglin, CAO Yanna, LI Jie, LI Zhongyuan, WANG Huijuan
Department of Pediatric Oncology, Tianjin Medical University Cancer Hospital, National Clinical Research Center for Cancer,
Key Laboratory of Cancer Prevention and Therapy, Tianjin 300060, China
△Corresponding Author E-mail: qiangzhao169@aliyun.com
Abstract:Objective To assess the outcomes of stage 4 neuroblastomas (NB), and analyze the associated prognostic factors. Methods Ninety-five children with stage 4 NB were retrospectively analyzed. The curative effects and related fac⁃tors affecting prognosis were compared between NB09 protocol group (n=40) and non-NB09 group (n=55). The median age of 95 children was 48 months (4-136 months), and the median follow-up time was 21 months (4-179 months). Results The total survival rate and progression free survival rate were significantly better in NB09 group than those of non-NB09 group (χ2=6.916 and 0.025,P<0.05). The univariate analysis showed that treatment plan, pathologival type, bone marrow involve⁃ment>20%, N-MYC amplification, surgical extent<90%, non-therapy of cis-retinoic acid, LDH>1 000 U/L and very good partial remission (VGPR) were the influencing factors for the prognosis in children (P<0.05). Multivariate regression analy⁃sis showed that bone marrow involvement>20% was the bad independent prognostic factors for stage 4 patients. Conclu⁃sionChildren with stage 4 NB treated according to the NB09 protocol have a better prognosis. Children of stage 4 neuro⁃blastomas with bone marrow involvement >20% have a bad prognosis to current treatment.
Key words:neuroblastoma; therapy; prognosis; child; NB09 protocol
中图分类号:R739.4
文献标志码:A
DOI:10.11958/59060
基金项目:天津市应用基础研究计划项目(10JCYBJC11600)
作者简介:钟本富(1990),男,硕士在读,主要从事儿童实体肿瘤综合治疗方面研究
