饮水铅暴露对大鼠脑组织APE1表达的影响及与氧化应激的关系研究
2016-05-31任清风李炜娟徐群英张中伟李伟冯建高任晓慧肖元梅
任清风,李炜娟,徐群英,张中伟,李伟,冯建高,任晓慧,肖元梅∆
饮水铅暴露对大鼠脑组织APE1表达的影响及与氧化应激的关系研究
任清风1,2,李炜娟1,3,徐群英1,张中伟1,李伟1,冯建高1,任晓慧1,肖元梅1∆
摘要:目的探讨饮水铅暴露对大鼠大脑皮质、小脑、海马组织中脱嘌呤脱嘧啶核酸内切酶1(APE1)表达的影响及其与氧化应激的关系。方法40只刚断乳雄性SD大鼠按体质量随机区组法均分为5组,对照组自由饮用去离子水,4个铅暴露组分别饮用100、200、400和800 mg/L醋酸铅溶液,连续染毒60 d后,取大脑皮质、小脑和海马组织,测定各组的超氧化物歧化酶(SOD)活力、过氧化氢(H2O2)水平和丙二醛(MDA)含量,蛋白印迹法检测APE1蛋白在各组织中的表达。结果铅暴露后,大脑皮质、小脑、海马中APE1蛋白表达水平均低于对照组,且随染铅剂量的升高呈逐渐下降趋势(P<0.05);随着染铅剂量的升高,大脑皮质、小脑和海马中的SOD活力基本呈下降趋势;而H2O2及MDA含量随染铅剂量的升高基本呈逐渐升高趋势,大脑皮质、小脑和海马组织的APE1蛋白表达水平与其SOD活力呈正相关(r分别为0.619、0.380、0.375,P < 0.05),而与H2O2水平和MDA含量呈负相关(r分别为-0.472、-0.535、-0.436,-0.514、-0.486、-0.316,P < 0.05)。结论饮水铅暴露可导致大鼠脑组织APE1蛋白表达水平改变,且此种改变与铅所致的氧化应激有关。
关键词:铅;脑组织;氧化应激;脱嘌呤脱嘧啶核酸内切酶1;超氧化物歧化酶;过氧化氢;丙二醛
∆通讯作者E-mail:xym72@163.com
铅既是主要的环境和食品污染物,也是常见的工业毒物。铅具有很强的毒性,其中最严重的健康危害是神经毒性,中枢神经系统(central nervous sys⁃tem,CNS)是铅发挥神经毒性作用的主要靶器官之一[1]。然而铅神经毒性的确切机制目前仍不清楚。有文献报道诱导氧化应激是铅神经毒性的机制之一[2-3]。低浓度铅可通过诱导细胞发生氧化应激而损伤细胞膜、DNA及抗氧化防御系统[4]。DNA氧化性损伤是氧化应激损伤的一种最突出的表现形式[5],且DNA氧化损伤最终往往会导致机体细胞的凋亡、衰老及肿瘤的发生,而DNA碱基切除修复(BER)是针对这类损伤的主要修复途径[6]。脱嘌呤脱嘧啶核酸内切酶1(APE1)的主要功能就是在DNA BER途径中发挥重要作用,其还可介导转录因子的氧化还原调控[7],但有关铅暴露对APE1蛋白的影响尚少见报道。本研究通过分析铅暴露后大鼠脑组织中APE1的表达水平变化及其与氧化应激的关系,为进一步探讨铅神经毒性机制提供科学依据。
1 材料与方法
1.1主要试剂与仪器三水合乙酸铅(分析纯,西陇化工厂);组织蛋白质提取试剂盒(美国OMEGA公司);超氧化物歧化酶(SOD)、过氧化氢(H2O2)和丙二醛(MDA)检测试剂盒(南京建成生物工程研究所);β-actin鼠单克隆抗体(美国earthox公司);Anti-APE1兔多克隆抗体(英国abcam公司);组织蛋白质测定试剂盒(碧云天生物技术研究所)。TS-1摇床(海门市其林贝尔仪器制造有限公司);电泳仪、电泳槽、转膜槽(美国Bio-RAD公司);QYDO-10A去离子水系统(美国millipore公司);低温高速离心机(德国Thermo公司)。
1.2实验动物分组及处理40只刚断乳SPF级健康、雄性SD大鼠,体质量90~100 g,购自北京维通利华实验动物有限公司,动物合格证号:SCXK(京)2012-0001,适应性喂养1周后按体质量采用随机区组法分为对照组和4个铅暴露组,每组8只,对照组自由饮用去离子水,4个铅暴露组分别饮用100、200、400、800 mg/L的醋酸铅溶液,动物染毒和组织处理方法参照肖元梅等[8]的方法。
1.3检测指标及其方法(1)按试剂盒说明书操作检测脑组织的SOD活力、H2O2水平和MDA含量[8]。(2)蛋白印迹法(Western blotting)检测脑组织APE1表达:按试剂盒所示方法提取组织蛋白后,测定蛋白浓度,常规经过制胶、上样、电泳、转膜、封闭、孵育一抗、孵育二抗及曝光等步骤,用IPP (Image Pro Plus 6.0)软件分析目的蛋白APE1条带光密度(OD)值和内参β-actin条带OD值,最后计算目的蛋白/内参的OD比值,从而得出APE1蛋白在皮质、小脑和海马中的相对表达量。
2 结果
2.1各组大鼠脑组织中APE1蛋白表达水平比较铅暴露后,大鼠大脑皮质、小脑和海马中的APE1蛋白表达水平,200、400、800 mg/L组均低于对照组,100 mg/L组小脑中的APE1水平也低于对照组(P<0.05);且基本随铅浓度的升高,APE1蛋白水平呈逐渐下降趋势,见表1。
Tab. 1 Comprison of APE1 protein level in rat brain tissue between five groups表1 各组大鼠脑组织中APE1蛋白表达水平比较(n=8,±s)
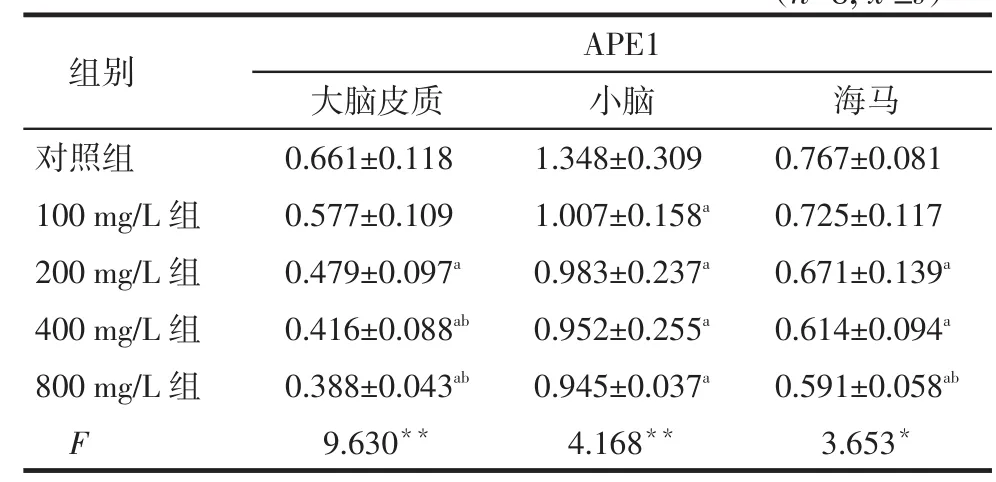
Tab. 1 Comprison of APE1 protein level in rat brain tissue between five groups表1 各组大鼠脑组织中APE1蛋白表达水平比较(n=8,±s)
*P<0.05,**P<0.01;a与对照组比较,b与100 mg/L组比较,P<0.05
组别对照组100 mg/L组200 mg/L组400 mg/L组800 mg/L组F APE1大脑皮质0.661±0.118 0.577±0.109 0.479±0.097a0.416±0.088ab0.388±0.043ab9.630**小脑1.348±0.309 1.007±0.158a0.983±0.237a0.952±0.255a0.945±0.037a4.168**海马0.767±0.081 0.725±0.117 0.671±0.139a0.614±0.094a0.591±0.058ab3.653*
2.2各组大鼠脑组织中SOD、H2O2和MDA含量比较铅暴露组大脑皮质、小脑和海马中的SOD活力均低于对照组,并随着染铅剂量的升高,SOD活力基本呈下降趋势;而H2O2及MDA含量基本随染铅剂量的升高呈逐渐升高趋势,见表2~4。
Tab. 2 Comprison of the SOD activity in rat brain tissues between five groups表2 各组大鼠脑组织SOD活力比较(n=8,U/mg prot,±s)
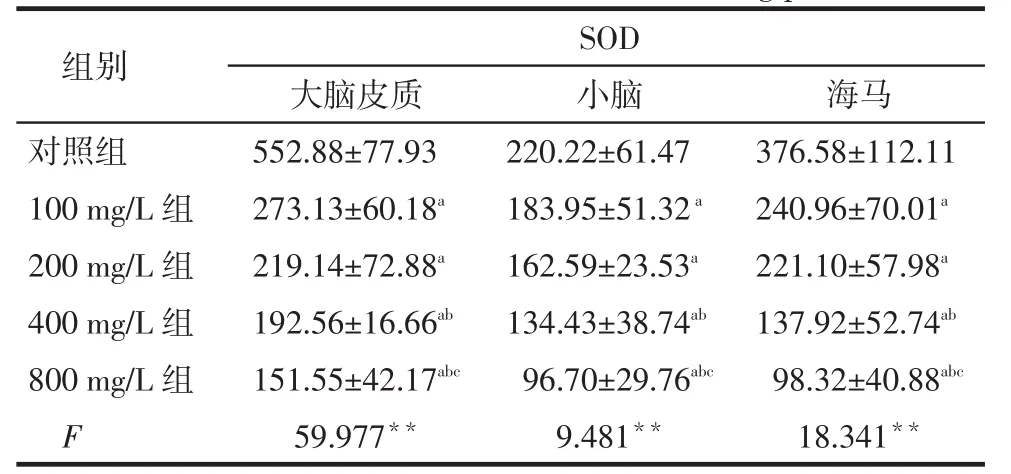
Tab. 2 Comprison of the SOD activity in rat brain tissues between five groups表2 各组大鼠脑组织SOD活力比较(n=8,U/mg prot,±s)
**P<0.01;a与对照组比较,b与100 mg/L组比较,c与200 mg/L组比较, P < 0.05
组别对照组100 mg/L组200 mg/L组400 mg/L组800 mg/L组F大脑皮质552.88±77.93 273.13±60.18a219.14±72.88a192.56±16.66ab151.55±42.17abc59.977**SOD小脑220.22±61.47 183.95±51.32a162.59±23.53a134.43±38.74ab96.70±29.76abc9.481**海马376.58±112.11 240.96±70.01a221.10±57.98a137.92±52.74ab98.32±40.88abc18.341**
2.3大鼠脑组织中APE1蛋白水平与氧化应激的关系大鼠大脑皮质、小脑和海马的APE1蛋白表达水平与其SOD活力呈正相关,与H2O2水平及MDA含量呈负相关(均P<0.05),见表5。
3 讨论
DNA氧化性损伤是氧化应激损伤的一种最突出的表现形式[5],主要以氧化性碱基损伤为主,并可能最终导致机体细胞的凋亡、衰老及肿瘤的发生。为了应对包括DNA氧化损伤在内的多种DNA损伤,维持基因组的完整性,生物体在进化过程中形成了相应的修复机制。BER是氧化应激诱导的DNA氧化损伤的主要修复途径,主要清除小的、非螺旋化的可能在复制过程中发生突变或导致单链断裂的低分子[6,9]。
Tab. 3 Comprison of the H2O2content in rat brain tissues between five groups表3 各组大鼠脑组织H2O2含量比较(n=8, mmol/g prot,±s)

Tab. 3 Comprison of the H2O2content in rat brain tissues between five groups表3 各组大鼠脑组织H2O2含量比较(n=8, mmol/g prot,±s)
**P<0.01;a与对照组比较,b与100 mg/L组比较, P < 0.05
组别对照组100 mg/L组200 mg/L组400 mg/L组800 mg/L组F大脑皮质16.37±3.33 20.03±2.29 23.17±5.32a25.49±9.00ab26.85±1.29ab5.653**H2O2小脑9.20±0.58 14.97±1.71a15.51±1.96a16.44±2.11a17.38±2.53ab22.880**海马11.93±1.31 13.11±2.07 14.69±2.06a15.35±2.96ab16.02±1.34ab5.381**
Tab. 4 Comprison of the MDA content in rat brain tissues between five groups表4 各组大鼠脑组织MDA含量比较(n=8,μmol/g prot,±s)

Tab. 4 Comprison of the MDA content in rat brain tissues between five groups表4 各组大鼠脑组织MDA含量比较(n=8,μmol/g prot,±s)
*P<0.05,**P<0.01;a与对照组比较,b与100 mg/L组比较,c与200 mg/L组比较,d与400 mg/L组比较, P < 0.05
组别对照组100 mg/L组200 mg/L组400 mg/L组800 mg/L组F大脑皮质0.87±0.17 1.09±0.36 1.15±0.14 1.31±0.15a1.49±0.46ab3.735*MDA小脑0.61±0.11 0.65±0.10 0.81±0.19ab0.84±0.09ab0.98±0.06abcd13.132**海马0.66±0.12 1.06±0.28a1.16±0.16a1.19±0.38a1.21±0.21a6.838**
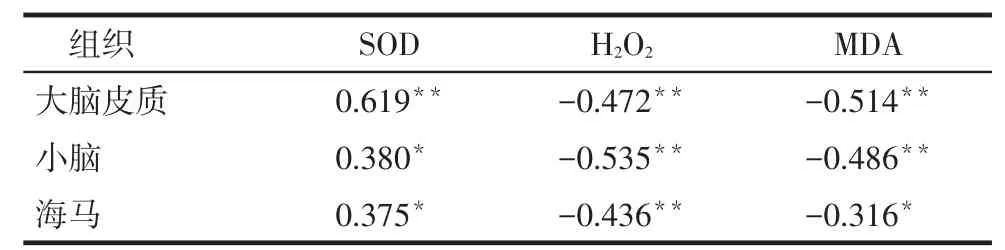
Tab. 5 The correlation between APE1 protein level and oxidative stress index in rat brain tissues表5 大鼠脑组织APE1蛋白表达水平与氧化应激指标相关性分析 (r)
APE1主要在DNA BER途径中发挥重要作用。APE1是BER过程中主要的限速酶,其在这一过程作为脱嘌呤、脱嘧啶位点(AP位点)核酸内切酶发挥重要作用[10]。这一过程中,APE1能够水解AP位点5′磷酸二酯酶键产生一个含有3′羟基和5′脱氧核糖磷酸末端的单链DNA中间体[11]。
Kelley等[12]研究发现APE1的DNA修复作用是受氧化还原调控的。研究发现,各种氧化性物质可以在数分钟至数小时内引起APE1蛋白水平的暂时上调,表明了APE1在细胞或机体出现氧化应激损伤时发挥重要作用[13]。也有研究表明,APE1蛋白水平的上调与氧化还原活性和AP核酸内切酶活性的增强相关,从而使细胞对氧化应激和DNA损伤物质的抵抗性增强[14]。
本研究结果表明,铅暴露诱导大鼠神经组织氧化应激时脑组织内的APE1蛋白表达水平下降。Yao等[15]研究发现结肠癌HT29细胞受到氧化应激损伤时APE1的蛋白水平下调,与本研究结果相同。可能是氧化应激损伤损害了与APE1蛋白表达途径的某个环节,也可能是铅直接起到抑制APE1蛋白合成的作用。本研究结果还显示,铅暴露大鼠脑组织中的SOD活力均低于对照组;H2O2、MDA高于对照组,提示铅可通过促进活性氧自由基的产生、抑制抗氧化酶系统和非酶系统、导致脂质过氧化损伤而致脑组织发生氧化应激损伤。
结合本次研究结果和国内外的研究发现,当机体处于氧化应激损伤时,APE1蛋白的表达水平可能早期能够在ROS的刺激下短暂上调,但是随着机体或细胞氧化损伤程度的不断加重,其蛋白表达水平最终也会下降,但是其中的具体机制仍需进一步的研究。
参考文献
[1] Verstraeten SV, Aimo L, Oteiza PI. Aluminium and lead: molecular mechanisms of brain toxicity[J]. Arch Toxicol,2008,82(11):789-802. doi: 10.1007/s00204-008-0345-3.
[2] Martinez-Haro M, Green AJ, Mateo R. Effects of lead exposure on oxidative stress biomarkers and plasma biochemistry in waterbirds in the field[J]. Environ Res,2011,111(4):530-538. doi: 10.1016/j. envres.2011.02.012.
[3] Flora SJ,Gautam P, Kushwaha P.Lead and ethanol co-exposure lead to blood oxidative stress and subsequent neuronal apoptosis in rats [J]. Alcohol Alcohol,2012,47(2):92- 101. doi: 10.1093/alcalc/ agr152.
[4] Ahamed M, Siddiqui MK. Low level lead exposure and oxidative stress: current opinions[J]. Clin Chim Acta,2007,383(1-2):57-64.
[5] Dizdaroglu M. Oxidative damage to DNA in mammalian chromatin [J]. Mutat Res,1992, 275(3-6): 331-342.
[6] Hazra TK, Das A, Das S, et al. Oxidative DNA damage repair in mammalian cells: a new perspective[J].DNA Repair (Amst), 2007,6 (4):470-480.
[7] Li MX, Wang D. Genetic structure and expression regulation of APE1/Ref-1[J]. Journal of Medical Molecular Biology, 2006, 3(5):350.
[8] Xiao YM, Xu QY, Zhang ZW, et al. Effects of lead exposure by drinking water on hydrogen peroxide, hydroxyl free radicals and lipid peroxi⁃dation in brain tissues of rats [J]. Tianjin Med J, 2015, 43(10): 1119-1121.[肖元梅,徐群英,张中伟,等.饮水铅暴露对大鼠脑组织过氧化氢、羟自由基和脂质过氧化的影响[J].天津医药, 2015, 43(10): 1119-1121]. doi:10.11958/j.issn.0253-9896.2015.10.009.
[9] Fortini P, Pascucci B, Parlanti E, et al. The base excision repair: mechanisms and its relevance for cancer susceptibility[J]. Biochim⁃ie, 2003, 85(11): 1053-1071.
[10] Izumi T, Brown DB, Naidu CV, et al. Two essential but distinct func⁃tions of the mammalian abasic endonuclease[J]. Proc Natl Acad Sci USA, 2005, 102(16): 5739-5743.
[11] Flaherty DM, Monick MM, Carter AB, et al. Oxidant-mediated in⁃creases in redox factor-1 nuclear protein and activator protein-1 DNA binding in asbestos- treated macrophages[J]. J Immunol, 2002, 168(11): 5675-5681.
[12] Kelley MR, Parsons SH. Redox regulation of the DNA repair func⁃tion of the human AP endonuclease Ape1/ref-1[J]. Antioxid Redox Signal,2001, 3(4): 671-683.
[13] Tell G, Damante G, Caldwell D, et al. The intracellular localization of APE1/Ref-1: more than a passive phenomenon[J]?Antioxid Re⁃dox Signa, 2005, 7(3-4): 367-384.
[14] Sung JS, Demple B. Roles of base excision repair subpathways in correcting oxidized abasic sites in DNA[J]. Febs J, 2006, 273(8): 1620-1629.
[15] Yao KS, Xanthoudakis S, Curran T, et al. Activation of AP-1 and of a nuclear redox factor, Ref-1, in the response of HT29 colon cancer cells to hypoxia[J]. Mol Cell Biol,1994, 14(9): 5997-6003.
(2015-09-10收稿2015-10-20修回)
(本文编辑闫娟)
作者单位:1南昌大学公共卫生学院(邮编330006);2九江学院临床医学院·附属医院;3南昌大学抚州医学院
Effects of lead exposure through drinking water on expression of APE1 protein and their relationships with oxidative stress in brain tissues of rats
REN Qingfeng1,2, LI Weijuan1,3, XU Qunying1, ZHANG Zhongwei1, LI Wei1, FENG Jiangao1, REN Xiaohui1, XIAO Yuanmei1∆
1 School of Public Health, Nanchang University, Nanchang 330006,China;2 Clinical Medical College, Jiujiang University;3 Fuzhou Medical College of Nanchang University
∆Corresponding Author E-mail: xym72@163.com
Abstract:Objective To observe the effects of lead exposure through drinking water on the expression of APE1 pro⁃tein in cerebral cortex, cerebellum and hippocampus of rats and its relationship with oxidative stress. Methods Forty weaned male SD rats were randomly assigned to five groups (control group and four exposure groups) according to body weights of rats. Rats in control group were given deionized water as drinking water. Rats in four exposure groups were given 100 mg/L, 200 mg/L, 400 mg/L and 800 mg/L lead acetate solution for 60 days. The activity of superoxide dismutase (SOD), the contents of hydrogen peroxide (H2O2) and malondialdehyde (MDA) in cortex, cerebellum and hippocampus were mea⁃sured using kits. The protein level of APE1 in cortex, cerebellum and hippocampus were detected by Western blotting assay. Results After being exposed to lead, the APE1 protein levels were significantly decreased in cortex, cerebellum and hippo⁃campus (P < 0.05). The protein level showed a trend of gradual decline with the increase of exposed lead (P < 0.05). With the increase of dye lead dose, the activity of SOD in cortex, cerebellum and hippocampus showed a downward trend, while the contents of H2O2and MDA showed a rising trend. The activity of SOD was positively correlated with APE1 protein level in cortex, cerebellum and hippocampus (r=0.619, 0.380 and 0.375,P < 0.05). While the contents of H2O2and MDA were neg⁃atively correlated with APE1 protein level in cortex, cerebellum and hippocampus (r=-0.472,-0.535,-0.436,-0.514,-0.486 and -0.316,P < 0.05). ConclusionLead exposure through drinking water can affect the expression of APE1 protein through inducing oxidative stress in brain tissues of rats.
Key words:lead; brain tissue; oxidative stress; APE1; superoxide dismutase;hydrogen peroxide;malonaldehyde
中图分类号:R994.4
文献标志码:A
DOI:10.11958/20150148
基金项目:国家自然科学基金资助项目(81160342);江西省自然科学基金资助项目(20122BAB205047);江西省教育厅科技项目(GJJ11312)
作者简介:任清风(1988),男,硕士研究生,主要从事重金属中毒机制与防治研究
