榄仁内生真菌JLR6的鉴定及其发酵条件优化
2016-05-30郭洪成吴亚腾王春龙柳志强
郭洪成 吴亚腾 王春龙 柳志强
摘 要 榄仁是热带及亚热带地区的一种常见药用植物,目前关于榄仁内生真菌的研究较少。从榄仁体内分离出一株内生真菌JLR6,利用对峙生长法测试JLR6对香蕉炭疽菌及芒果炭疽菌的拮抗活性,通过ITS序列分析对其进行初步鉴定,并利用Plackett-Burman设计结合响应面的方法对菌株JLR6的发酵条件进行了优化。 结果表明:菌株JLR6对香蕉炭疽菌及芒果炭疽菌有明显的拮抗活性,皿内抑制率分别为45.50%和57.90%,通过ITS序列分析,初步将JLR6鉴定为Diaporthe sp.;优化后菌株JLR6的最适发酵条件为细菌学蛋白胨10 g/L、葡萄糖20 g/L、酵母粉17.82 g/L、装液量87.59 mL、接种量9.06 %,于180 r/min、28℃条件下培养7 d,生物量达到4.79 g/L。
关键词 榄仁 ;内生真菌 ;Diaporthe sp. ;拮抗活性 ;发酵条件优化
分类号 Q939.95 Doi:10.12008/j.issn.1009-2196.2016.01.008
Abstract Terminalia catappa is a common medicinal plant in tropical and subtropical regions, and there is few study on its endophytic fungi so far. An endophytic fungi JLR6 was isolated from Terminalia catappa, and its antagonistic activity to Colletotrichum musae and Colletotrichum gloeosporioides were determined by confrontation growth method. The strain was identified by ITS sequence analysis, and the fermentation conditions were optimized by Plackett-Burman design and response surface methodology. The results showed strain JLR6 had obvious antagonistic activity to C. musae and C. gloeosporioides, and the inhibition rates were 45.50% and 57.90%, respectively. Strain JLR6 was identified as Diaporthe sp. according to ITS sequence. After optimization, the optimal fermentation conditions were 10 g/L peptone, 20 g/L glucose, 17.82 g/L yeast extract, 87.59 mL of loading volume and 9.06% of inoculum size. After 7 d culture on 28℃, 180 r/min, the biomass was up to 4.79 g/L.
Keywords Terminalia catappa ; endophytic fungi ; Diaporthe sp. ; antagonistic activity ; optimization of fermentation condition
榄仁树(Terminalia catappa)别名枇杷树、法国枇杷,为使君子科(Combretaceae)榄仁树属落叶乔木,高15 m或更高,5~6月开花,9月果实成熟,原产于马达加斯加、印度东部和安达曼群岛及马来半岛,在中国海南、广东、广西、台湾、福建等地均有分布[1]。
植物内生菌(endophyte)指那些在其生活史中的某一段时期或全部阶段生活于健康植物各组织和器官内部,不引起被感染的宿主植物组织症状明显改变的菌类,包括那些在其生活史中的某一阶段表面生的腐生菌、对宿主暂时没有伤害的潜伏病原菌和菌根菌[2]。内生菌在植物体内能产生多种生物学作用,如提供植物所需要的营养物质,参与植物的防卫功能,促进植物快速生长,增强植物抗逆、抗病、抗虫的能力[3]。因此,内生菌对植物病害的生防作用及其开发利用引起了广泛关注。目前有关榄仁内生菌的研究较少,本研究从榄仁体内分离出一株内生真菌JLR6, 发现其对香蕉炭疽菌及芒果炭疽菌具有较好的拮抗效果,利用ITS 序列分析对该菌株进行了初步鉴定,并通过响应面法对其发酵条件进行了优化,为今后的应用奠定一定基础。
1 材料与方法
1.1 材料
1.1.1 供试材料
榄仁茎采自海南大学儋州校区,内生真菌JLR6从榄仁茎中经组织表面消毒分离获得。香蕉炭疽菌(Colletotrichum musae)和芒果炭疽菌(C. gloeosporioides Penz)由海南大学环境与植物保护学院提供。
1.1.2 培养基
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL。
CM培养基:蛋白胨5 g,酵母粉5 g,葡萄糖10 g,蒸馏水1 000 mL。
1.2 方法
1.2.1 菌株JLR6皿内拮抗活性测定
在直径为9 cm的PDA平板中央分别接种一块直径为5 mm的香蕉炭疽菌、芒果炭疽菌的菌饼,菌丝面朝下,同时在菌饼一侧接种一块JLR6菌饼,以不接内生真菌JLR6的平板为对照,每处理3次重复,于28℃培养7 d,测试菌株JLR6的皿内拮抗活性。
抑菌活性/%=(对照组病原菌生长距离-试验组病原菌生长距离)/对照组病原菌生长距离×100
1.2.2 ITS序列分析
菌株JLR6基因组的提取采用CTAB法。利用ITS通用引物(ITS1:5′-TCCGTAGGTGAACCTGCGG-3′,ITS4:5′-TCCTCCGCTTATTGATATGC-3′)进行基因扩增,由上海英骏生物技术有限公司进行序列测定,将测序结果在GenBank中进行Blast分析。
1.2.3 菌株JLR6的发酵条件优化
采用摇瓶试验进行发酵条件优化,将菌株JLR6接种于CM培养基中,于28℃、180 r/min条件下振荡培养3 d,将种子培养液转接入发酵培养基中,按照如下方案进行发酵条件优化。Plackett-Burman设计:选用11因素、试验次数为12的Plackett-Burman设计,对5个因素进行2水平设计(表1),以生物量为响应值,利用Design-Expert 8.0进行显著性分析。
对于Plackett-Burman设计选择的3个显著因子A、B、C(酵母粉、装液量和接种量),根据中心组合设计(Central Composite Design,CCD)原理,从5个水平(-α,-1,0,+1,α)进行考查(表2),以生物量为响应值,确定其最优条件。
生物量计算采用干重法,将菌株发酵液过滤,收集菌丝体,用去离子水洗涤3次,置于真空干燥箱烘至恒重,称量并计算生物量。
2 结果与分析
2.1 菌株JLR6的皿内拮抗活性
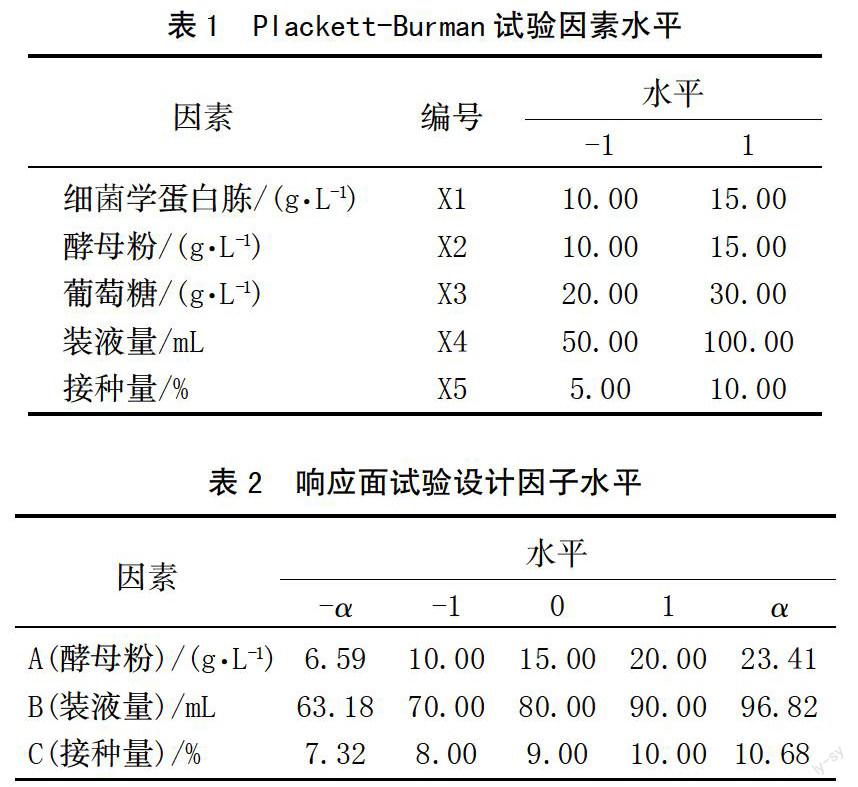
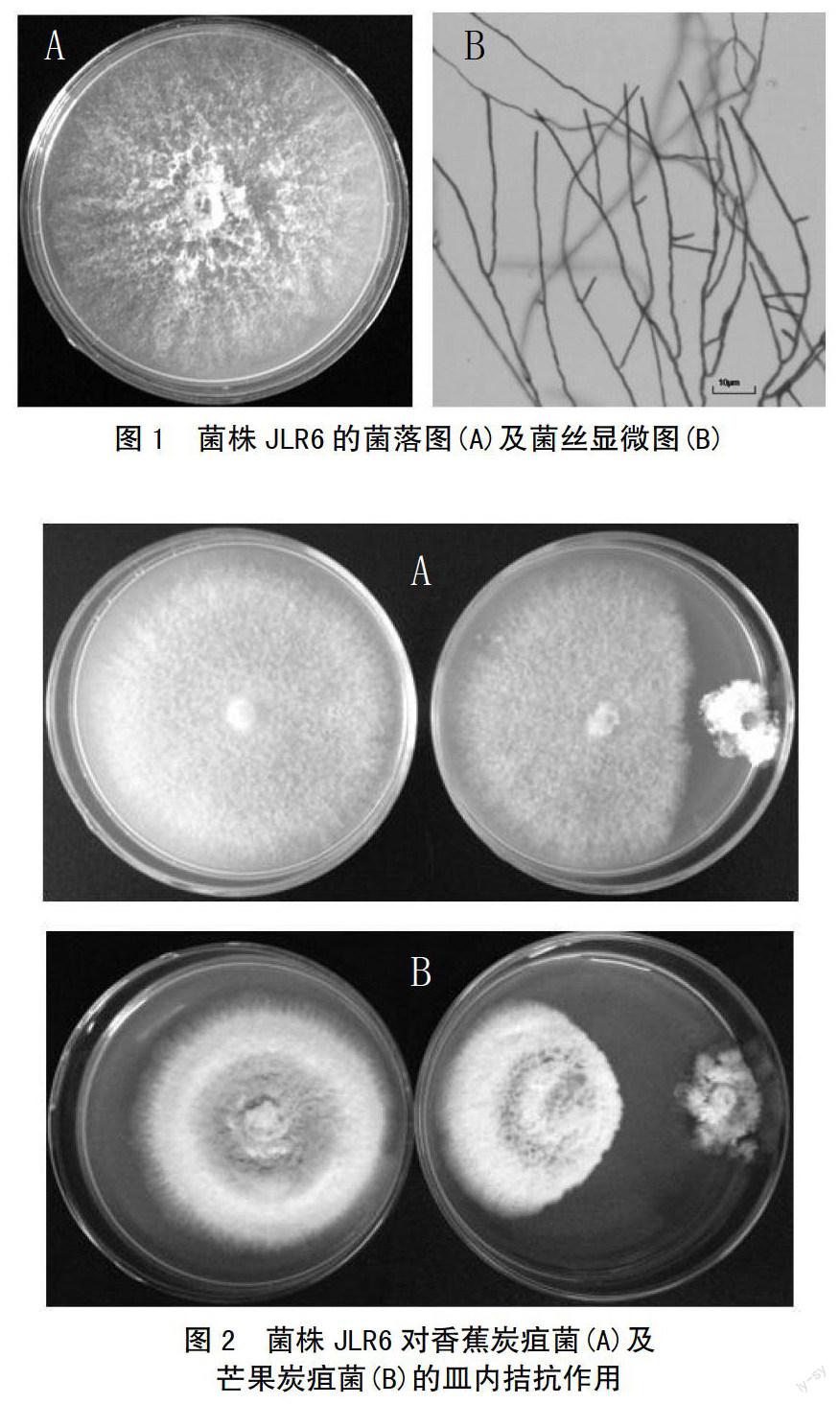
菌株JLR6在PDA平板上的菌落呈絮状或绒毛状,乳白色或灰黑色,菌落边缘不规则(图1)。利用对峙生长法测试了菌株JLR6对香蕉炭疽菌及芒果炭疽菌的拮抗活性,结果见图2。可以看出,菌株JLR6对2种病原菌均具有明显的拮抗作用,能够有效抑制病原菌菌丝在PDA 培养基中的扩展。经测定,菌株JLR6对香蕉炭疽菌及芒果炭疽菌的皿内抑制率分别为45.50%和57.90%。
2.2 ITS序列分析
对菌株JLR6的ITS序列进行PCR 扩增,产物经纯化后测序,得到605 bp 的碱基序列。将ITS序列进行Blast分析,发现其与Diaporthe属中多个菌株(Genbank登录号分别为JQ514150,JN153055,EF423532,GQ352484)的同源性达到99%,因此初步将JLR6鉴定为Diaporthe sp.。
2.3 JLR6发酵条件的优化
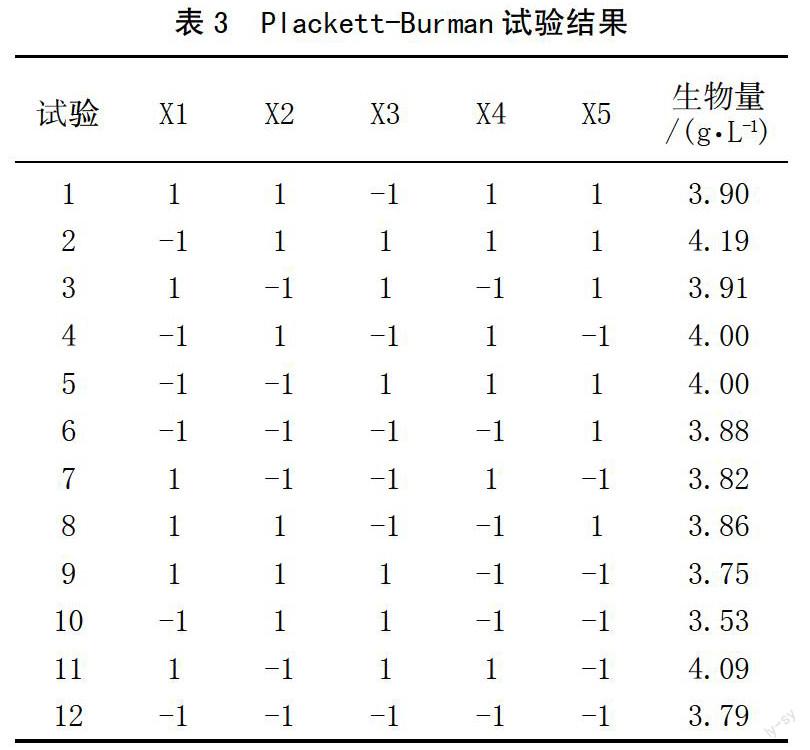
为获得菌株JLR6的最适发酵条件,首先通过Plackett-Burman试验考察细菌学蛋白胨、酵母粉、葡萄糖、接种量、装液量5个因素对菌体干重的影响,结果见表3,各因素效应结果见表4。表4中p值表示各因子对菌体发酵影响的显著性,若p值小于0.05,说明该因素对JLR6发酵过程的影响显著。
从表4可以得出,酵母粉、葡萄糖、装液量和接种量4个因子的影响是显著的;F值表征因子对JLR6生物量的影响程度,F值越大,表明该因子对生物量的影响程度越大。在JLR6发酵过程中,装液量对其生物量的影响最大,其次是接种量和酵母粉,葡萄糖影响相对较小,而细菌学蛋白胨对生物量的影响不显著。经过Plackett-Burman试验,将酵母粉、装液量和接种量3个显著因子做进一步优化,以确定最适水平。
针对Plackett-Burman试验确定的3个显著因子(酵母粉、装液量和接种量)进行响应面分析,试验设计及结果见表5,方差分析结果见表6。借助Design expert 8.0软件对试验数据进行二次多元回归拟合,得到二次回归方程为:
Y=4.49+0.5A+0.13B+0.11C-0.041AB+0.016AC+0.071BC-0.28A2-0.13B2-0.17C2
其中,Y表示JLR6生物量。从表6可以看出,该模型的p值<0.01,R2=97.6%,说明该模型能够较好地模拟JLR6的发酵过程。
依据回归方程做响应面图,结果见图3、4。图3表示接种量为9.06%时,酵母粉浓度和装液量对JLR6生物量的交互影响,可以看出酵母粉浓度和装液量分别在16~20 g/L和80~90 mL时,生物量较大。图4表示酵母粉浓度为17.82 g/L时,装液量和接种量对JLR6生物量的交互影响,当装液量和接种量分别在80~90 mL和9%~10%时,菌株JLR6生物量较大。通过软件进一步分析计算,得到预测最大生物量为4.678 g/L,此时酵母粉浓度为17.82 g/L,装液量为87.59 mL,接种量为9.06%。
为了验证模型的准确性和有效性,按照优化后的最适发酵条件(细菌学蛋白胨10 g/L,葡萄糖20 g/L,酵母粉17.82 g/L,装液量87.59 mL,接种量9.06%),于180 r/min、28℃条件下培养7 d,测得生物量为4.79 g/L,与预测值4.69 g/L相接近,说明试验设计与响应面分析方法能够较好地模拟JLR6的发酵过程,结果可靠。
4 讨论与结论
榄仁是热带及亚热带地区的一种常见药用植物,民间常用于防治肝炎、肝腹水、肝癌等各种肝病,功效显著[4]。目前关于榄仁的研究多集中于其药用活性及药理机制方面,如一些研究者发现,榄仁叶提取物对急慢性肝损伤具有一定的防护作用, 其机理可能与其对抗脂质过氧化、保护线粒体及肝细胞有关[4-5]。但目前关于榄仁内生真菌的研究报道很少,本研究从榄仁体内分离出一株内生真菌JLR6,发现其对香蕉炭疽菌及芒果炭疽菌均有较好的拮抗活性,其皿内拮抗活性分别为45.50%和57.90%,通过ITS序列分析初步将其鉴定为Diaporthe sp.。
近年来,国内外已筛选到多株可用于香蕉炭疽病的生防菌株,涉及细菌、放线菌、酵母、丝状真菌等,例如Streptomyces aureofaciens[6]、Trichoderma harzianum[7]、Pichia anomala[8]、Candida oleophila[8]、Pseudomonas syringae[9]、Burkholderia spinosa[10]、Bacillus amyloliquefaciens[11]、Pantoea agglomerans[12]、Bacillus subtilis[13]和Pseudomonas fluorescens[14]等;在芒果炭疽病生防菌的筛选方面也取得了不少进展,研究发现Bacillus subtilis[15]、Bacillus amyloliquefaciens[16]、绿色木霉菌[17]、季也蒙毕赤酵母[18]、Meyerozyma caribbica[19]和Cryptococcus laurentii[20]等对芒果炭疽病具有较好的防治效果。然而,目前还未见有关Diaporthe sp.用于香蕉炭疽菌及芒果炭疽菌防治的报道。
传统的发酵条件优化方法如单因素优化法,存在数据利用率不高、试验次数多及试验结果不准确等问题[21]。Plackett-Burman设计是一种2水平的试验设计方法,它可以利用较少的实验次数,从众多的考察因素中快速有效地筛选出主要的影响因子,被广泛应用于因子主效应的估计[22]。响应面法是一种优化生物过程的综合技术,采用该法可以建立连续变量曲面模型,对影响生物产量的因子水平及其交互作用进行优化与评价[23],响应面法已经被成功应用于许多发酵过程的优化当中[24-26]。本研究利用Plackett-Burman设计对JLR6的发酵条件进行了筛选,获得了3个主要的显著因子,即酵母粉浓度、装液量和接种量。利用响应面法对3个显著因子进行优化,建立了二次多项方程模型,获得了最适的发酵条件,在验证试验中得到的实测值与预测值接近,模拟结果较好。
参考文献
[1] 韦晓娟. 优良园林绿化树种——榄仁[J]. 广西林业科学,2001,30(3):150-151.
[2] Stone J K, Bacon C W, White J F. An overview of endophytic microbes: endophytism defined[M]//Microbial Endophytes. Boca Raton,Florida: CRC Press, 2000: 3-29.
[3] Sturz A V, Christie B R, Norwak J. Bacterial endophytes: Potential role in developing sustainable systems of crop production[J]. Critical Reviews in Plant Sciences, 2000, 19(1): 1-30.
[4] 汤新慧,高 静,窦 环,等. 榄仁叶提取物对D-GalN诱导的小鼠急性肝损伤的防护作用[J]. 中国中药杂志,2004(11):47-51.
[5] 徐力致,高 静,朱 俐,等. 榄仁树叶提取物(LR-98)对实验性肝损伤的防护作用[J]. 南京大学学报(自然科学),2000,36(2):197-201.
[6] Taechowisan T, Lu C, Shen Y, et al. Secondary metabolites from endophytic Streptomyces aureofaciens CMUAc130 and their antifungal activity [J]. Microbiology, 2005, 151(5): 1 691-1 695.
[7] Alvindia D G, Natsuaki K T. Evaluation of fungal epiphytes isolated from banana fruit surfaces for biocontrol of banana crown rot disease [J]. Crop Protection , 2008, 27(8): 1 200-1 207.
[8] Lassois L, de Lapeyre de Bellaire L, Jijakli M H. Biological control of crown rot of bananas with Pichia anomala strain K and Candida oleophila strain O[J]. Biological Control, 2008, 45(3): 410-418.
[9] Williamsona S M, Guzmánb M, Marinc D H, et al. Evaluation of Pseudomonas syringae strain ESC-11 for biocontrol of crown rot and anthracnose of banana [J]. Biological Control, 2008, 46(3): 279-286.
[10] De Costa D M, Zahra A R F, Kalpage M D, et al. Effectiveness and molecular characterization of Burkholderia spinosa, a prospective biocontrol agent for controlling postharvest diseases of banana [J]. Biological Control , 2008, 47: 257-267.
[11] Alvindia D G, Natsuaki K T. Biocontrol activities of Bacillus amyloliquefaciens DGA14 isolated from banana fruit surface against banana crown rot-causing pathogens[J]. Crop Protection, 2009, 28(3): 236-242.
[12] Niroshini Gunasinghe W K R, Karunaratne A M. Interactions of Colletotrichum musae and Lasiodiplodia theobromae and their biocontrol by Pantoea agglomerans and Flavobacterium sp. in expression of crown rot of “Embul” banana [J]. Biological Control, 2009, 54(4): 587-596.
[13] Fu G, Huang S L, Ye Y F, et al. Characterization of a bacterial biocontrol strain B106 and its efficacy in controlling banana leaf spot and post-harvest anthracnose diseases [J]. Biological Control, 2010, 55(1): 1-10.
[14] Peeran MF, Nagendran K, Gandhi K, et al. Water in oil based PGPR formulation of Pseudomonas fluorescens (FP7) showed enhanced resistance against Colletotrichum musae [J]. Crop Protection, 2014, 65: 186-193.
[15] 张鲁斌,常金梅,詹儒林. 芒果炭疽病拮抗菌的筛选及防治效果研究[J]. 热带农业科学,2010,30(5):12-14.
[16] 汪 远,詹儒林,何 红,等. 红树内生细菌菌株Kc-38的抗菌物质及对采后芒果炭疽病的防效[J]. 中国生物防治学报,2011,27(1):82-87.
[17] 冯卫华,伦家欣,蒋 雨,等. 绿色木霉菌抑制芒果炭疽菌特性研究[J]. 中国食品学报,2012,12(1):99-104.
[18] 许春青. 芒果炭疽病菌拮抗酵母的筛选、鉴定及其保护剂的评价[D]. 武汉:华中农业大学,2013.
[19] Bautista-Rosales P U, Calderon-Santoyo M, Servín-Villegas R, et al. Action mechanisms of the yeast Meyerozyma caribbica for the control of the phytopathogen Colletotrichum gloeosporioides in mangoes[J]. Biological Control, 2013, 65(3): 293-301.
[20] Bautista-Rosales P U, Calderon-Santoyo M, Servín-Villegas R, et al. Biocontrol action mechanisms of Cryptococcus laurentii on Colletotrichum gloeosporioides of mango [J]. Crop Protection, 2014, 65: 194-201.
[21] 柳志强,李晓宇. 响应面法优化海洋细菌Bacillus sp.YP07淀粉酶发酵条件研究[J]. 中国酿造,2011(2):64-66.
[22] Ahuja S K, Ferreira G M, Moreira A R. Application of Plackett-Burman design and response surface methodology to achieve exponential growth for aggregated shipworm bacterium[J]. Biotechnology and Bioengineering, 2004, 85(6): 666-675.
[23] Kalil S J, Maugeri F, Rodrigues M I. Response surface analysis and simulation as a tool for bioprocess design and optimization[J]. Process Biochemistry, 2000, 35(6): 539-550.
[24] 阎金勇,杨江科,闫云君. 单因素-响应面法优化白地霉Y162产脂肪酶条件[J]. 中国生物工程杂志,2007,27(8):69-75.
[25] 黄光建,徐学锋,郭梅君,等. D-最优混料设计在豉香型白酒香醅优化中的应用[J]. 华南农业大学学报, 2013,34(3):427-430,435.
[26] 黎扣扣,张春苗,顾海东,等. 灵芝S3发酵培养基的优化及其对镰刀菌的抑制[J]. 菌物学报,2014,33(2):401-410.
