高温胁迫下瓜实蝇的内参基因筛选
2016-05-30周世豪李磊符悦冠
周世豪 李磊 符悦冠

摘 要 基于实时荧光定量PCR技术,测定瓜实蝇雌成虫GAPDH、SD、β-TUB、ACT和RPL13共5个备选内参基因分别在25(CK)、37、45 ℃下处理1 h的mRNA水平表达情况,并借助Bestkeeper、Normfinder和GeNorm程序分析5个备选内参基因表达的穩定性。筛选得出BestKeeper:SD值排序为SD(0.06)=GAPDH(0.06)关键词 高温胁迫;瓜实蝇;内参基因
中图分类号 Q963 文献标识码 A
Abstract To select suitable reference genes in the adult female Bactrocera cucurbitae after the treatment of different high temperature stress, We determined the female adult of B. cucurbitae the mRNA expression stability of five candidate reference genes(GAPDH, SD, β-TUB, ACT and RPL13)after the treatment of temperature stress(1 h)at 25 ℃(CK), 37 ℃ and 45 ℃ by RT-qPCR method. Then three software-based approaches(Bestkeeper, Normfinder and GeNorm)were used to evaluate the expression stability of the five candidate reference genes. The SD values of the five reference genes stability by BestKeeper method in the ascending order were SD(0.06)=GAPDH(0.06)
BestKeeper程序通过取候选内参基因Ct值的几何平均数,依据其大小,对候选基因配对差异分析后进行排序[12]。NormFinder和GeNorm将各候选基因的Ct值采取线性方程进行转化,使其最高相对表达量赋予数值1,NormFinder是直接計算算出各候选基因的表达稳定值,稳定值越小对应基因越稳定[13]。GeNorm则是先计算各候选内参基因的整体情况,而不是对单一内参基因进行评价,这样更有利于减小误差,最终给出一个稳定值,该值越小越稳定[13]。Bestkeeper、Normfinder和GeNorm 3种程序各有利弊,应结合一起对内参基因进行综合评价。
本文基于前期转录组测序的基础上,利用RT-qPCR以及Bestkeeper、Normfinder和GeNorm 3种程序分析GAPDH、SD、β-TUB、ACT和RPL13共5个备选内参基因分别在25、37、45 ℃下处理1 h的mRNA水平表达稳定性,以便筛选出瓜实蝇雌成虫在高温胁迫下表达稳定的合适内参基因。
1 材料与方法
1.1 材料
1.1.1 供试虫和养虫管理 实验所用虫源采自海南省澄迈县苦瓜地,继而在本实验室内采用人工饲料进行扩繁,幼虫饲料配方为:酵母粉100 g;玉米粉500 g;苯甲酸钠2 g;蔗糖100 g;南瓜500 g;浓盐酸4 mL;水500 mL。成虫饲料为:酵母粉:蔗糖(w ∶ w)=1 ∶ 1。建立稳定实验室种群。室内平均温度(25±1)℃,RH为(70±5)%,14L ∶ 10D。本研究中所用的实验昆虫均为初羽化的瓜实蝇雌成虫。将所有供试虫分别放入已设置好温度的不同光照培养箱中,于25(CK,最适温度)、37、45 ℃下处理1 h,处理完后迅速放入液氮中速冻,置于-80 ℃下备用,各个温度处理均设3个重复。
1.1.2 主要试剂和仪器 Allprep组织/细胞RNA/DNA分提试剂盒(北京艾德莱生物科技有限公司,RN29);第一链cDNA合成试剂盒(上海生工生物工程有限公司,B532445-0020);Marker(上海生工生物工程有限公司,B300721-0125);TransStart Green qPCR SuperMix(北京全式金生物科技有限公司,AQ101-02);全自动荧光定量PCR反应扩增仪(美国ABI公司,7500);普通PCR仪(Bio-Rad T100)。
1.2 方法
1.2.1 总RNA的提取和第一链cDNA合成 按照Allprep试剂盒操作说明提取各温度条件下瓜实蝇雌成虫总RNA,继而用1.5%琼脂糖凝胶电泳检测总RNA的完整性。按照第一链cDNA合成试剂盒操作说明反转录合成第一链cDNA,保存在-20 ℃备用。
1.2.2 引物设计 根据前期转录组测序结果,筛选出GAPDH、SD、β-TUB、ACT和RPL13共5个备选内参基因相关序列,使用在线引物设计软件NCBI Primer-BLAST(http://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计引物。各引物序列见表1,由上海生工生物工程有限公司合成。
1.2.3 PCR分析 根据表1中各引物分别对5个候选内参基因进行PCR分析,以验证所设引物的可行性。PCR反应体系为20 μL:1 μL cDNA,10 μL 2×power Taq Master Mix,正、反向引物各0.4 μL,ddH2O补足体积至20 μL。扩增程序:95 ℃ 2 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,34个循环;72 ℃ 5 min。PCR反应完成后用1.5%琼脂糖凝胶电泳检测各个反应产物。
1.2.4 RT-qPCR分析 RT-qPCR反应体系为20 μL:10 μL TransStart Green qPCR SuperMix,2 μL cDNA,正、反向引物各1 μL,ddH2O补足体积至20 μL。扩增程序:95 ℃ 3 min;95 ℃ 7 s,57 ℃ 10 s,75 ℃ 15 s, 40个循环。扩增程序结束后,进行融解曲线分析,从72 ℃到95 ℃ 15 s,之后降至60 ℃ 1 min,然后温度逐渐上升至95 ℃,期间升温速度5 ℃/s,最后95 ℃再持续10 s。
1.3 数据分析
将RT-qPCR分析所得到的不同温度处理下每个候选内参基因的Ct值,按照要求输入至Bestkeeper、Normfinder和GeNorm 3种分析程序中。Bestkeeper分析程序,通过对输入不同候选内参基因的Ct值,对样品进行相关性配对分析,并算出标准差(SD)。以SD<1作为评判候选内参基因稳定性界限,SD 值越小,其对应的内参基因越稳定。Normfinder分析程序,采用同处理组内方差与不同处理间方差相结合方法,计算出稳定值,该值越小,其对应的内参基因越稳定。GeNorm分析程序,通过逐步删掉最不稳定的候选内参基因,每步均计算每个基因的M值,M值越小,内参基因越稳定,直至保留最佳内参基因为止。
2 结果与分析
2.1 提取总RNA质量检测
按照Allprep试剂盒操作说明,提取25、37和45 ℃下处理1 h后瓜实蝇雌成虫总RNA,继而用1.5%琼脂糖凝胶电泳检测总RNA完整性,结果见图1。由图1显示,3种不同温度处理提取总RNA 都含有明显的28S、18S和5S三条带,18S条带最明显,点样孔和泳道无明显杂质残留,说明提取总RNA完整性较好,无蛋白和DNA污染,可用于后续实验。
2.2 PCR分析结果
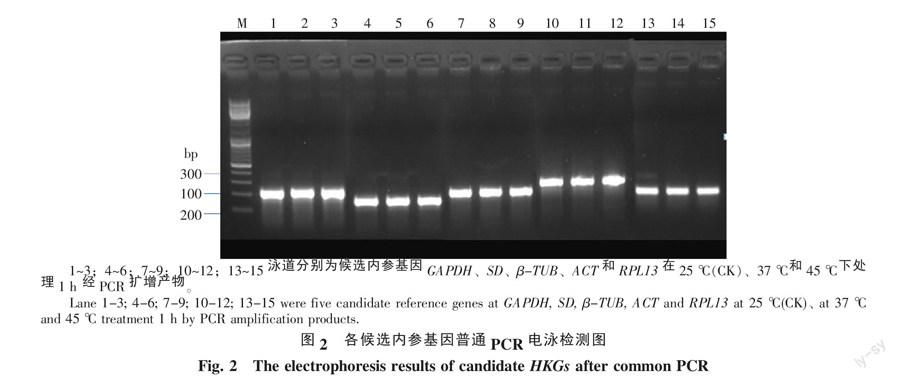
各候选内参基因PCR产物电泳检测结果见图2。从图2可见,各候选内参基因均检测到预期大小的PCR产物,各条带单一清晰,无其它非特异性扩增产物,说明各候选内参基因引物设计合理,可以进行后续实验。
2.3 RT-qPCR分析结果
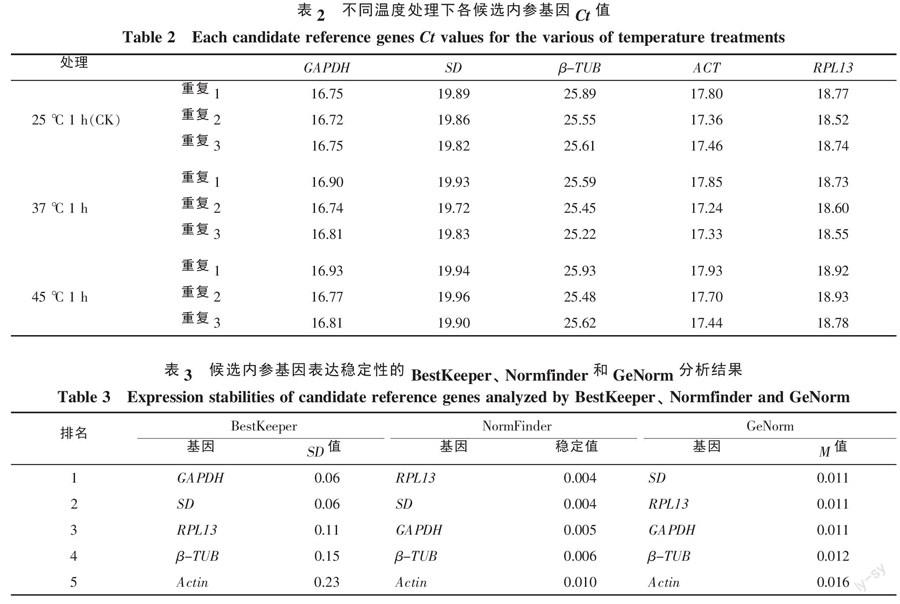
对5个候选内参基因进行RT-qPCR分析,结果表明,各实验处理熔解曲线均只产生单一的熔解峰,不存在引物二聚体等非特异扩增产物。不同温度处理下各候选内参基因的Ct值在16~26之间(表2),其中β-TUB表达量最高,其Ct值在25.2~25.9之间,GAPDH表达量最低,其Ct值在16.7~16.9之间。
将上述所得各候选内参基因Ct值,按照要求代入BestKeeper、Normfinder和GeNorm内参基因分析程序,结果见表3。
BestKeeper分析程序显示,各候选内参基因SD值均小于1,均在稳定界限内,SD值排序为:SD(0.06)=GAPDH(0.06)3 讨论与结论
本文选定的5个瓜实蝇雌成虫候选内参基因GAPDH、SD、β-TUB、ACT和RPL13,经RT- qPCR方法分析后表明,在不同温度条件下各个基因的Ct值并不相同,对在不同的实验条件下,内参基因表达稳定性筛选极其重要。采用BestKeeper、Normfinder和GeNorm 3种不同分析程序对5个候选内参基因的稳定性进行评价,可以看出,不同的分析程序对内参基因的稳定性排序也有差异,这是因为不同的分析程序算法不同导致[14],因此,应结合不同的分析程序,对内参基因表达稳定性进行评价。
在不同的实验条件下,基因的表达存在差异,从而导致蛋白层面的差异,因此,在不同实验条件下,选择合适的内参基因,mRNA水平上的定量分析对了解目标基因功能,解释相关生物学现象极其重要[15]。申建梅等[16]在23~26 ℃的条件下,以ACT为内参基因,对瓜实蝇嗅觉受体基因在各个发育时期的表达水平不同进行了研究,而在本文高温的条件中,ACT基因的表达稳定性评估并不是最佳。在与瓜实蝇同为双翅目的近缘种桔小實蝇(Bactrocera dorsalis)内参基因的筛选中,对高效氯氰菊酯对桔小实蝇看家基因稳定性的影响研究[17],筛选出RPL13比SD的表达稳定性高,而本文结果与之相反,这些研究结果与本文结果异同是因为研究种类和不同的实验条件所致。
瓜实蝇雌成虫是多寄主、耐热型害虫,高温对其生命活动有极其重要的影响[18]。在高温胁迫下,昆虫表现出相应的生态、行为、生理生化等变化,如存活率下降,羽化率降低,发育历期延长、酶活性不同、DNA和蛋白质差异表达等[19]。本文在前期对瓜实蝇雌成虫在25(CK)、37和45 ℃条件下处理1 h进行转录组测序,了解相关的候选内参基因序列的基础上,采用RT-qPCR方法对5个备选内参基因进行验证及评价其稳定性,为进一步利用转录组测序结果,筛选出目的基因,了解目的基因在虫体高温条件下的表达状况,进而利用RNA干扰技术在特定时间对目的基因进行沉默表达,达到高温条件下防治瓜实蝇的目的,与传统单从基因的角度分析相比[16],增加针对性和目的性。本文结果还可为结合瓜实蝇在高温条件下其它方面的生命活动现象,共同阐明瓜实蝇在高温条件下的响应机制,有助于提高瓜实蝇种群高温条件下预测的准确性,为瓜实蝇的高温防治效果奠定基础。
参考文献
[1] Ransbotyn V, Reusch T B H. Housekeeping gene selection for quantitative real-time PCR assays in the seagrass Zostera marina subjected to heat stress. Limnology and Oceanography[J]: Methods, 2006, 4: 367-373.
[2] Yoo W G, ImKim T, Li S, et al. Reference genes for quantitative analysis on Clonorchis sinensis gene expression by real-time PCR[J]. Parasitology Research, 2009, 104(2): 321-328.
[3] Andersen C L, Jensen J L, rntoft T F. Normalization of real-time quantitative reverse transcription-PCR data: a model-based variance estimation approach to identify genes suited for normalization, applied to bladder and colon cancer data sets[J].Cancer Research, 2004, 64(15): 5 245-5 250.
[4] Scharlaken B, de Graaf D C, Goossens K, et al. reference gene selection for insect expression studies using quantitative real-time PCR: the head of the honeybee, Apis mellifera, after a bacterial challenge[J]. Journal of Insect Science, 2008, 8(33): 1-10.
[5] Matta B P, Bitner-Mathe B C, Alves-Ferreira M. Getting real with real-time qPCR: a case study of reference gene selection for morphological variation in Drosophila melanogaster wings[J]. Development Genes and Evolution, 2011, 221(1): 49-57.
[6] 岳秀利, 高新菊, 王进军, 等. 二斑叶螨内参基因的筛选及解毒酶基因的表达水平[J]. 中国农业科学, 2013, 46(21): 4 542-4 549.
[7] 李人柯. 瓜实蝇的为害与防治[J]. 中国蔬菜, 1997(3): 26-27.
[8] Dhillon M K, Singh R, Naresh J S, et al. The melon fruit fly, Bactrocera cucurbitae: A review of its biology and management[J]. Journal of Insect Science, 2005, 5(40): 1-16.
[9] 江昌木, 艾洪木, 赵士熙. 不同寄主营养条件下的瓜实蝇实验种群生命表[J]. 福建农林大学学报: 自然科学版, 2006, 31(1): 24-28.
[10] Weems H V, Heppner J B. Melon fly Bactrocera cucurbitae Coquillett(Insecta: Diptera: Tephritidae)[M]. Florida Department of Agriculture and Consumer Services, 2001: 199.
[11] 韋淑丹, 黄树生, 王玉群, 等. 温度对瓜实蝇实验种群生长发育及生殖的影响研究[J]. 南方农业学报, 2011, 42(7): 744-747.
[12] Pfaff M W, Tichopad A, Prgomet C, et al. Determination of stable housekeeping genes, differentially regulated target genes and sample integrity: BestKeeper~Excel-based tool using pairwise correlations[J]. Biotechnology Letters, 2004, 26: 509-515.
[13] Andersen CL, Ledet-Jensen J, 0mtoft T. Normalization of real-time quantitative RT-PCR data, a model-based variance estimation approach to identify genes suited for normalization, applied to bladder and colon cancer data sets[J]. Cancer Res, 2004, 64: 5 245-5 250.
[14] 符 伟, 谢 文, 张 卓, 等. Bt毒素诱导下小菜蛾实时定量PCR内参基因的筛选[J]. 昆虫学报, 2012, 55(12): 1 406-1 412.
[15] Bustin S A. Real-time, fluorescence-based quantitative PCR: a snapshot of current procedures and preferences[J]. Expert Rev Mol Diagn, 2005, 5(4): 493-498.
[16] 申建梅, 胡黎明, 宾淑英, 等. 瓜实蝇嗅觉受体基因的克隆及表达谱分析[J]. 昆虫学报, 2011, 54(3): 265-271.
[17] 申光茂. 桔小实蝇消化和解毒代谢相关基因鉴定及其对药剂胁迫的应激反应[D]. 西南大学, 2013.
[18] 江昌木. 瓜实蝇种群系统与检疫防除综合技术[D]. 福州: 福建农林大学, 2006.
[19] 杜 尧, 马春森, 赵清华, 等. 高温对昆虫影响的生理生化作用机理研究进展[J]. 生态学报, 2007, 27(4): 1 555-1 572.
责任编辑:赵军明
