香蕉枯萎病菌假定G蛋白偶联受体基因Fogpr1的功能分析
2016-05-30郭立佳梁昌聪刘磊汪军杨腊英王国芬黄俊生
郭立佳 梁昌聪 刘磊 汪军 杨腊英 王国芬 黄俊生

摘 要 为了研究尖孢镰刀菌古巴专化型假定G蛋白偶联受体基因fogpr1的功能,构建了fogpr1基因敲除突变体。与野生型相比,fogpr1基因敲除突变体在菌丝生长、产孢量和菌落形态等方面没有明显变化,对巴西蕉的致病性也没有降低。此外,酵母双杂交实验结果表明,Fogpr1可以与G蛋白Fga1、Fga2 和Fgb1互作。这些结果表明Fogpr1可能是一个G蛋白偶联受体,但不参与调控尖孢镰刀菌的发育和致病性。
关键词 尖孢镰刀菌古巴专化型;G蛋白;致病性;生长;发育
中图分类号 S432.4 文献标识码 A
Abstract To investigate the functions of the G-protein coupled receptor gene fogpr1 in the pathogenic fungus Fusarium oxysporum f. sp. cubense(Foc), the fogpr1 deletion mutants were constructed. The fogpr1-deletion mutants showed no apparent alterations in mycelium growth, conidiation and colonial morphology as compared to the wild type. The virulence against banana plants(Musa spp. cv. Brazil)was not reduced. Additionally, the protein Fogpr1 could interact with the G-protein Fga1, Fga2 and Fgb1 in yeast two-hybrid system. The results indicate that Fogpr1 might be a G-protein coupled receptor, whereas play no roles in development and pathogenicity of Foc. The results lay a foundation for studying the roles of G-protein coupled receptors in Foc.
Key words Fusarium oxysporum f. sp. cubense; G-protein coupled receptor; Pathogenicity; Growth; Development
doi 10.3969/j.issn.1000-2561.2016.01.021
尖孢镰刀菌(Fusarium oxysporum)是一种无性真菌,广泛存在于各種环境中,其在土壤中可以长久存活,故也是一种土壤习居菌。其中一些尖孢镰刀菌是重要的植物病原菌,引起许多作物包括棉花、番茄、西瓜、甘蓝、香蕉等根腐病或枯萎病。因此,尖孢镰刀菌病原菌是许多农作物生产的一种重要限制因子[1-2]。当前重要作物枯萎病的防治主要依靠使用抗性品种,包括使用抗性砧木。抗病育种是该类病害防治的重要研究方向。
尖孢镰刀菌古巴专化型(F. oxysporum f. sp. cubense)是引起香蕉枯萎病的病原菌。该病原菌引起的香蕉枯萎病十分难以防治,目前尚无十分有效的方法,使用抗病品种是今后防治该病害的主要措施之一。对其致病机理的深入理解将有助于香蕉抗枯萎病育种。近年来,在尖孢镰刀菌古巴专化型致病机理研究方面取得了一些进展。笔者所在的科研团队破译了尖孢镰刀菌古巴专化型1号和4号小种基因组序列[3]。国内外一些学者鉴定了一些致病基因包括fgb1[4]、FoOCH1[5]、Focr4-1562[6]、Foatf1[7]等。然而,这些研究结果相对于复杂的病原菌致病机理来说,仍然十分有限,仍需更深入研究。尤其是尖孢镰刀菌如何感知环境和宿主,在很大程度上仍是未知。
研究发现,在一些真核生物中,G蛋白偶联受体(GPCR)是一类包含7个跨膜结构域的蛋白,主要负责传递胞外信号到胞内并触发一些信号传导级联。G蛋白偶联受体在各种信号如光、质子、钙离子、气味、氨基酸、核苷酸、蛋白、多肽、激素类和脂肪酸等刺激下,会发生构象变化,导致与其结合的G蛋白复合物解离为α亚基和βγ二聚体,继而激活下游信号通路,引起生理和代谢的变化[8]。在一些模式真菌中,一些G蛋白偶联受体已有研究报道。在芽殖酵母(Saccharomyces cerevisiae)中,STE3和STE2参与有性结合,Gpr1参与营养感知,调控假菌丝的分化[8]。Gehrke A等[9]研究发现GprC和GprD参与调控烟曲霉(Aspergillus fumigatus)的菌落生长、菌丝形态发生和毒力;Xue C等[10]发现在新隐球菌(Cryptococcus neoformans)中 Gpr4感知氨基酸可激活依赖cAMP的蛋白激酶A途径;Li L等[11]发现在粗糙链孢霉(Neurospora crassa)中GPR-4对碳源依赖的无性生长和发育是必需的;Miwa T等[12]发现Gpr1调控白色念球菌(Candida albicans)的形态发生和菌丝形成;Han K等[13]发现GprD负调控构巢曲霉(A. nidulans)的有性发育。这些研究结果表明,G蛋白偶联受体在真菌生长、形态发生和毒力等生物过程中具有重要调控作用。在尖孢镰刀菌中,一些学者发现G蛋白基因(fga1、fga2和fgb1)参与尖孢镰刀菌黄瓜专化型(F. oxysporum f. sp. cucumerinum)的发育和致病性,并可能参与胞外信号在胞内的传递。但是,迄今与G蛋白复合物结合的G蛋白偶联受体仍未有所研究报道。
笔者采用生物信息学方法从尖孢镰刀菌古巴专化型基因组序列中鉴定了假定G蛋白偶联受体编码基因Fogpr1,发现其编码蛋白与芽殖酵母G蛋白偶联受体Gpr1、烟曲霉GprC和GprD等在发育关系上较为接近,相似性较高。为验证其功能,笔者进一步通过基因敲除实验获得Fogpr1敲除突变体,并对突变体进行了分析,以期了解其功能及在尖孢镰刀菌古巴专化型侵染香蕉过程中的作用。
1 材料与方法
1.1 材料
(1)培养基PDA、PDB和再生培养基的配制参照文献[4]的方法进行。
(2)0.7 mol/L氯化钠溶液,Driselase崩溃酶溶液(20 mg/mL, Sigma)转化使用的STC溶液和PTC溶液的配制方法参考文献[4]。
(3)供试菌株和质粒尖孢镰刀菌古巴专化型(F. oxysporum f. sp. cubense)4号小种菌株B2和pCT74质粒由中国热带农业科学院环境与植物保护研究所微生物资源研究利用课题组保存。
(4)供试香蕉品种巴西蕉苗(Musa sp. AAA. cv. Brazil)由中国热带农业科学院组织培养中心提供,株高大约20 cm。
1.2 方法
(1)真菌基因组DNA提取野生型菌株B2和转化菌株的菌丝体培养及基因组DNA提取参照文献[14]的方法。
(2)fogpr1基因敲除载体的构建以野生型菌株基因组DNA为模板,用引物对AF(5′-ggggtaccATG
TCAGCAACAGAAGGAAGATG-3′, 划线碱基为KpnⅠ识别序列)和AR(5′-ccgctcgagACAGTAACGGCGGT
CAATCC-3′,划线碱基为XhoⅠ识别序列)进行PCR扩增,获得fogpr1基因开放阅读框上游5′端745 bp同源臂DNA;用引物对BF(5′-tcccccgggTG
TTCCACTCACCAATCTCCTT-3′,划线碱基为SmaⅠ识别序列)和BR(5′-tgctctagaCTGCTCTGCTGTTGTT
GACTAA-3′,划线碱基为XbaⅠ识别序列)进行PCR扩增,获得下游3′端826 bp同源臂DNA。PCR扩增采用Premix TaqTM试剂(TaKaRa, Dalian),扩增条件为:95 ℃预变性5 min,然后进行35个扩增循环,即95 ℃变性30 s,53 ℃退火30 s,72 ℃延伸1 min,最后72 ℃保温5 min。所扩增的DNA片断分别连接于pMD19T载体,形成pMD19T-5A和pMD19T-3B克隆载体。再用限制性内切酶KpnⅠ和XhoⅠ、SmaⅠ和XbaⅠ从克隆载体切下5′端和3′端同源臂DNA,分别连接于相同限制性内切酶酶切的线性pCT74载体(包含潮霉素抗性基因hph和GFP基因表达盒)中,构建成pCT74-fogpr1载体。最后用KpnⅠ和XbaⅠ从pCT74-fogpr1载体中切下用于转化的DNA片断,回收纯化备用。
(3)尖孢镰刀菌古巴专化型原生质体制备参照文献[4]的方法进行。
(4)PEG介导的原生质体转化参照文献[4]的方法进行。
(5)PCR扩增鉴定fogpr1基因敲除突变体以fogpr1转化子和野生型菌株B2基因组DNA为模板,采用引物F1(5′-GTGTTGGAGGTGATTATGAG-3′)和F2(5′-CGTTGCAAGACCTGCCTGAA-3′)进行PCR扩增,检测转化子是否在fogpr1 5′端发生的同源重组;用引物C1(5′-ATGAACTCGCAAGGCAACAG-3′)和C2(5′-TCATTTTCCTCTCGGTGTACG-3′)进行PCR扩增,检测转化子是否存在fogpr1基因,预计分别扩增约2 180 bp和1 606 bp DNA片断。如果用F1和F2引物进行PCR扩增结果为阳性而用C1和C2 引物进行PCR扩增结果为阴性,那么这类转化子即为fogpr1基因敲除突变体。PCR扩增采用Premix TaqTM试剂(Takara,Dalian),扩增条件与1.2-(2)所述相同,除延伸时间改为2 min外。
(6)酵母双杂载体的构建及酵母转化分别用引物对Fogpr1_A(5′-ggaggccagtgaattcAAGCTTACGAC
ATGGAGCTTG-3′和5′-cgagctcgatggatccTTGATTCGG
TCGTCGAGGGGC-3′,小写字母碱基为同源重组序列,下同)和引物对Fogpr1_B(5′-ggaggccagtgaattcCG
AAACACCATCGTCTTCGCC-3′和5′-cgagctcgatggatcc
TCTATGCGCATCCATGCTCCT-3′),以基因组DNA为模板,进行PCR扩增,可获得Fogpr1胞内肽段A(第48~109氨基酸残基)和B(第344~479氨基酸残基)DNA编码序列,分别為186 bp和408 bp。采用clonase酶(Clontech, USA)通过重组反应,分别连接于捕获载体pGADT7 AD,形成载体pGADT7-A和-B。分别用引物对T7-fga1(5′-catggaggccgaattcAT
GGGCTGCGGAATGAGCACAGAG-3′和5′-gcaggtcga
cggatccTTAGATAAGACCACAGAGACGCAG-3′)、T7-
fga2(5′-catggaggccgaattcATGGGCGCATGCATGAGC
TCGAGT-3′和5′-gcaggtcgacggatccTCAAAGAATGCC
CGAGTCCTTAAG-3′)和T7-Fgb1(5′-catggaggccgaat
tcATGAACTCGCAAGGCAACAGT-3′和5′-gcaggtcga
cggatccTCATTTTCCTCTCGGTGTACG-3′),以cDNA为模板,进行PCR扩增,获得G蛋白α和β亚基编码基因fga1、fga2和fgb1序列,并分别连接于诱饵载体pGBKT7中,形成载体pGBKT7-fga1、-fga2和-fgb1。随后将所构建捕获载体和诱饵载体送至上海生工生物工程技术服务有限公司测序。验证克隆序列正确后,将捕获载体和诱饵载体进行两两组合,共转化酵母菌株Y2H Gold。酵母转化参照Matchmaker Gold Yeast Two-Hybrid System试剂盒(Clontech, USA)所示的说明书方法进行。在QDO培养基上筛选阳性克隆。同时,共转化空载的捕获载体和诱饵载体的酵母Y2H Gold菌株做对照。
(7)致病性测定及病情统计将fogpr1敲除突变体和野生型菌株B2菌株分别接种于300 mL的PDB培养基中,置于25 ℃、180 r/min的摇床中震荡培养7 d。离心收集分生孢子,用蒸馏水重悬,将分生孢子悬浮液浓度调至106个/mL。野生型菌株与fogpr1敲除突变体均处理30株幼苗,每株苗浇50 mL孢子悬浮液,以无菌水作为对照。实验重复3次。处理后,按照常规方法栽培管理,并观察植株的发病情况。接种处理30 d后,从中间纵向切开球茎,观察球茎褐变程度以及叶片黄化情况,记录每株幼苗发病级数,病害分级详见文献[14]: 0级健康无发病;1级20%以内球茎组织褐变;2级40%以内球茎褐变;3级为60%以内球茎褐变;4级为80%以内球茎褐变,叶片黄化;5级为80%以上球茎褐变,植株死亡。
1.3 数据处理
接种fogpr1突变体和野生型菌株B2的香蕉幼苗发病情况用病情指数表示,病情指数计算采用公式:病情指数=100×[∑(植株发病级数×对应株数)/(植株发病最高级数×总株数)]。数据采用SigmaPlot 12.5软件统计分析模块进行统计分析。
2 结果与分析
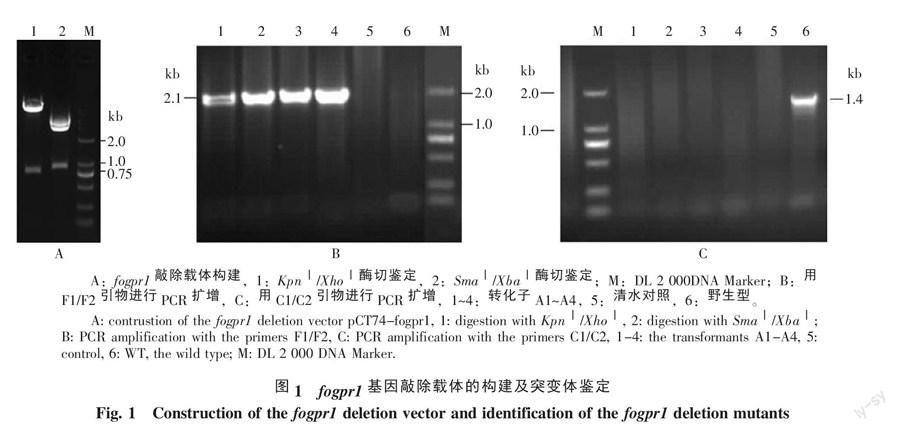
2.1 fogpr1基因敲除载体的构建与突变体鉴定
用限制性内切酶KpnⅠ和XhoⅠ酶切fogpr1基因敲除载体pCT74-fogpr1,结果可切下预计的约750 bp DNA条带,用SmaⅠ和XbaⅠ酶切,可切下约840 bp DNA条带(图1-A)。测序结果表明所克隆的DNA序列正确。这些结果表明fogpr1基因敲除载体已构建成功。以其中4个转化子和野生型菌株基因组DNA为模板,用F1/F2引物对进行PCR扩增,结果显示,以转化子A1~A4基因组DNA为模板,可扩增到大约2.1 kb的DNA扩增条带,野生型及清水对照均无PCR扩增条带(图1-B);用C1/C2引物对进行PCR扩增,结果显示,以转化子A1~A4的DNA和清水为模板,PCR扩增检测均无条带,而以野生型菌株B2的DNA为模板,可检测到1.4 kb左右的DNA扩增条带(图1-C)。这些结果表明转化子A1~A4均为fogpr1敲除突变体。
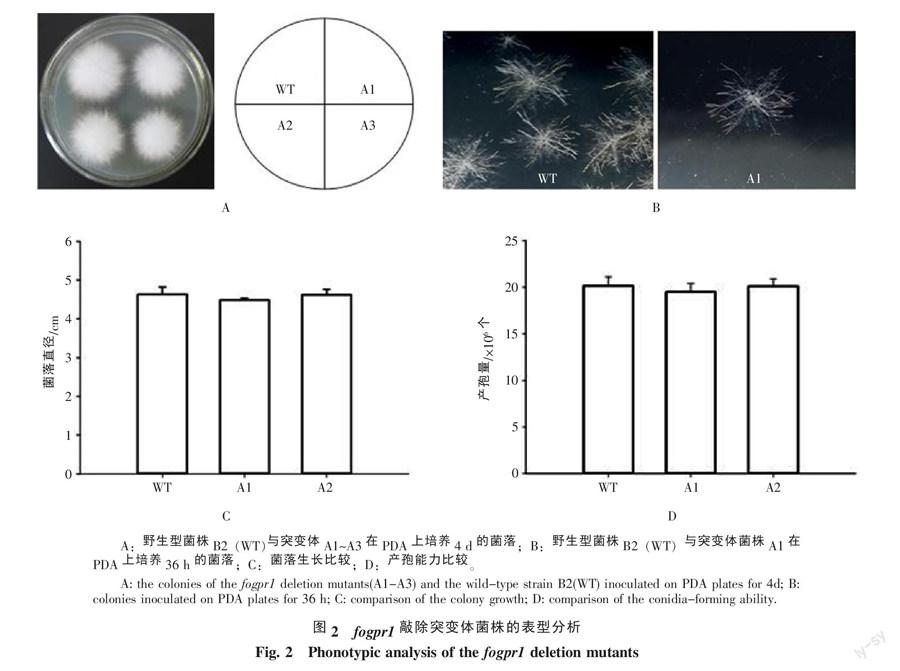
2.2 fogpr1基因敲除突变体表型分析
在PDA平板上培养36 h,fogpr1敲除突变体菌株(A1~A3)与野生型菌株B2形成的菌落形态相似(图2-A);菌丝均呈辐射状向四周生长,没有明显差异(图2-B)。在PDA平板上培养4 d,野生型菌落平均直径(4.62 cm)与突变体菌株A1和A2菌落平均直径相当(4.61 cm和4.48 cm,图2-C)。在PDA平板上培养7 d,A1和A2突变体菌株产孢量(20.1×106个和19.5×106个,图2-D)与野生型菌株B2产孢量(20.0×106个)相当。结果表明,敲除fogpr1基因没有导致尖孢镰刀菌的表型发生明显变化。
2.3 fogpr1基因敲除突变体对巴西蕉的致病性
致病性测定结果显示,接种fogpr1敲除突变体菌株A1和A2的巴西蕉植株平均病情指数(43.3和41.9,图3)与野生型菌株B2的平均病情指数(45.2,图3)相当,而对照没有发病。该结果表明敲除fogpr1基因不影响其对巴西蕉的致病性。
2.4 Fogpr1与G蛋白的互作分析
利用酵母双杂系统分析Fogpr1蛋白与G蛋白的互作,结果显示,所有共转化诱饵载体和捕获载体的酵母菌株在DDO+X-α-Gal的平板上可正常生长;而在QDO+AbA抗性平板上,共转化pGADT7-53和pGADT7-T的正对照菌株菌落生长正常,可水解X-α-Gal产生蓝色底物,但共转化pGADT7-lam和pGADT7-T的负对照菌落不能生长,呈暗灰色,无蓝色底物产生(图4-A);同时,共转化pGADT7-Fogpr1-A与pGBKT7-Fga1、-Fga2和-Fgb1的酵母菌株可以正常生长,菌落呈白色,可产生蓝色底物(图4-B);再者,共转化pGADT7-Fogpr1-B与pGBKT7-Fga1、-Fga2和- Fgb1的酵母菌株可以正常生长,菌落呈白色,可产生蓝色底物(图4-C)。这些表明,Fogpr1蛋白胞内肽段A和B与Fga1和Fgb1在酵母双杂系统中存在互作,且与Fga2的互作最为明显。
3 讨论与结论
笔者用TMHMM软件预测Fogpr1蛋白的跨膜结构,结果表明尖孢镰刀菌Fogpr1蛋白具有典型G蛋白偶联受体的结构特征,包括7个跨膜区、4个胞外区和4个胞内区,暗示fogpr1可能是一个G蛋白偶联受体基因。基于蛋白氨基酸序列的聚类分析表明Fogpr1与已知功能的烟曲霉G蛋白偶联受体GprC和GprD[9]在进化关系上较为接近。為了分析fogpr1基因的功能,笔者构建了fogpr1基因敲除突变体,并分析该突变体的表型,发现其在菌落形态、菌丝生长、产孢能力和致病力等方面均没有发生明显的变化,表明fogpr1基因可能不参与调控尖孢镰刀菌生长、发育和致病力。该结果与Gehrke A等[9]报道的烟曲霉(A. fumigatus)假定G蛋白偶联受体GprC和GprD的功能明显不同。Gehrke A等研究发现敲除GprC和GprD导致突变体生长严重减缓,萌发率降低,在小鼠侵染模型中其致病力显著下降,而且基因互补可以恢复为初始野生型表型[9]。这表明虽然Fogpr1与GprC和GprD在进化关系上较为接近,但其在功能上并没有相似性。再者,由于Fogpr1不具有Fga1[15]、Fga2[16]和Fgb1[17-18]蛋白的功能如调控尖孢镰刀菌的菌丝分枝、细胞极性生长和致病力等,因此,推测Fogpr1可能与G蛋白不在一个信号传导途径上。
通過酵母双杂系统分析其与G蛋白Fga1、Fga2和Fgb1的互作,笔者发现其胞内区A和B均可以与G蛋白Fga1、Fga2和Fgb1的互作,表明Fogpr1可能是一个G蛋白互作的蛋白。由于烟曲霉GprC和GprD是否与G蛋白互作并无研究报道,因此无法得知。在新型隐球菌(C. neoformans)中,Xue C等[10]研究发现Gpr4可以与G蛋白α亚基Gpa1互作。Miwa A等[12]研究发现白色念球菌(C. albicans)的Gpr1的羧基端肽段可与G蛋白α亚基 Gpa2互作。这表明Fogpr1与新型隐球菌Gpr4和白色念球菌Gpr1相似,可以和G蛋白互作。因此Fogpr1可能是一个G蛋白偶联受体。
综上所述,根据fogpr1突变体的表型分析和酵母双杂实验结果,笔者推测Fogpr1可能是一个G蛋白偶联受体,但其并不参与调控尖孢镰刀菌的发育和致病性。至于该蛋白在尖孢镰刀菌古巴专化型中是否具有其他功能有待进一步研究。该研究为进一步鉴定G蛋白偶联受体奠定了基础。
参考文献
[1] Michielse C B, Rep M. Pathogen profile update: Fusarium oxysporum[J]. Molecular Plant Pathology, 2009, 10(3): 311-324.
[2] Pietro A D, Madrid M P, Caracuel Z, et al. Fusarium oxysporum: exploring the molecular arsenal of a vascular wilt fungus[J]. Molecular Plant Pathology, 2003, 4(5): 315-325.
[3] Guo L, Han L, Yang L, et al. Genome and transcriptome analysis of the fungal pathogen Fusarium oxysporum f. sp. cubense causing banana vascular wilt disease[J]. PloS One, 2014, 9(4): e95543.
[4] 郭立佳, 杨腊英, 王国芬, 等. 尖孢镰刀菌古巴专化型fgb1基因敲除突变体的构建与表型分析[J]. 热带作物学报, 2014, 35(11): 2 205-2 210.
[5] Li M H, Xie X L, Lin X F, et al. Functional characterization of the gene FoOCH1 encoding a putative alpha-1,6-mannosyltransferase in Fusarium oxysporum f. sp. cubense[J]. Fungal Genetics and Biology, 2014, 65: 1-13.
[6] 吴飞宏, 曾 涛, 陈汉清, 等. 尖镰孢古巴专化型4号小种T-DNA插入突变体Focr4-1562及其基因敲除子的生物学表型研究[J]. 菌物学报, 2012(4): 584-592.
[7] Qi X, Guo L, Yang L, et al. Foatf1, a bZIP transcription factor of Fusarium oxysporum f. sp. cubense, is involved in pathogenesis by regulating the oxidative stress responses of Cavendish banana (Musa spp.)[J]. Physiological and Molecular Plant Pathology, 2013, 84(0): 76-85.
[8] Mark C Overton, Sharon L Chinault, Kendall J. Blumer. Oligomerization of g-protein-coupled receptors: lessons from the yeast Saccharomyces cerevisiae[J]. Eukaryotic Cell, 2005, 4(12): 1 963-1 970.
[9] Gehrke A, Heinekamp T, Jacobsen I, et al. Heptahelical receptors GprC and GprD of Aspergillus fumigatus are essential regulators of colony growth, hyphal morphogenesis, and virulence[J]. Applied and Environmental Microbiology, 2010, 76(12): 3 989-3 998.
[10] Xue C, Bahn Y S, Cox G M, et al. G protein-coupled receptor Gpr4 senses amino acids and activates the cAMP-PKA pathway in Cryptococcus neoformans[J]. Molecular Biology of the Cell 2006, 17(2): 667-679.
[11] Li L, Borkovich K A. GPR-4 is a predicted G-protein-coupled receptor required for carbon source-dependent asexual growth and development in Neurospora crassa[J]. Eukaryotic Cell 2006, 5(8): 1 287-1 300.
[12] Miwa T, Takagi Y, Shinozaki M, et al. Gpr1, a putative G-protein-coupled receptor, regulates morphogenesis and hypha formation in the pathogenic fungus Candida albicans[J]. Eukaryotic Cell, 2004, 3(4): 919-931.
[13] Han K, Seo J, Yu J. A putative G protein-coupled receptor negatively controls sexual development in Aspergillus nidulans[J]. Molecular Microbiology, 2004, 51(5): 1 333-1 345.
[14] 郭立佳, 黃俊生, 王国芬, 等. 香蕉黑腐病菌(Botryodiplodia theobromae)的PCR检测[J]. 植物病理学报, 2007(3): 248-254.
[15] Jain S, Akiyama K, Mae K, et al. Targeted disruption of a G protein alpha subunit gene results in reduced pathogenicity in Fusarium oxysporum[J]. Current Genetics, 2002, 41(6): 407-413.
[16] Jain S, Akiyama K, Takata R, et al. Signaling via the G protein alpha subunit FGA2 is necessary for pathogenesis in Fusarium oxysporum[J]. FEMS Microbiology Letters, 2005, 243(1): 165-172.
[17] Delgado-Jarana J, Martinez-Rocha A L, Roldan-Rodriguez R, et al. Fusarium oxysporumG-protein beta subunit Fgb1 regulates hyphal growth, development, and virulence through multiple signalling pathways[J]. Fungal Genetics and Biology, 2005, 42(1): 61-72.
[18] Jain S, Akiyama K, Kan T, et al. The G protein beta subunit FGB1 regulates development and pathogenicity in Fusarium oxysporum[J]. Current Genetics, 2003, 43(2): 79-86.
责任编辑:沈德发
