广西甜瓜细菌性果斑病病原鉴定及16S rDNA序列分析
2016-05-30谢慧婷李战彪秦碧霞杨世安崔丽贤邓铁军蔡健和
谢慧婷 李战彪 秦碧霞 杨世安 崔丽贤 邓铁军 蔡健和


摘要:【目的】对广西区内疑似甜瓜细菌性果斑病的病原菌进行分离鉴定,明确引起该病害的病原菌,为甜瓜细菌性果斑病的抗病育种及综合防治提供理论依据。【方法】分别采集南宁市和贺州市疑似甜瓜细菌性果斑病的病叶(编号:WM0922)和病果(编号:XD0611)样品,对样品进行分离纯化,并通过测定分离菌株的致病性、觀察菌落形态和培养性状、测定其生理生化性状及比对分析16S rDNA序列,对供试病原菌进行鉴定。【结果】从编号WM0922的病叶上分离得到5株菌株,经致病性测定有3株菌株(WM0922-2、WM0922-3和WM0922-4)具有致病性;从编号XD0611的病果上分离得到8株菌株,经致病性测定有4株菌株(XD0611-5、XD0611-6、XD0611-7和XD0611-8)具有致病性;择优选取具有代表性的菌株WM0922-3和XD0611-7进行后续试验,发现二者均可侵染葫芦子叶,革兰氏反应均为阴性,培养性状及生理生化测定结果一致,对比分析16S rDNA基因序列,与Acidororax citrulli的相似性均在99%以上。【结论】引起甜瓜细菌性果斑病的病原菌为燕麦嗜酸菌西瓜亚种(A. avenae subsp. citrulli)。
关键词: 甜瓜;果斑病菌;病原菌鉴定;燕麦嗜酸菌西瓜亚种
中图分类号: S432.1 文献标志码:A 文章编号:2095-1191(2016)10-1698-06
0 引言
【研究意义】广西常年西甜瓜种植面积约6万ha,主要集中在南宁市、北海市、桂林市及桂东南和桂中的部分地区(洪日新等,2009)。近年来,随着广西甜瓜产业的迅猛发展,甜瓜病虫害也日益严重。2015年,在广西甜瓜种植区发现一种疑似国内检疫性病害——甜瓜细菌性果斑病,该病害早期可为害甜瓜叶片和茎秆,引起水渍状病斑,后干枯坏死;后期为害果实,引起果肉腐烂变质,个别大棚的发病率达100%,果农损失惨重。因此,对疑似甜瓜细菌性果斑病病原菌进行鉴定,明确引起该病害的病原菌,进而采取有针对性的防治措施,对保障广西甜瓜产业的健康发展具有重要意义。【前人研究进展】瓜类细菌性果斑病病害最早于1969年在美国佛罗里达州的西瓜上发现,1989年在美国大陆严重暴发(Crall and Schenck,1969;Hopkins,1989);1998年我国首次在西瓜上发现西瓜细菌性果斑病(张荣意等,1998)。1978年Schaad等首次将西瓜细菌性果斑病鉴定为Psendomonas psendomonas subsp. citrulli;1992年Willems等采用rRNA-DNA和DNA- DNA将西瓜细菌性果斑病病原菌更名为Acidororax avenae subsp. citrulli。我国对甜瓜细菌性果斑病病原菌鉴定的研究也较多。赵廷昌等(2001)采用柯赫氏法则、革兰氏染色反应、生理生化反应、细胞化学成分分析和DNA-DNA杂交的方法将内蒙古、新疆的甜瓜细菌性果斑病鉴定为A. citrulli。王晓东等(2010)采集武汉地区的甜瓜病样进行分离纯化,并采用致病性测定、形态学、培养性状、生理生化性状和16S rRNA序列分析等方法,将武汉地区的甜瓜细菌性果斑病鉴定为A. citrulli。吉训聪等(2012)采集海南甜瓜病样进行分离鉴定纯化,并采用柯赫氏法则对分离菌株进行致病性测定及形态学、培养性状、生理生化性状和16S rRNA序列等方法,将海南的甜瓜细菌性果斑病鉴定为A. citrulli。朱晓媛等(2013)从云南滇南地区采集疑似细菌性果斑病的西瓜、甜瓜样品,对其进行分离鉴定,观察分离菌的培养性状,分析其ITS序列,最终确定云南瓜类细菌性果斑病的病原菌为A. citrulli。【本研究切入点】虽然国内外对瓜类细菌性果斑病的研究较多,但未发现有对广西甜瓜细菌性果斑病病原菌鉴定的相关报道。【拟解决的关键问题】采用传统的细菌鉴定方法和现代分子生物学技术,对引起广西甜瓜细菌性果斑病的病原菌进行鉴定、分析,明确引起该病害的病原菌,以期为甜瓜细菌性果斑病的抗病育种及综合防治提供理论依据。
1 材料与方法
1. 1 试验材料
1. 1. 1 样品 2014年9月从南宁市武鸣县采集厚皮甜瓜(北甜一号甜瓜)植株上疑似细菌性果斑病的病叶,编号:WM0922;2015年6月从贺州市信都镇祉洞村采集薄皮甜瓜(广州白沙蜜甜瓜)疑似细菌性果斑病的病果,编号:XD0611;阳性对照菌株由中国农业科学院郑州果树研究所古勤生老师课题组提供,编号:B+。
1. 1. 2 试剂 细菌基因组DNA提取试剂盒及2×Taq Master Mix均购自北京康为世纪生物科技有限公司,其余试剂均为国产分析纯。
1. 2 试验方法
1. 2. 1 病原菌分离 参照方中达(1998)的方法,选取疑似甜瓜细菌性果斑病的病瓜和病叶,切取病健交界部位的组织,75%酒精消毒20 s,移至5%次氯酸钠溶液消毒1 min,灭菌水冲洗3次,置于灭菌研钵中研磨,加无菌水浸泡20 min,然后在YDC培养基上划线接种,28 ℃培养48 h,选取单菌落进行纯化培养。
1. 2. 2 病原菌致病性测定 将分离获得的菌株分别接种于LB培养液中,28 ℃培养36 h后制成1×108 CFU/mL菌悬液。
厚皮甜瓜叶片上的致病性测定:选取健康厚皮甜瓜种子120粒,每20粒种子为1组,浸泡于不同编号的菌悬液中30 min,以无菌水为对照,分别水洗后每组中的20粒种子分成3份种植于穴盘中,常规管理。
薄皮甜瓜果实上的致病性测定:选取健康薄皮甜瓜,75%酒精擦拭果皮表面后用接种针蘸取菌悬液分别针刺于果皮表面,28 ℃保湿培养48 h,观察结果。
根据甜瓜叶片和果实上的致病性测定结果,测试获得供试菌株对葫芦苗的致病性:选取健康安生葫芦种子100粒,正常催芽后每20粒种子为1组,浸泡于不同编号的菌悬液中30 min,以无菌水为对照,分别水洗后种植于穴盘中,常规管理。
1. 2. 3 病原菌形态观察 将分离纯化后获得的菌株分别接种于LA培养基上,于28 ℃恒温箱中培养48 h后,观察菌落形态、质地、大小、透明度及表面光滑程度等培养性状。
1. 2. 4 病原菌生理生化性状测定 参考方中达(1998)、赵廷昌(2011)的方法。测定所用新鲜菌株均在NA培养基上培养24 h,每个测定重复3次。
1. 2. 5 马铃薯软化试验 参照赵廷昌等(2001)的方法,先将马铃薯切成片状,再将NA培养基上培养24 h的新鲜菌株用移菌环接种到片状马铃薯的切面,保湿后置于28 ℃恒温箱中,每天观察记录马铃薯腐败情况。
1. 2. 6 病原菌16S rDNA序列分析 细菌DNA的提取:参考试剂盒提供的方法进行DNA提取,获得的DNA溶液置于-20 ℃冰箱中保存备用。
PCR扩增:以细菌总DNA为模板,采用细菌16S rDNA的通用引物27F/1492R进行扩增(27F:5'-AGAG
TTTGATCCTGGCTCAG-3';1429R:5'-GGTTACCTT
GTTACGACTT-3',片段长1400 bp)。引物由英潍捷基(上海)贸易有限公司合成。
PCR反应体系(10.0 μL):2×Taq MasterMix 5.0 μL,引物27F(10 μmol/L)和1492R(10 μmol/L)各0.5 μL,菌体DNA模板0.5 μL,双蒸水3.5 μL。扩增程序:95 ℃预变性5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 45 s,进行30个循环;72 ℃延伸10 min,4 ℃下保存。
电泳检测PCR产物,将未纯化的PCR产物送英潍捷基(上海)贸易有限公司进行测序,测序结果通过BLAST程序与GenBank核酸数据库进行比对分析。
2 结果与分析
2. 1 病害田间症状
从南宁市武鸣县采集的厚皮甜瓜病叶(WM0922)发病症状:病叶发病初期有水浸状小斑点,扩大时有的受叶脉限制成多角形暗绿色病斑,有的沿叶脉发展成条形水渍状黄褐色病斑,随后变为褐色,干枯下陷,周围有黄色晕圈(图1)。
贺州市信都镇采集的薄皮甜瓜病瓜(XD0611)发病症状:发病初期在病果皮上出现圆形暗绿色水渍状斑点,后扩展为不规则形褐色水渍状病斑,病斑轻微凹陷,果皮变薄,一碰即裂,内部果肉变成水浸状腐烂(图2)。
2. 2 病原菌鉴定
2. 2. 1 病原菌分离结果 从编号WM0922的病叶上分离得到5株菌株,分别编号WM0922-1~WM0922-5;从编号XD0611的病果上分离得到8株菌株,分别编号XD0611-1~XD0611-8。分离得到的菌株分别接种于健康厚皮甜瓜叶片和健康薄皮甜瓜果皮上。
2. 2. 2 致病性测定结果 接种菌株WM0922-2、WM0922-3和WM0922-4的厚皮甜瓜子叶张开时均出现症状,且发病率在98%以上;接种菌株WM0922-1和WM0922-5的厚皮甜瓜植株均未表现症状。发病初期厚皮甜瓜子葉叶尖或叶缘出现水渍状病斑,四周有黄色晕圈,随后向子叶基部扩展成条形或不规则形水浸状病斑,病斑扩展至嫩茎时引起嫩茎腐烂,幼苗很快死亡(图3-A)。对发病后的厚皮甜瓜子叶进行分离纯化,得到与供试菌株形态特征相同的菌株。
接种菌株XD0611-5~XD0611-8的薄皮甜瓜果皮48 h后均出现症状;接种菌株XD0611-1~XD0611-4的薄皮甜瓜果皮均未表现症状。发病初期果皮表面针孔处出现水渍状病斑(图3-B),随后病斑相连扩展,切开发病部位果皮可见果肉已腐烂,并伴有恶臭味。将发病后的果皮进行分离纯化,得到与供试菌株形态特征相同的菌株。
择优选取具有代表性的菌株WM0922-3和XD0611-7进行后续试验。供试菌株WM0922-3和XD0611-7及对照菌株B+对葫芦苗的致病性测定结果显示,供试菌株和对照菌株均在葫芦子叶张开时即出现症状,且发病率在95%以上。发病初期葫芦子叶叶尖或叶缘上出现水渍状区域,随后向子叶基部扩展成条形或不规则形水浸状病斑,子叶病斑扩展至嫩茎时引起嫩茎腐烂,幼苗很快死亡;子叶病斑逐渐扩大,四周有黄色晕圈,后干枯呈灰褐色坏死斑(图4)。将发病后的葫芦子叶进行分离纯化,得到与供试菌株形态特征相同的菌株。
2. 2. 3 菌株培养性状 2株供试菌株在LA培养基上置于28 ℃培养48 h,菌株呈乳白色、半透明状、圆形、表面光滑、隆起,直径1~2 mm;在YDC培养基上菌落呈白色。革兰氏染色反应均为阴性。
2. 2. 4 生理生化特性 供试菌株WM0922-3、XD0611-7和阳性对照B+的生理生化测定结果(表1)相同,其中测定结果表现为阳性的项目有:过氧化氢酶、氧化酶、柠檬酸钠盐、明胶液化、淀粉水解、3%氯化钠溶液、硝酸盐还原和亚硝酸盐还原;测定结果表现为阴性的项目有:KB产荧光、5%氯化钠溶液、吲哚的产生、甲基红试验、丙二酸钠盐和V-P试验。
2. 2. 5 马铃薯软化情况 供试菌株WM0922-3和XD0611-7及阳性对照B+均能引起马铃薯薯块软化腐烂。
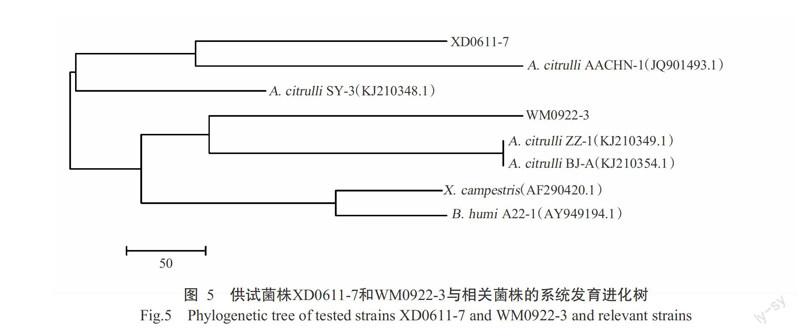
2. 2. 6 16S rDNA序列分析 对供试菌株WM0922-3和XD0611-7的16S rDNA序列进行扩增及序列测定分析,获得2株供试菌株的16S rDNA片段长度分别为1369和1368 bp(GenBank登录号分别为KU758900和KU865320)。将供试菌株的16S rDNA序列用BLAST在GenBank中进行同源性比对,结果发现,供试菌株WM0922-3和XD0611-7与A. citrulli各菌株16S rDNA的相似性均在99%以上。为进一步了解该菌株的进化情况,以Xanthomonas campestris和Burkholderia humi为外群,用MEGA 5.2的Neighbor-Joining法构建系统发育进化树(图5)。从图5可以看出,供试菌株XD0611-7与海南地区A. citrulli(JQ901493.1)处于同一分支;菌株WM0922-3与郑州地区A. citrulli(KJ210349.1)和北京地区A. citrulli(KJ210354.1)处于同一分支,说明XD0611-7与A. citrulli(JQ901493.1)可能具有较近的亲缘关系,而WM0922-3与A. citrulli(KJ210349.1、KJ210354.1)具有较近的亲缘关系。序列分析及系统发育进化树分析结果均表明,供试菌株WM0922-3和XD0611-7均为燕麦嗜酸菌西瓜亚种(A. avenae subsp. citrulli)。
3 讨论
本研究采集广西区疑似甜瓜细菌性果斑病样品2份,对其进行分离纯化,编号WM0922的样品分离获得5株菌株,编号XD0611的样品分离获得8株菌株。对分离获得的菌株进行致病性测定,结果发现编号WM0922-2、WM0922-3和WM0922-4的菌株能够侵染厚皮甜瓜子叶,表现相同症状;菌株编号XD0611-5、XD0611-6、XD0611-7和XD0611-8的菌株能够侵染薄皮甜瓜果皮,表现相同症状;且能再次分离后得到培养性状相同的病菌,说明菌株为引起该病害的病原菌。据相关文献报道(赵廷昌等,2001),该病原菌可侵染多种葫芦科作物,因此择优选取具有代表性的菌株WM0922-3和XD0611-7对葫芦苗进行致病性测定,结果发现,2株供试菌株均可引起葫芦子叶相同的水浸状病斑。
供试菌株WM0922-3、XD0611-7和阳性对照B+的生理生化测定结果相同,与国内外的研究结果基本一致,但个别特性仍有些许差异,其中明胶液化结果为阳性,与赵廷昌等(2001)、任小平等(2010)相同,但与金岩等(2004)、王晓东等(2010)不同;淀粉水解结果为阳性,与王晓东等(2010)相同,但与赵廷昌等(2001)、蔡学清等(2005)不同;V-P试验结果为阴性,与王晓东等(2010)相同,但与张悦丽等(2014)不同;马铃薯软化试验结果与金岩等(2004)、吉训聪等(2012)相同,均可引起马铃薯软化腐烂,但与赵廷昌等(2001)、王晓东等(2010)不同。其原因可能是由于病害采集地理位置不同、气候条件差异及菌株株系间存在遗传分化,导致不同菌株特性间的细微区别。
对供试菌株WM0922-3和XD0611-7进行16S rDNA序列扩增及序列测定分析,结果发现,2株供试菌株与A.citrulli各菌株16S rDNA的相似性均在99%以上。从系统发育进化树中发现,WM0922-3与郑州地区和北京地区A. citrulli具有较近的亲缘关系,XD0611-7与海南地区A.citrulli具有较近的亲缘关系。因甜瓜细菌性果斑病是典型的种传病害,带菌种子的调运是主要传播途径之一,故推测供试菌株与其他地区具有较近亲缘关系的原因可能与甜瓜生产中带菌种子的调运有关。
综合以上结果,确定了广西区内厚皮甜瓜和薄皮甜瓜上分离得到的病原菌均为燕麦嗜酸菌西瓜亚种(A. avenae subsp. citrulli)。此病原菌可引起甜瓜细菌性果斑病,且具有危害重、传播迅速、防治困难等特点,今后应加强引种的检疫,封锁发病区,彻底销毁病株、消毒病土,以控制该病害的蔓延,避免造成经济损失。本研究明确了广西甜瓜细菌性果斑病的病原及其生理特性,对该病害的检验检疫、抗病育种和综合防控具有重要意義。但对于该病原菌的致病类型、寄主范围和药剂防治,还有待进一步研究。
4 结论
本研究采用传统细菌鉴定方法和现代分子生物学技术对广西厚皮甜瓜和薄皮甜瓜上疑似细菌性果斑病的病原进行分离和鉴定,明确该病原菌为燕麦嗜酸菌西瓜亚种(A. avenae subsp. citrulli)。
参考文献:
蔡学清,黄月英,杨建珍,陈军,蔡国隆,胡方平. 2005. 福建省西瓜细菌性果斑病的病原鉴定[J]. 福建农林大学学报(自然科学版), 34(4): 434-437.
Cai X Q,Huang Y Y,Yang J Z,Chen J,Cai G L,Hu F P. 2005. Pathogen identification of bacterial fruit blotch of watermelon in Fujian[J]. Journal of Fujian Agriculture and Forestry University(Natural Science Edition), 34(4): 434-437.
方中达. 1998. 植病研究方法[M]. 第3版. 北京: 中国农业出版社.
Fang Z D. 1998. Methodology for Plant Pathology[M]. The 3rd Edition. Beijing: China Agricultural Press.
洪日新,李文信,李天艳. 2009. 广西西甜瓜生产发展现状与研究进展[C]//第12次全国西甜瓜科研生产协作会议学术交流论文摘要集:221.
Hong R X,Li W X,Li T Y. 2009. Current status and research development of watermelon and melon production in Guangxi[C]//The 12th Abstract Set of Scientific Research and Production Coordination Meeting for Watermelon and Melon in China:221.
金岩,张俊杰,吴燕华,高洁. 2004. 西瓜细菌性果斑病的发生与病原菌鉴定[J]. 吉林农业大学学报, 26(3): 263-266.
Jin Y,Zhang J J,Wu Y H,Gao J. 2004. Occurrence of watermelon bacterial fruit blotch and identification of its pathogens[J]. Journal of Jilin Agricultural University, 26(3): 263-266.
吉训聪,肖彤斌,黄伟明,肖敏,赵志祥,陈绵才. 2012. 海南甜瓜细菌性果斑病病原菌鉴定[J]. 广东农业科学, 39(11):89-91.
Ji X C,Xiao T B,Huang W M,Xiao M,Zhao Z X,Chen M C. 2012. Pathogen identification of bacterial fruit blotch of melon in Hainan[J]. Guangdong Agricultural Sciences, 39(11):89-91.
任小平,李小妮,王琳,孙嘉祥,吴九玲,刘琼光. 2010. 广东西瓜果斑病的病原鉴定[J]. 华南农业大学学报, 31(4): 40-43.
Ren X P,Li X N,Wang L,Sun J X,Wu J L,Liu Q G. 2010. Identification for pathogen of bacterial fruit blotch of watermelon in Guangdong province[J]. Journal of South China Agricultural University, 31(4): 40-43.
王晓东,孙玉宏,葛米红,李国庆. 2010. 武汉地区保护地甜瓜细菌性斑点病病原鉴定[J]. 湖北农业科学, 49(8): 1883-1886.
Wang X D,Sun Y H,Ge M H,Li G Q. 2010. Identification of causal organism of bacterial leaf blotch of melon from a greenhouse in Wuhan[J]. Hubei Agricultural Sciences, 49(8): 1883-1886.
赵廷昌. 2011. 植物病原细菌鉴定实验指导[M]. 第3版. 北京: 中国农业科学技术出版社.
Zhao T C. 2011. Identification and Experiment Instruction for Plant Pathogenic Bacteria[M]. The 3rd Edition. Beijing: China Agricultural Science and Technology Press.
赵廷昌,孙福在,王兵万,回文广. 2001. 哈密瓜细菌性果斑病病原菌鉴定[J]. 植物病理学报, 31(4): 358-364.
Zhao T C,Sun F Z,Wang B W,Hui W G. 2001. Pathogen identification of Hami melon bacterial fruit blotch[J]. Acta Phytopathologica Sinica, 31(4): 358-364.
张荣意,谭志琼,文衍堂,张惠梅,简日明. 1998. 西瓜细菌性果斑病症状描述和病原菌鉴定[J]. 热带作物学报, 19(1): 70-76.
Zhang R Y,Tan Z Q,Wen Y T,Zhang H M,Jian R M. 1998. Description and identification of the causal organism of bacterial fruit blotch of watermelon[J]. Chinese Journal of Tropical Crops, 19(1): 70-76.
张悦丽,齐军山,张博,李林,徐作珽,郑继法,李长松. 2014. 山东省西瓜细菌性果斑病的病原菌鉴定[J]. 山东农业科学, 46(3): 83-85.
Zhang Y L,Qi J S,Zhang B,Li L,Xu Z T,Zheng J F,Li C S. 2014. Pathogen identification of watermelon bacterial fruit blotch in Shandong province[J]. Shandong Agricultural Sciences, 46(3): 83-85.
朱晓媛,王文成,徐烨,刘雅婷,郑元仙,江常杰,王金龙. 2013. 云南省瓜类细菌性果斑病的鉴定[J]. 云南農业大学学报(自然科学版),28(2): 175-179.
Zhu X Y,Wang W C,Xu Y,Liu Y T,Zheng Y X,Jiang C J,Wang J L. 2013. Identification of bacterial fruit blotch of melons found in Yunnan province[J]. Journal of Yunnan Agricultural University(Natural Science), 28(2):175-179.
Crall J M,Schenck N C. 1969. Bacterial fruit rot of watermelon in Florida[J]. Plant Disease, 53:74-75.
Hopkins D L. 1989. Bacterial fruit blotch of watermelon : a new disease in the eastern USA[J]. Process Cucurbitaceae,89:74-75.
Schaad N W,Sowell G J,Goth R W,Colwell R R, Webb R E. 1978. Psendomonas psendoalcaligenes subsp. citrulli subsp. nov.[J]. International Journal of Systematic Bacteriology, 28(1): 117-125.
Willems A,Goor M,Thielemans S,Gillis M,Kersters K,De Ley J.. 1992. Transfer of several phtyopath of genic pseudomonas species to Acidororax as Acidororax avenae subsp. avenae subsp. nov., Acidororax avenae subsp. citrulli, Acidororax avenae subsp. cattleyae and Acidororax konjaci[J]. International Journal of Systematic Bacteriology,42(1): 107-119.
(责任编辑 麻小燕)
