荸荠组培苗在间歇浸没式生物反应器(TIBs)中的高效增殖技术
2016-05-30高美萍林志城张驰江文董伟清欧昆鹏桂杰闭志强何芳练陈丽娟
高美萍 林志城 张驰 江文 董伟清 欧昆鹏 桂杰 闭志强 何芳练 陈丽娟


摘要:【目的】探讨间歇浸没式生物反应器(TIBs)对荸荠(Eleocharis dulcis)组培苗快速繁殖的效果,为提高荸荠组培苗繁殖效率及其工厂化生产提供技术支撑。【方法】以初代诱导培养获得的桂蹄2号荸荠组培苗为外植体,利用TIBs系统进行组培快繁,研究荸荠组培苗不同继代代数、接种密度、激素组合及反应器间歇浸没频率等因子对荸荠组培增殖的影响。【结果】经初代诱导培养的第4、5、6代继代材料增殖倍数较高,其中第6代继代苗增殖倍数最高,达31.1倍,到第7代后随继代代数的增加增殖倍数逐渐降低。当接种密度大于15丛/瓶时,外植体污染率达16.0%;当接种密度低于10丛/瓶时,外植体的污染率为0。低于10 min/6 h的间歇浸没频率有利于降低污染率,在6 h内低于15 min的浸没时间有利于降低玻璃化苗率;当激素组合为3.0 mg/L 6-BA+0.01 mg/L NAA时,组培苗增殖倍数达38.5倍,且组培苗生长正常。【结论】在TIBs系统中,采用经初代诱导培养的第5代荸荠继代组培苗,增殖培养基为MS+3.0 mg/L 6-BA+0.01 mg/L NAA+30.0 g/L蔗糖,pH 6.0,接种密度10丛/瓶,反应器间歇浸没频率为10 min/6 h,可获得较好的培养效果。
关键词: 荸荠;组培苗;TIBs;高效增殖
中图分类号: S645.3 文献标志码:A 文章编号:2095-1191(2016)10-1653-05
0 引言
【研究意义】荸荠(Eleocharis dulcis)属莎草科荸荠属,又叫马蹄、乌芋、通天草等,是我国原产的一种多年水生草本植物,其味甜多汁,肉质松脆爽口消渣,是一种药食兼用的果蔬。荸荠不仅是广西名特优农产品之一,还是我国传统的重要出口创汇产品之一。传统荸荠组织培养主要采用半固体培养,该方法在组织培养操作过程中需要大量的手工劳动,增殖率较低,是一种劳动密集型技术。因此,加强对荸荠组培快繁技术的研究,对于解决市场需求、实现荸荠组培苗工厂化生产具有重要意义。【前人研究进展】间歇浸没式生物反应系统是近20年来发明的一种用于植物组织快繁生产的系统,最先由Teisson改进命名。该培养方式结合固体培养和液体培养的优点而舍弃其缺点,使培养材料达到最大增殖数(Alverd et al.,1993;Etienne and Berthouly,2002;Be and Debergh,2006;Benlal et al.,2008)。目前,国外利用间歇浸没式生物反应器(TIBs)进行组培快繁研究的植物品种较多,国内利用该套系统进行研究的作物品种也在不断增多,其中在甘蔗上的研究报道较多。Lorenzo等(2001)利用TIBs系统对一个古巴甘蔗品种进行组织培养,其一代增殖可达40倍,获得的组培苗在田间的生长情况也较传统方法获得的组培苗适应性好。Angela等(2009)将几个澳大利亚甘蔗品种在不同生物反应器中进行试验比较,发现利用TIBs系统的甘蔗组培苗一代增殖率超过20倍。在国内,部分学者采用TIBs系统对甘蔗和香蕉进行组培快繁研究。刘丽敏等(2009)利用TIBs系统对ROC16和ROC22两个甘蔗品种进行组培快繁研究,发现ROC16一代增殖率达40倍,ROC22一代增殖率为30倍。杨柳等(2011)以新台农22号茎尖脱毒组培苗为材料,研究了不同激素组合、间歇浸没频率、接种密度等因素对其在TIBs系统中增殖效果的影响,结果表明,该系统可使甘蔗组培一代增殖40倍以上。李铁军等(2012)以笃斯越橘(Vaccinium uliginosum)丛生苗为材料,研究笃斯越橘在TIBs中的增殖效果,结果发现接种密度对笃斯越橘丛生苗增殖生长有重要影响,接种密度是重要的调控参数之一。【本研究切入点】目前,国内利用TIBs系统进行组培快繁的植物品种主要有甘蔗和香蕉,未见应用于水生蔬菜荸荠的相关报道。【拟解决的关键问题】研究荸荠组培苗不同继代代数、接种密度、激素组合及反应器间歇浸没频率等因子对荸荠组培增殖的效果,优化TIBs系统培养荸荠组培苗的增殖技术,为提高荸薺组培苗繁殖效率及其工厂化生产提供技术支撑。
1 材料与方法
1. 1 试验材料
以广西农业科学院生物技术研究所提供的经初代诱导培养的健康荸荠组培苗(桂蹄2号)为试验材料,诱导培养基为MS+1.0 mg/L BA+0.1 mg/L NAA+ 30.0 g/L蔗糖。TIBs系统根据Lorenzo等(1998)的设计思路建立。TIBs系统中培养瓶和储液瓶分别为2.5和3.0 L的广口无色玻璃瓶和三角瓶,瓶高分别为26和30 cm,直径为14和15 cm。储液瓶中液体培养基体积为1.0 L。
1. 2 试验方法
1. 2. 1 不同代数继代组培苗对TIBs系统组培的影响
分别以继代培养2~8代的组培苗为试验材料,增殖培养基为传统荸荠增殖培养基,即MS+6-BA 1.5 mg/L+ NAA 0.01 mg/L+30.0 g/L蔗糖,pH 5.8~6.0,TIBs系统间歇浸没频率为10 min/3 h,接种密度为10丛/L(每15颗芽为1丛)。
1. 2. 2 不同接种密度在TIBs系统中的增殖效果 在试验1.2.1基础上,以第5代继代组培苗为材料,培养基配方及TIBs条件同1.2.1,组培苗接种密度设置为5、10、15和20丛/L。
1. 2. 3 不同间歇浸没频率对TIBs系统组培的影响
在试验1.2.2基础上以第5代继代组培苗为试验材料,增殖培养基配方同上,接种密度10丛/L,TIBs系统间歇浸没频率设为10 min/3 h、10 min/6 h、10 min/12 h和10 min/24 h,共4个处理。
1. 2. 4 不同浸没时间对TIBs系统组培的影响 在试验1.2.3基础上以第5代继代组培苗为试验材料,增殖培养基配方同上,接种密度10丛/L,TIBs系统设组培苗在培养液中浸没时间为5、10、15、20和30 min/6 h,共5个处理。
1. 2. 5 不同激素组合对TIBs系统组培的影响 在试验1.2.4基础上以第5代继代组培苗为试验材料,接种密度为10丛/L,间歇浸没频率为10 min/6 h,6-BA浓度梯度设为1.0、1.5、2.0、3.0和4.0 mg/L,NAA浓度设为0.01和0.05 mg/L,共10个处理。
以上各试验培养条件:光照强度1500 lx,培养温度(28±2)℃,光照16 h/d,黑暗8 h/d。增殖培养40 d。试验均设每处理3套TIBs系统,重复2次,取平均值。
1. 3 统计分析
接种后每周观察记录1次生长状况,40 d后计算每瓶组培苗丛数,数据采用SPSS 18.0的SNK法进行差异显著性分析。
2 结果与分析
2. 1 不同代数荸荠继代组培苗在TIBs系统中的增殖效果
将经初代诱导培养的第2~8代荸荠组培苗转接到TIBs系统中培养,增殖效果见表1。经过40 d培养后,第4、5、6代继代组培苗增殖倍数较高,其中第6代继代组培苗增殖倍数最高,为31.1倍;到第7代增殖倍数开始下降,第8代增殖倍数降到最低,为22.6倍。随着继代苗代数的增加,组培苗增殖的时间推迟,第4、5、6、7代差异不显著(P>0.05,下同),均在6.0 d左右开始增殖。因此,为了保证材料的充足且不影响增殖倍数,利用TIBs系统进行荸荠组培苗快繁以第5代材料最佳。
2. 2 不同接种密度在TIBs系统中的增殖效果
选用第5代继代组培苗,研究不同接种密度对荸荠组培快繁效果的影响,结果见表2。随着接种密度的增加,增殖芽数也逐渐增多,但培养基污染风险加大,当接种密度大于15丛/瓶时污染率达16.0%,而低于10丛/瓶的接种密度外植体的污染率得到有效控制。因此,为达到低污染高增值的培养效果,选择10丛/瓶用于后续试验研究。
2. 3 不同间歇浸没频率在TIBs系统中的增殖效果
间歇浸没频率是TIBs系统的重要调控因素之一。选用第5代继代组培苗、接种密度10丛/瓶,研究间歇浸没频率对荸荠组培快繁效果的影响,结果见表3。由表3可知,随着间歇浸没频率的延长,组培苗的污染率上升,当间歇浸没频率达10 min/12 h后污染率明显增加,植株的生长势也较差;增殖倍数随着间歇浸没频率的延长而降低,当间歇浸没频率为10 min/3 h和10 min/24 h时,芽增殖倍数分别达到最高32.1倍及最低24.4倍;当间歇浸没频率为10 min/3 h和10 min/6 h时,芽增殖倍数均在30.0倍以上。由此可见,短时间的间歇浸没有利于荸荠植株的生长,提高荸荠组培苗的增殖率和降低污染率。本研究适宜的间歇浸没频率为10 min/6 h以下。
2. 4 不同浸没时间在TIBs系统中的增殖效果
由表4可知,随着浸没时间的增加,组培苗芽的增殖倍数逐渐增加,其中,每6 h浸没30 min的增殖倍数最高,为34.8倍。SNK法分析结果表明,浸没20 min与浸没30 min的增殖倍数间差异不显著,浸没5、10、15 min与浸没20、30 min的增殖倍数间差异显著(P<0.05,下同);延长浸没时间对组培苗生长势有促进作用;当浸没时间超过20 min 时组培苗出现玻璃化苗,玻璃化率为27.0%,浸没时间为30 min时玻璃化率为34.0%(表4)。为了控制组培苗的变异率,生产上在6 h内采用15 min以下的浸没时间有利于组培苗的正常生长。
2. 5 不同激素组合对荸荠组培苗增殖的影响
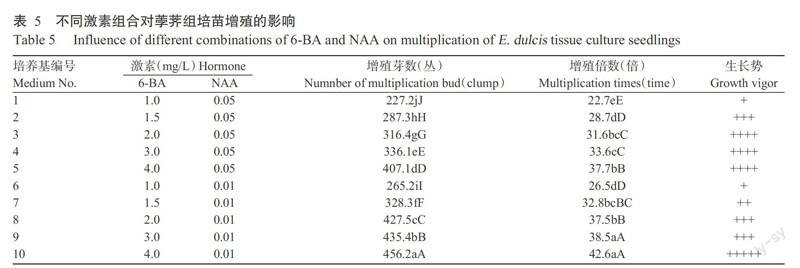
在上述试验结果的基础上,将组培诱导的第5代继代苗、接种密度10丛/瓶、间歇浸没频率采用10 min/6 h,转接至含不同浓度6-BA和NAA组合的增殖培养基中培养。培养6 d左右时基部长出新芽,25 d后可见1 cm长的新芽,30~40 d内新芽增长速度最快。从表5可以看出,芽的增殖倍数随着6-BA浓度的增加而逐渐上升,在4.0 mg/L 6-BA条件下培养基添加0.05和0.01 mg/L NAA,芽的增殖倍数最高,分别为37.7和42.6倍;当NAA为0.05 mg/L时,6-BA为1.0 mg/L与1.5、2.0、3.0、4.0 mg/L的增殖倍数差异显著,而2.0与3.0 mg/L、2.0与4.0 mg/L间的增殖倍数差异不显著;当NAA为0.01 mg/L时,6-BA为3.0与4.0 mg/L间增殖倍数差异不显著,其他处理间增殖倍数差异均显著;NAA 0.01 mg/L较0.05 mg/L更有利于芽的分蘖,增殖倍数更多,但植株较细,长势稍逊。试验还发现,当6-BA达到4.0 mg/L时出现丛生苗,苗细弱,紧密成一簇。为降低组培苗变异率,在保证组培苗质量的同时拥有较高的增殖倍数,以3.0 mg/L 6-BA+0.01 mg/L NAA最佳,在该条件下组培苗增殖倍数可达38.5倍。
3 讨论
本研究通过对荸荠组培苗在TIBs系统中继代增殖培养条件优化,得到采用经初代诱导培养到第5代继代组培苗、接种密度10丛/瓶、培养基激素组合3.0 mg/L 6-BA+0.01 mg/L NAA、間歇浸没频率10 min/6 h,组培苗增殖达38.5倍。杭玲等(2005,2007)利用荸荠茎尖分别进行固体和液体组织快繁培养,结果表明,固体培养一代继代增殖3~4倍,液体培养一代继代增殖6~8倍,而本研究采用的TIBs系统组培增殖倍数远高于传统固体和液体培养方法。Alverd等(1993)利用该系统对香蕉(Musa AAB)进行组培快繁研究,发现一代增殖率达30倍,其原因可能与TIBs系统有良好的气体交换环境有关;同时,培养基的循环利用可充分利用培养基的营养成分而有效防止营养沉积和有害物质积累(Aitken-Christie and Jones,1987)。
大量研究表明,使用不同代数的继代苗为外植体,其组培苗的生长、增殖等状况不同。杨柳等(2011)在利用TIBs进行甘蔗组培快繁研究时发现,以第4代甘蔗继代苗为接种材料最有利于甘蔗组培苗的增殖和生长;粟靖(2011)研究發现,以第7代香蕉不定芽为试验材料时,香蕉的生长和增殖效果最好。本研究利用TIBs系统进行荸荠组培苗快繁研究,选用第5代继代组培苗最理想。
间歇浸没频率和间歇浸没时间是影响植物组培快繁的关键因素之一,其直接影响外植体的呼吸和对营养的吸收(Shepherd and Silva,1996)。不同作物品种间最佳间歇浸没频率和浸没时间差异明显。Roels等(2005)研究表明,间歇浸没频率和浸没时间为20 min/h最有利于香蕉增殖;Angela等(2009)研究发现,间歇浸没频率和浸没时间为1 min/24 h对甘蔗品种Q165和Q117的增殖效果较好。本研究结果表明,荸荠组培苗的间歇浸没频率和浸没时间为10 min/6 h时增殖效果较好。可见,不同作物品种芽的增殖倍数与间歇浸没频率、浸没时间相关,具体原因有待对组培苗代谢及代谢产物进行深入探讨后才能确定。本研究中在6 h内间歇浸没时间低于15 min均未见玻璃化苗,浸没时间超过15 min则易出现玻璃化苗,具体引起玻璃化苗的原因有待进一步研究。另外,TIBs系统培养由于营养液富集,容易造成污染,培养中要严格筛选继代材料,避免细菌或霉菌类的污染材料接入培养瓶。
4 结论
本研究结果表明,利用TIBs系统进行荸荠组培苗快繁,适宜增殖生长的培养基为MS+3.0 mg/L 6-BA+
0.01 mg/L NAA+30.0 g/L蔗糖,pH 6.0,取第5代继代组培苗,接种密度10丛/L,间歇浸没频率10 min/6 h,继代增殖倍数可达38.5倍。
参考文献:
杭玲,黄卓忠,廖首发. 2007. 荸荠脱毒及组培快繁技术研究与应用[J]. 江苏农业科学,(6): 143-144.
Hang L, Huang Z Z, Liao S F. 2007. Research and application of water chestnut detoxification and tissue culture rapid propa-
gation technology[J]. Jiangsu Agricultural Sciences,(6): 143-144.
杭玲,苏国秀,蒋慧萍,黄卓忠,何铁光,蒙平,张向军. 2005. 荸荠的组织培养和快速繁殖[J]. 广西农业科学,36(4): 306-307.
Hang L, Sun G X, Jiang H P, Huang Z Z, He T G, Meng P, Zhang X J. 2005. Tissue culture and rapid propagation of water chestnut(Eleocharis tuberosa)[J]. Guangxi Agricultural Sciences, 36(4):306-307.
粟靖. 2011. 利用间歇浸没式生物反应器(TIBs)进行香蕉组培快繁研究[D]. 南宁:广西大学.
Li J. 2011. Banana micro-propagation in temporary immersion bioreactor system(TIBs)[D]. Nanning: Guangxi University.
李铁军,朴炫春,廉家盛,廉美兰. 2012. 利用生物反应器接触培养法增殖笃斯越橘丛生苗[J]. 林业科学,48(11):130-133.
Li T J, Piao X C, Lian J S, Lian M L. 2012. Proliferation of adventitious shoots of Vaccinium uliginosum using raft biore-
actors[J]. Scientia Silvae Sinicae,48(11):130-133.
刘丽敏,李松,戴友铭,余坤兴,刘红坚,淡明. 2009. 甘蔗茎尖脱毒培养技术研究[J]. 中国糖料,(2): 18-20.
Liu L M,Li S,Dai Y M,Yu K X,Liu H J,Dan M. 2009. Study on virus-free culture techniques of sugarcane stem tip[J]. Sugar Crops of China,(2): 18-20.
杨柳,秦刚,杨丽涛,吴建明,罗瑞鸿,魏源文,李杨瑞. 2011. 利用间歇浸没式生物反应器进行甘蔗组培快繁的研究[J]. 华南农业大学学报,32(1):37-41.
Yan L, Qin G, Yang L T, Wu J M, Luo R H, Wei Y W, Li Y R. 2011. Optimization of sugarcane rapid propagation in temporary immersion bioreactors system[J]. Journal of South China Agricultural University,32(1):37-41.
Aitken-Christie J,Jones C. 1987. Towards automation: Pine shoots hedges in vitro[J]. Plant Cell,Tissue and Organ Culture,8(3):185-196.
Alverd D,Cote F,Teisson C. 1993. Comparison of methods of liquid medium culture for banana micropropagation effects of temporary immersion of explants[J]. Plant Cell, Tissue and Organ Culture,32(1):55-60.
Angela M, Jean A B, Prakash L. 2009. Development of a temporary immersion system(RITAR) for mass production of sugarcane(Saccharum spp. Interspecific hybrids)[J]. In Vitro Cellular & Developmental Biology-Plant, 45(4):450-457.
Be L V,Debergh P C . 2006. Potential low cost micro-propagation of pineapple(Ananascomosus)[J]. South African Journal of Botany,72(2):191-194.
Bernal A, Machado P, Cortegaza L, Elva R. 2008. Priming and biopriming integrated into the sugarcane micropropagation technology by Temporary immersion bioreactors(TIBS)[J]. Sugar Tech,10(1):42-47.
Etienne H, Berthouly M. 2002. Temporary immersion in plant micro-propagation[J]. Plant Cell,Tissue and Organ Culture,69(3):215-231.
Lorenzo J C, González B L, Escalona M,Teisson C,Espinosa P,Borroto C. 1998. Sugarcane shoot formation in an improved temporary immersion system[J]. Plant Cell,Tissue and Organ Culture,54(3):197-200.
Lorenzo J C,Ojeda E,Espinosa A,Borroto C. 2001. Field performance of temporary immersion bioreactor-derived sugarcane plants[J]. In Vitro Cellular & Development Biology-Plant, 37(6): 803-806.
Roels S,EscalonaI M,Cejas I, Noceda C,Rodriguez R,Canal M J,Sandoval J,Debergh P. 2005. Optimization of Plantain (Musa AAB) micropropagation by temporary immersion system[J]. Plant Cell, Tissue and Organ Culture,82(1):57-66.
Shepherd K, Silva K M. 1996. Mitotic instability in banana varieties. Aberrations in conventional triploid plants[J]. Fruits Paris, 51(2): 99-103.
(責任编辑 麻小燕)
