黄喉拟水龟白眼病病原菌分离鉴定及药敏试验
2016-05-30陆专灵钟一治赵忠添雷燕韦友传张益峰
陆专灵 钟一治 赵忠添 雷燕 韦友传 张益峰


摘要:【目的】明确黄喉拟水龟白眼病的病原菌及其药敏特性,为该病的防控提供参考依据。【方法】对患白眼病的黄喉拟水龟进行无菌解剖、划线培养、分离筛选,对分离获得的菌株进行培养特征、生理生化特性鉴定、16S rDNA序列分析及同源性比对分析,通过动物致病性试验鉴定致病性,并采用药敏试验检验其耐药性。【结果】从患白眼病黄喉拟水龟稚龟肝脏、肺脏及脾脏中分离获得的优势菌株对小白鼠和黄喉拟水龟均有强的致病性,为兼性厌氧、产酸、产气、发酵型、无运动能力的革兰氏阴性杆菌,其16S rDNA序列(GenBank登录号KU855372)与肺炎克雷伯菌(Klebsiella pneumoniae)的同源性达99.1%。分离菌株对恩诺沙星、头孢噻吩、头孢噻肟、氧氟沙星等高度敏感,但对链霉素、新霉素、青霉素、卡那霉素、四环素、克林霉素、强力霉素、阿莫西林、复方新诺明等已产生耐药性。【结论】肺炎克雷伯菌是引起黄喉拟水龟白眼病的主要病原菌,生产中可选用恩诺沙星、氧氟沙星等沙星类或头孢噻吩、头孢噻肟等头孢类药物进行防治。
关键词: 黄喉拟水龟;白眼病;分离;鉴定;药敏试验
中图分类号: S947.12 文献标志码:A 文章编号:2095-1191(2016)11-1974-05
Abstract:【Objective】Pathogen of withe eye disease in Mauremys mutica and its drug sensitivity characteristics were confirmed in order to provide reference for prevention and control of the disease. 【Method】Sterile anatomy, streak culture, isolation and selection were applied on M. muticas with withe eye disease. Cultural characteristics and physiological and biochemical characteristics of the isolated strains were identified, 16S rDNA sequence analysis and homology comparison were conducted. Pathogenicity was identified through animal pathogenic experiment and drug resistance was identified through drug sensitivity test. 【Result】A dominant strain was isolated from liver, lung and spleen of M. mutica with withe eye disease, which was strongly pathogenic to mice and M. mutica. The isolated strain was identified to be a gram-negative bacillus with facultative anaerobic, acidogenicity, aerogenesis, fermentation and no exercise ability. The 16S rDNA sequences of the isolated strain(GenBank accession number: KU855372) and that of Klebsiella pneumoniae had 99.1% homology. The isolated strain was hypersensitive to enrofloxacin, cephalothin, cefotaxime and ofloxacin, but showed drug resistance to streptomycin, neomycin, penicillin, kanamycin, tetracycline, clindamycin, doxycycline, amoxicillin and compound sulfamethoxazole. 【Conclusion】K. pneumoniae is one of the main pathogenic bacteria causing withe eye disease of M. mutica. Quinolone and cephalosporin analogues such as enrofloxacin, ofloxacin cephalothin and cefotaxime can be used to prevent and control the disease.
Key words: Mauremys mutica; withe eye disease; isolation; identification; drug sensitivity test
0 引言
【研究意義】黄喉拟水龟(Mauremys mutica)隶属于龟鳖目淡水龟科,自然分布于越南、日本及我国的东部和南部等地,是具有较高经济价值的拟水龟品种之一(赵忠添等,2007)。黄喉拟水龟在稚龟阶段极易发生白眼病,其临床症状主要表现为眼部发炎充血、眼睛肿大、眼睛外表有黄白色分泌物,病龟精神不振、反应迟顿,不时用前肢抓挠眼部,常浮在水面、张口呼吸,嘴角流出黏液等。由于病龟长期不摄食,加上体内器官受病菌感染,最终衰竭死亡(赵忠添,2006),给黄喉拟水龟养殖业带来极大的经济损失。【前人研究进展】目前,有关龟鳖类白眼病的研究报道较少,对其病原菌的鉴定结果也各不相同。伍惠生(2001)推测乌龟眼部受细菌感染可导致白眼病,使用呋喃类、红霉素等药物进行防治有一定效果;章剑(2001)初步鉴定鳄龟白眼病的病原为枯草芽胞杆菌(Bacillus subtilis);于清泉(2003)研究发现,在龟白眼病初期可选用利福平眼药水滴眼、麦迪霉素片拌料或链霉素腹腔注射,均可获得良好的防效;赵忠添(2006)对黄喉拟水龟白眼病进行防治初探,发现链霉素、罗红霉素等抗菌素对黄喉拟水龟白眼病治疗有一定作用;万辑(2007)研究表明,七彩龟白眼病是由细菌感染引起,但未明确具体病原菌;杨瑞婷(2014)研究发现巴西龟白眼病的病原菌主要是革兰氏阴性菌,与巴西龟肠道菌群检出情况相似;李建华和胡大胜(2014)在对广西拟水龟幼龟白眼病进行诊断时,确诊其病原菌为嗜水气单胞菌(Aeromonas hydrophila)。【本研究切入点】实际生产发现,白眼病对12~30 g的稚龟有较强传染性,病情发展迅速,若处理不当死亡率可达20%~50%,但至今除了赵忠添(2006)对黄喉拟水龟白眼病进行防治初探外,未见其他相关研究报道。【拟解决的关键问题】对患白眼病的黄喉拟水龟进行无菌解剖和病原分离,经细菌培养特征、生理生化试验、16S rDNA序列分析及动物致病性试验鉴定其病原菌,并通过药敏试验分析病原菌的药物敏感性,以期为黄喉拟水龟白眼病的防治提供参考依据。
1 材料与方法
1. 1 试验材料
患白眼病黄喉拟水龟采自南宁市某龟鳖养殖场,健康黄喉拟水龟稚龟(10~30 g)由广西水产科学研究院那马基地提供,4周龄健康小白鼠购自广西医科大学实验动物中心。普通琼脂培养基、LB培养基在实验室配制;血琼脂培养基购自郑州安图生物工程股份有限公司;微量生化反应管、药敏纸片购自上海金穗生物科技有限公司;Ex-Taq、pMD18-T载体购自宝生物工程(大连)有限公司;胶回收试剂盒、质粒回收试剂盒购自天根生化科技(北京)有限公司。
1. 2 细菌分离培养及理化鉴定
无菌剖检病龟,用接种环在其肝脏、肺脏、脾脏等组织上取样接种于普通琼脂培养基和血琼脂培养基,37 ℃恒温培养18 h。挑选单个菌落接种于LB培养基,37 ℃纯化培育16 h。纯化的细菌经革兰氏染色后,于显微镜下进行观察,细菌鞭毛用硝酸盐染色。同时对细菌进行葡萄糖、乳糖、麦芽糖、甘露醇、蔗糖、M.R.、V-P、硫化氢、枸橼酸盐、吲哚、硝酸盐、明胶、硫化氢、鸟氨酸脱羧酶、动力试验等生理生化鉴定,具体操作参照东秀珠和蔡妙英(2001)的方法。
1. 3 动物试验
将分离纯化后的菌株接种于新鲜普通琼脂培养基上,37 ℃培养16 h后用无菌生理盐水进行稀释,采用比浊法进行计数,将菌悬液稀释为1×108 CFU/mL。选用4周龄健康小白鼠和健康黄喉拟水龟稚龟进行动物试验,其中,小白鼠试验分别设试验组(15只)和对照组(15只),试验组经小白鼠腹腔注射菌悬液100 μL/只,对照组腹腔注射等量生理盐水;黄喉拟水龟试验也设试验组(9只)和对照组(9只),试验组稚龟经腹腔注射菌悬液100 μL/只,对照组腹腔注射等量生理盐水。试验组和对照组动物在同一环境下养殖,每天观察小白鼠和黄喉拟水龟的发病、死亡情况,连续观察10 d,并对死亡的试验动物进行剖检和病原菌分离鉴定。
1. 4 16S rDNA序列分析
分离菌株经37 ℃摇床(200 r/min)培养16 h后,取1.5 mL于4 ℃下12000 r/min离心1 min,抽提细菌总DNA。PCR反应体系50.0 μL,其中10×PCR Buffer 5.0 μL,dNTP 2.0 μL,上游引物16S-F(5'-AGAGTTTGAT
CMTGGCTCAG-3')1.0 μL,下游引物16S-R(5'-TACG
GYTACCTTGTTACGACTT-3')1.0 μL,Ex-Taq 1.0 μL,DNA模板1.0 μL,ddH2O 39.0 μL。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,进行35个循环;72 ℃延伸10 min,预扩增片段1501 bp。PCR产物进行琼脂糖凝胶电泳检测,经凝胶回收试剂盒纯化回收后连接至pMD18-T载体,再转化DH5α感受态细胞。挑选阳性克隆送至北京六合华大基因科技有限公司进行测序,测序结果在NCBI中进行BLAST比对分析,并用MAGE 5.0构建系统发育进化树。
1. 5 药敏试验
将分离纯化的菌株涂布在普通琼脂培养基上,然后分别贴上药敏纸片,37 ℃恒温培养24 h后测量各抗菌药的抑菌圈直径,评判分离菌株的药物敏感性。
2 结果与分析
2. 1 黄喉拟水龟白眼病的临床症状及其病理变化
黄喉拟水龟白眼病的临床症状主要表现为眼睛发炎、肿大、充血,眼睑黏膜糜烂、眼睛外表覆盖黄白色分泌物(图1);病情严重时鼻子及嘴巴黏膜溃烂、不时有黏液流出,张口呼吸。其剖检病理变化表现为肝脏有针状出血、瘀血,严重时有大块瘀血斑;肺部有积液、充血,或有较多气泡,咽喉红肿充血。
2. 2 分离菌株的形态学及生理生化鉴定结果
分离菌株在普通琼脂培养基上生长成浅白色、透明、圆形凸起、边缘光滑的菌落,菌落直径0.4~1.5 mm。分离菌株为革兰氏阴性杆菌,菌体两端顿圆,呈单个或短链状排列(图2)。对分离菌株进行生理生化鉴定,结果显示该菌表现为兼性厌氧、产酸、产气、发酵型、无运动能力的革兰氏阴性杆菌(表1),与肺炎克雷伯菌(Klebsiella pneumoniae)的生理生化特性高度相似。
2. 3 分离菌株的动物致病性试验结果
小白鼠人工感染试验结果表明,小白鼠在注射接种菌悬液后10 h开始发病,24 h内全部死亡。黄喉拟水龟人工感染试验结果表明,黄喉拟水龟在注射接种菌悬液后24 h开始发病,病龟表现出精神萎靡不振、反应迟顿、呼吸困难、眼部发炎充血等症状,从第2 d开始有病龟死亡,至第7 d试验组黄喉拟水龟全部死亡;剖检发现,其病理变化表现为肝脏肿胀、有出血点,脾脏肿大,肺脏充血水肿。对照组的小白鼠和黄喉拟水龟均未发病或死亡。从发病死亡小白鼠、黄喉拟水龟的肺脏和肝脏均能分离获得与接种菌株一致的病原菌。
2. 4 分离菌的16S rDNA扩增及测序分析结果
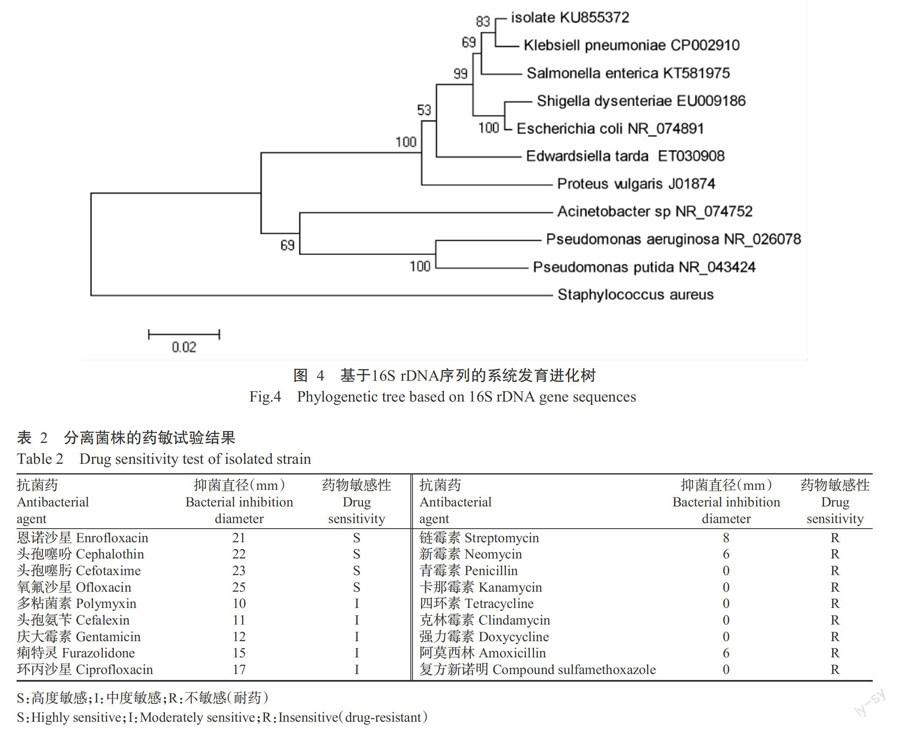
PCR扩增分离菌株的16S rDNA,琼脂糖凝胶电泳检测结果显示,扩增片段约1500 bp(图3),与预期结果一致。将纯化回收的目的片段送至北京六合华大基因科技有限公司进行测序,其GenBank登录号为KU855372。将分离菌株的16S rDNA序列与GenBank已知菌株的16S rDNA进行比对,发现分离菌株与肺炎克雷伯菌的同源性最高,为99.1%。用MAGE 5.0构建基于16S rDNA序列的肠杆菌科及革兰氏阴性菌系统发育进化树,发现分离菌株与肺炎克雷伯菌同属于一个群体(图4),即确定分离菌株为肺炎克雷伯菌。
2. 5 药敏试验结果
药敏试驗结果表明,分离菌株对恩诺沙星、头孢噻吩、头孢噻肟、氧氟沙星等高度敏感,对多粘菌素、痢特灵、头孢氨苄、庆大霉素、痢特灵、环丙沙星等中度敏感,对链霉素、新霉素、青霉素、卡那霉素、四环素、克林霉素、强力霉素、阿莫西林、复方新诺明等已产生耐药性(表2)。
3 讨论
肺炎克雷伯菌为革兰氏阴性菌,隶属于肠杆菌科(Enterobacteriaceae)克雷伯菌属(Klebsiella),通常寄生于动物呼吸道和肠道内,对动物有强致病性(Brisse and Duijkeren,2005;贾艳等,2006)。目前,已从多种哺乳动物及水生动物中分离获得肺炎克雷伯菌,其病理变化主要集中在肝脏、肺脏、呼吸道及肠道。徐海圣和舒妙安(2002)从患病中华鳖的病料中分离获得肺炎克雷伯菌,其病理变化为全身浮肿、腹腔内有积液,肝脏呈花斑状,肺部充血发黑。本研究从患白眼病黄喉拟水龟的肝脏、肺脏和脾脏中分离获得一株优势菌株,其培养特性、生理生化鉴定结果初步确定为肺炎克雷伯菌;将分离菌株的16S rDNA序列与肺炎克雷伯菌进行比对,发现二者的同源性为99.1%;由基于16S rDNA序列的肠杆菌科及革兰氏阴性菌系统发育进化树也发现分离菌株与肺炎克雷伯菌同属于一个群体,即确定分离菌株为肺炎克雷伯菌。本研究剖检发现患白眼病黄喉拟水龟的主要病理变化为肝脏、肺脏和呼吸道损伤,与赵忠添(2006)、李建华和胡大胜(2014)的剖检结果相似,在病情严重时才表现出眼部感染发炎,即肺脏、肝脏受损才是患白眼病龟鳖死亡的主要原因。
本研究的药敏试验结果表明,从患白眼病黄喉拟水龟肝脏、肺脏及脾脏中分离获得的肺炎克雷伯菌对链霉素、新霉素、青霉素、卡那霉素、四环素、克林霉素、强力霉素、阿莫西林、复方新诺明等已产生耐药性,可能与肺炎克雷伯菌的广泛耐药性有密切关系。刘保光等(2014)研究表明,β-内酰胺类抗生素是治疗肺炎克雷伯菌感染的有效药物,但随着β-内酰胺类抗生素在临床治疗中的大量应用,导致细菌产生β-内酰胺酶,致使肺炎克雷伯菌耐药性逐年提高。林星宇等(2015)研究发现,猪源肺炎克雷伯菌对青霉素类及青霉素类复合制剂不敏感,且对部分头孢类抗生素表现出低程度耐药,表明其可能含有β-内酰胺酶,产生了耐药性。因此,在黄喉拟水龟白眼病的防治中应引起高度重视,必须始终贯彻以防为主的指导思想,从正规良种场购买或引进优质种苗;养殖过程中注意环境卫生、控制养殖密度,采取仿生态养殖模式;治疗时应根据药敏试验结果科学用药,减少广谱抗生素的使用,避免产生耐药性。
4 结论
肺炎克雷伯菌是引起黄喉拟水龟白眼病的主要病原菌,生产中可选用恩诺沙星、氧氟沙星等沙星类或头孢噻吩、头孢噻肟等头孢类药物进行防治。
参考文献:
东秀珠,蔡妙英. 2001. 常见细菌系统鉴定手册[M]. 北京:科学出版社:349-398.
Dong X Z,Cai M Y. 2001. Identification of Common Bacteria Systems[M]. Beijing:Science Press:349-398.
贾艳,孙长江,韩文瑜,何礼洋,杨洋. 2006. 肺炎克雷伯菌研究进展[J]. 微生物学杂志,26(5):75-78.
Jia Y,Sun C J,Han W Y,He L Y,Yang Y. 2006. Progress in Klebsiella pneumoniae[J]. Journal of Microbiology,26(5):75-78.
李健华,胡大胜. 2014. 一例广西拟水龟幼龟白眼病的诊断分析[J]. 海洋与渔业,(6):63-64.
Li J H,Hu D S. 2014. A diagnostic analysis on young Mauremys guangxiensis with withe eye disease in Guangxi[J]. Ocean & Fishery,(6):63-64.
林星宇,王印,杨泽晓,姚学萍,胡凌,彭善珍,陈平,邬旭龙. 2015. 猪源肺炎克雷伯菌的分离鉴定[J]. 中国预防兽医学报,37(5):375-378.
Lin X Y,Wang Y,Yang Z X,Yao X P,Hu L,Peng S Z,Chen P,Wu X L. 2015. Isolation and identification of Klebsiella pneumoniae from swine[J]. Chinese Journal of Preventive Veterinary Medicine,37(5):375-378.
刘保光,吴华,张萍英. 2014. 肺炎克雷伯菌耐药研究进展[J]. 畜牧与兽医,46(2):108-111.
Liu B G,Wu H,Zhang P Y. 2014. Drug resistance research progress of Klebsiella pneumoniae[J]. Animal Husbandry & Veterinary Medicine,46(2):108-111.
万辑. 2007. 七彩龟白眼病的防治[J]. 水利渔业,27(1):67.
Wan J. 2007. Prevention and control of withe eye disease in Trachemys scripta elegans[J]. Reservoir Fisheries,27(1):67.
伍惠生. 2001. 龟鳖类的白眼病及其防治的新进展[J]. 河南水产,(1):9-10.
Wu H S. 2001. New progress of prevention and treatment of white eye disease in testudinate[J]. Henan Fisheries,(1):9-10.
徐海圣,舒妙安. 2002. 中華鳖肺炎克雷伯氏菌病的病原研究[J]. 浙江大学学报(理学版),29(6):702-706.
Xu H S,Shu M A. 2002. Studies on the pathogens of the Klebsiella pneumoniae disease of Trionyx sinensis[J]. Journal of Zhejiang University(Science Edition),29(6):702-706.
杨瑞婷. 2014. 巴西龟白眼病病原的鉴别[J]. 养殖技术顾问,(9):81.
Yang R T. 2014. Pathogenic identification of withe eye disease in Trachemys scripta elegans[J]. Technical Advisor for Animal Husbandry,(9):81.
于清泉. 2003. 龟白眼病及防治方法[J]. 齊鲁渔业,20(9):21.
Yu Q Q. 2003. Prevention and control methods for turtle withe eye disease[J]. Shandong Fisheries,20(9):21.
章剑. 2001. 鳄龟白眼病防治[J]. 内陆水产,(2):36.
Zhang J. 2001. Prevention and control of withe eye disease in Chelydra sertentina[J]. Inland Fisheries,(2):36.
赵忠添. 2006. 黄喉拟水龟“白眼病”防治初探[J]. 江西水产科技,(4):44-46.
Zhao Z T. 2006. Prevention and control of withe eye disease in Mauremys mutica[J]. Jiangxi Fishery Sciences and Technology,(4):44-46.
赵忠添,施军,李青. 2007. 黄喉拟水龟人工繁殖技术[J]. 广西农业科学,38(3):326-329.
Zhao Z T,Shi J,Li Q. 2007. Artificial propagation technology for Mauremys mutica[J]. Guangxi Agricultural Sciences,38(3):326-329.
Brisse S,Duijkeren Ev. 2005. Identification and antimicrobial susceptibility of 100 Klebsiella animal clinical isolates[J]. Veterinary Microbiology,105(3-4):307-312.
(责任编辑 兰宗宝)
