兴义维蚋蚋卵(胚胎)原代细胞培养及鉴定
2016-05-30周静刘占钰徐旭崔立秋吴慧陈汉彬杨明
周静 刘占钰 徐旭 崔立秋 吴慧 陈汉彬 杨明

摘要:【目的】筛选出最适宜兴义维蚋蚋卵(胚胎)原代细胞的培养条件和最佳培养基组合,并对其原代细胞进行鉴定,为蚋类细胞系的建立打下基础。【方法】采用组织块和单细胞法对兴义维蚋蚋卵(胚胎)进行原代细胞培养,分析培养基、温度、pH、CO2和培养器皿对细胞培养的影响;并测定蚋卵(胚胎)及原代细胞的rDNA-ITS区序列,通过构建基于ITS区序列的蚋类系统发育进化树鉴定其种属来源。【结果】兴义维蚋蚋卵(胚胎)原代细胞最适宜的培养方法为组织块法,培养基为改良型Shields and Sang M3,pH 6.0~6.5,培养温度28 ℃,恒温生化培养箱和5% CO2培养箱对原代细胞培养无明显差异,培养器皿为经多聚赖氨酸(PLL)处理的一次性塑料培养皿/板。由基于ITS区序列构建的蚋类系统发育进化树可知,蚋卵(胚胎)及其原代培养细胞均来源于兴义维蚋。【结论】成功建立的兴义维蚋蚋卵(胚胎)原代细胞培养方法可在科研生产中进一步推广应用。
关键词: 兴义维蚋;蚋卵(胚胎);原代细胞;培养;鉴定
中图分类号: S852.743 文献标志码:A 文章编号:2095-1191(2016)11-1945-07
Abstract:【Objective】The present study was conducted to select the most suitable culture conditions and optimal culture media for culturing primary cells of eggs(embryos) in Simulium(Wilhelmia) xingyiense, and identify the primary cells in order to lay a foundation for establishment of blackfly cell lines. 【Method】Primary cells of eggs(embryos) in S.(W.) xingyiense were cultured using tissue block method and single cell method. The influence factors for cell culture were analyzed, including medium, temperature, pH value, CO2 and culture vessels. At the same time, the sequences of rDNA-ITS region of eggs(embryos) and primary cells were determined, and blackfly phylogenetic tree was established based on their ITS sequences to identify their species origin. 【Result】The tissue block method was the optimal culture method for culturing the primary cells of eggs(embryos) in S.(W.) xingyiense. The appropriate culture medium was modified Shields and Sang M3 with pH 6.0-6.5 and 28 ℃ culture temperature. Constant temperature biochemical incubator and 5% CO2 incubator made no significant differences on culturing primary cells. Poly-L-lysine(PLL) treated plastic petri dishes/plates could be used as culture vessels. The result of blackfly phylogenetic tree based on ITS sequences showed that blackfly eggs(embryos) and their primary cells were derived from S.(W.) xingyiense. 【Conclusion】The culture method for primary cells of eggs(embryos) in S.(W.) xingyiense successfully established can be further applied in scientific research and production.
Key words: Simulium(Wilhelmia) xingyiense; blackfly egg(embryo); primary cell; culture; identification
0 引言
【研究意义】昆虫细胞培养是细胞工程研究的基本技术之一,已成为现代实验生物学的重要研究手段(李守信等,2005)。昆蟲细胞培养来源于不同组织,并广泛应用于医学、遗传学及生物学等研究领域(Smagghe et al.,2009),是研究昆虫生理生化、生物反应器及表达基因产物等的重要材料(Reid et al.,2016)。蚋类俗称黑蝇(Blackfly),隶属于昆虫纲(Insecta)双翅目(Diptera)蚋科(Simuliidae),是人类和畜禽多种疾病(盘尾丝虫病、禽鸟住白细胞虫病)的传播媒介,对家畜的危害尤为严重,轻者引发变态反应,造成肉、乳产量下降,重者可导致家畜死亡,影响社会公共卫生(陈汉彬等,2016)。因此,加强蚋类细胞培养体系研究,对了解蚋类生态习性及其生物防治具有重要意义。【前人研究进展】迄今为止,世界范围内已建成800多株昆虫细胞系,包括黑腹果蝇细胞系(BSR-9840)、白纹伊蚊细胞系(Aa-778)和嗜人按蚊细胞系(Ana-104)等,这些细胞系主要来源于双翅目和鳞翅目昆虫(张寰等,2007)。昆虫细胞系已广泛应用于病毒传播和疾病治疗等领域的基础与应用研究,如果蝇和白纹伊蚊细胞系已用于研究Sindbis病毒与细胞间的交互作用(Mudiganti et al.,2006;唐芬芬等,2015;Roest et al.,2016);蜜蜂、蚊类昆虫细胞系主要用于研究我国蝙蝠科病毒、虾黄头病毒及登革热病毒的传播途径(Gangnonngiw et al.,2010;Xia et al.,2014;Yang et al.,2015)。此外,昆虫细胞系可用于研究信号转导通路或作为生物反应器生产疫苗(Mena and Kamen,2011;Shilo,2016),或用于筛选新型化学杀虫剂(Smagghe et al.,2009)及研究溴氰菊酯农药抗性基因(Chi et al.,2016)。【本研究切入点】目前,蚋类研究主要集中在形态和分子水平(杨明等,2004;徐旭等,2012;陈汉彬等,2016),尚无针对蚋类细胞培养的研究报道。【拟解决的关键问题】以贵州省贵阳市郊区兴义维蚋[Simulium(Wilhelmia) xingyiense]蚋卵(胚胎)为材料,筛选出最适宜兴义维蚋蚋卵(胚胎)原代细胞的培养条件和最佳培养基组合,并对其原代细胞进行鉴定,以期为蚋类细胞系的建立打下基础。
1 材料与方法
1. 1 试验材料
试验在贵州医科大学分子生物学重点实验室进行。供试材料为蚋卵前幼虫期胚胎(肉眼观察为棕黑色,显微镜下通过透明卵壳可见红眼点出现,破卵器形成)(陈汉彬等,2016),采自贵州省贵阳市郊区。
1. 2 试验方法
1. 2. 1 原代细胞培养 筛选野外采集的兴义维蚋蚋卵(胚胎),经70%乙醇→1%过氧乙酸→2.8% NaClO消毒处理(周静等,2010)。选取Graces、Schneiders和Shields and Sang M3为基本培养基,并在Shields and Sang M3中添加5 mg/L胰岛素作为改良型Shields and Sang M3培养基,然后分别加入20% FBS和抗生素混合液(500 U/mL青霉素、500 mg/mL硫酸链霉素和12.5 mg/mL两性霉素B)。
1. 2. 2 原代细胞培养条件优化 在生化培养箱和5% CO2培养箱中,设定细胞培养温度为26、28和30 ℃,培养基pH调节至6.2、6.5和6.8,分别在经0.1%多聚赖氨酸(PLL)包被处理的玻璃培养瓶和塑料培养皿中培养,并设未经PLL包被处理的培养器皿为阴性对照。
1. 2. 3 原代细胞培养方法建立 分别以组织块法和单细胞法进行蚋卵胚胎组织处理。组织块法是经眼科剪剪碎胚胎、纱布过滤后获得的大量细小组织和少量细胞;单细胞法是在冰上匀浆胚胎组织块,并用0.25%胰蛋白酶消化处理后,按1×105个/mL接种细胞(Xu et al.,2015)。
1. 2. 4 原代细胞培养观察 根据细胞生长情况,分别进行1/2、1/3和1/4部分换液,倒置显微镜下定期观察组织细胞贴壁情况及细胞迁移增殖生长状态,应用显微测微尺测量细胞大小,并进行拍照分析。
1. 3 蚋卵(胚胎)及原代培养细胞种属鉴定
1. 3. 1 rDNA-ITS序列扩增 采用基因组抽提试剂盒从用于原代细胞培养的卵筏上剩余卵块提取蚋卵(胚胎)基因组DNA,而原代培养细胞需重悬于200 μL PBS中后,再以基因组抽提试剂盒提取原代细胞基因组DNA。采用本课题组自行设计的引物PCX1(5'-GTTGACCGAACTTGATGATTTAGAG-3')和 PCX4
(5'-GGGTAGTCACACATTATTTGAGGC-3')进行PCR扩增,扩增程序:94 ℃预变性7 min;94 ℃ 1 min,58 ℃ 1 min,72 ℃ 2 min,进行35个循环;72 ℃延伸5 min。对PCR产物进行纯化及鉴定,挑选阳性克隆菌株送至南京金思瑞科技公司进行测序。
1. 3. 2 序列分析构建 基于蚋类ITS区序列构建系统发育进化树,包含148条序列。其中,待鉴定序列11条,本课题组已测定的蚋科2属8亚属16种114条序列,GenBank中的蚋科5属9亚属20种23条序列。每条序列均为完整的rDNA-ITS区,包含ITS1、5.8S和ITS2。采用ClustalX 1.83进行多重序列比对,并以MEGA 4.0中的邻接法(Neighbor-joining method,NJ)和最大简约法(Maximum parsimony method,MP)构建系统发育进化树,以鉴定蚋(卵)胚胎及原代培养细胞的种属来源。
2 结果与分析
2. 1 原代细胞培养材料
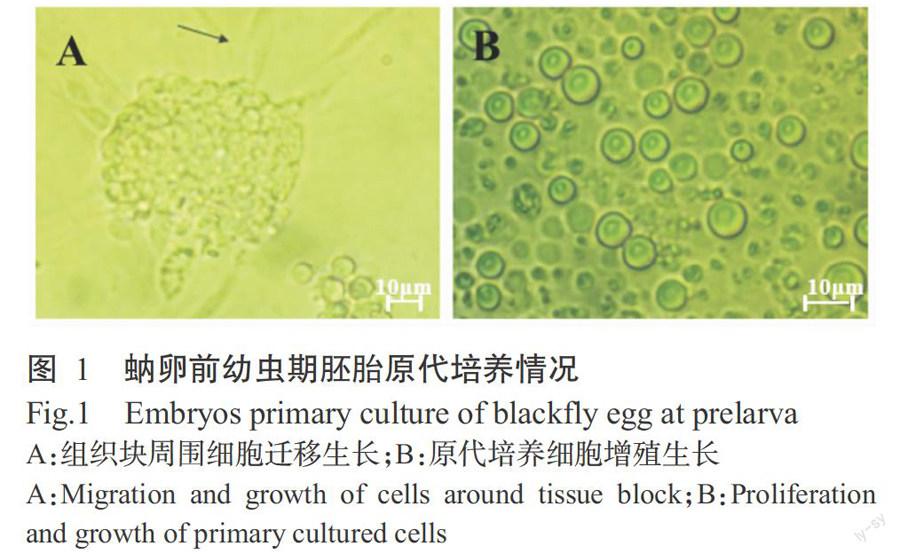
原代細胞培养材料为蚋卵前幼虫期胚胎,其培养过程中可观察到胚胎组织块周围有多种细胞迁移和生长(图1-A),并可见多个圆形细胞分裂增殖(图1-B)。初步证实蚋卵前幼虫期胚胎可作为蚋类原代细胞培养材料来源,但其建系能力有待下一步研究验证。
2. 2 原代细胞培养影响因素筛选结果
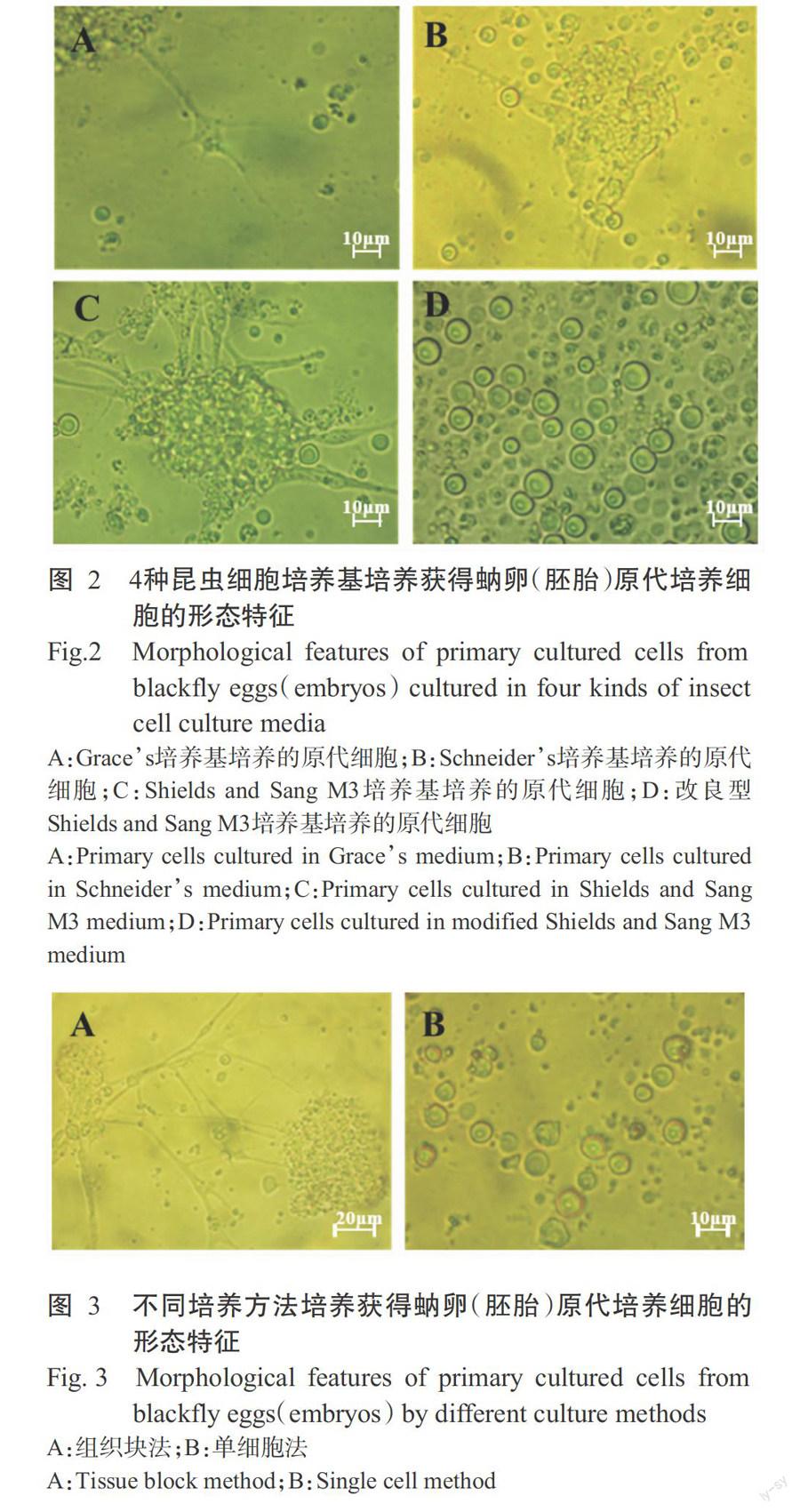
2. 2. 1 原代细胞培养基筛选 培养4周后,发现蚋卵(胚胎)组织细胞在Graces、Schneiders、Shields and Sang M3及改良型Shields and Sang M3培养基中均有细胞迁移生长(表1)。其中,在Graces培养基中只有极少量的组织块贴壁,少量细胞迁移生长(图2-A);在Schneiders培养基中,部分组织块贴壁,少量细胞迁移生长(图2-B);在Shields and Sang M3和改良型Shields and Sang M3培养基中,培养2~3 d后贴壁组织块周围细胞呈拉网树枝样迁移生长,细胞种类数量较多,形态规则,折光性较好,表现出较好的生长势(图2-C,图2-D);尤其在改良型Shields and Sang M3培养基中,于培养2周后每日对3个视野的100个细胞分别进行计数,连续观察3 d,发现其平均增殖率约20%。可见,改良型Shields and Sang M3培养基更适合蚋卵胚胎原代细胞培养。
2. 2. 2 原代细胞培养方法筛选 组织块法培养12 h后可见大量组织块贴壁(图3-A),各种不同类型的细胞逐渐从贴壁组织块周围迁移生长,3~4 d呈拉网树枝样生长,组织块周围还可见多个圆形脱落细胞,继续培养2~3 d后可见部分细胞分裂增殖。单细胞培养法培养获得的细胞以圆形细胞为主,形态较单一,细胞大小不一(图3-B);部分细胞培养24 h后为半贴壁生长,轻摇易动,其余细胞悬浮于培养液中生长,可见细胞碎片悬浮于培养液中;随着培养时间的延长,细胞形态不规则、折光性变差、细胞增殖生长不明显,逐渐死亡。因此,确定蚋卵(胚胎)组织原代细胞培养宜采用组织块法。
2. 2. 3 原代细胞培养条件筛选 蚋卵(胚胎)组织细胞在恒温生化培养箱和5% CO2培养箱中均可生长、繁殖,在原代细胞培养阶段无明显差异。在28 ℃培养温度条件下,组织块贴壁后即有细胞迁移,2~3 d可见组织块周围细胞呈拉网状生长(图4-A);培养温度降至26 ℃时细胞迁移时间推迟;培养温度上升至30 ℃时原代细胞出现胞质皱缩现象,细胞生长状态不佳(图4-B)。原代培养细胞在pH 6.2~6.5内生长状态较好(图4-C),但培养基pH超过6.5后,随着培养时间的推移,培养基中极易出现结晶体,细胞逐渐消亡(图4-D)。在经PLL预处理的塑料培养皿中,培养1~2 d开始有大量组织块贴壁,并有多种细胞迁移生长(图4-E);而在未经PLL处理的塑料培养皿及玻璃培养瓶中仅有少量组织细胞贴壁,较少细胞迁移生长(图4-F);培养液中的悬浮组织块不利于细胞脱落和迁移生长。
2. 3 原代培养细胞的形态特征
蚋卵(胚胎)组织细胞培养40 d后,可观察到组织块周围迁移出各种形状的蚋卵(胚胎)原代细胞。根据细胞形态学特征可初步分为:神经元样细胞(图5-A)、肌肉样细胞(图5-B)、肌管样细胞(图5-C)、上皮样细胞(图5-D)、巨噬样细胞(图5-E)和圆形/卵圆形细胞(图5-F)。在细胞培养过程中增殖较明显的是组织块周围脱落的圆形/卵圆形细胞,增殖率约20%(表1)。
2. 4 蚋卵(胚胎)组织及原代培养细胞的种属鉴定结果
2. 4. 1 PCR扩增及验证结果 用引物对PCX1/PCX4扩增6个蚋卵(胚胎)组织样本及5个原代细胞样本,均能获得预期大小的目的片段。将目的片段纯化后克隆,利用载体特异引物进行PCR验证,可获得1000 bp的片段(图6),每个样本挑取2~3个阳性克隆送至南京金思瑞科技生物公司测序,其序列比对结果显示蚋卵(胚胎)组织样本及原代细胞的11条序列均为蚋类特异基因,可用于构建系统发育进化树分析。
2. 4. 2 系统发育进化树分析序列结果 通过对比基于ITS区序列构建的NJ树和MP树,发现两者在各类群系统发育关系上基本一致,尤其是待鉴别的6个蚋卵(胚胎)组织序列(zj-B1-6、zj-B1-1、zj-2-3、zj-1-4、zj-2-2和zj-B2-1)和5个原代培养细胞序列(zj-1-3、zj-1-2、zj-B1-8、zj-2-1和zj-B2-7)在两个系统发育进化树中的归属相同。从图7可看出,待鉴别的6个蚋卵(胚胎)组织序列和5个原代培养细胞序列明确归属于兴义维蚋一枝,即可确定待鉴别的蚋卵(胚胎)及其原代培养细胞均来源于兴义维蚋。
3 讨论
蚋类细胞系的建立可为从细胞水平上研究蚋类的生理生化特性及其病毒学、免疫学、遗传学和新型农药研制等提供有效的技术手段。目前,已建立的800多种昆虫细胞系主要来源于鳞翅目和双翅目(张寰等,2007)。双翅目中,以果蝇建立的细胞系最多、应用最广(Cross and Sang,1978),但迄今未见成功建立蚋类细胞系的研究报道。已建立的昆虫细胞系母细胞50%以上来自昆虫的胚胎、初孵幼虫(张寰等,2007)。本研究选用野外采集的蚋卵(胚胎)作为培养材料,并将其置于蚋类槽式饲养系统中发育至蚋卵前幼虫期胚胎,再用于蚋卵(胚胎)原代细胞培养。蚋类细胞培养具有以下特点:(1)野外采集的各时期胚胎样本中,可鉴别的蚋卵前幼虫期胚胎保证了培养材料来源的一致性。(2)胚胎发育时间越短,细胞增殖能力越强,但对消毒剂耐受力较差,不利于细胞系建立。野外采集样本需经多种消毒剂处理,蚋卵前幼虫期胚胎既保留了胚胎组织增殖潜能,又可有效抵抗多种消毒剂。(3)在原代培养过程中,蚋卵前幼虫期胚胎组织块周围有大量细胞迁移分化,同时可观察到较多圆形细胞增殖生长。可见,蚋卵前幼虫期胚胎是蚋类细胞系建立的较好组织来源。果蝇、家蚕等也曾应用晚期胚胎成功建立了细胞系(Schneider,1972;Xu et al.,2015)。
适宜的细胞培养基利于细胞增殖与分化。国内外学者已应用Graces、Schneiders和Shields and Sang M3培養基成功建立了果蝇、家蚕等双翅目昆虫细胞系(Schneider,1972)。本研究结果表明,蚋卵(胚胎)组织块在Graces培养基中细胞迁移生长较少,在Schneiders培养基有部分细胞迁移,在Shields and Sang M3培养基中细胞迁移、分化及部分增殖,在改良型Shields and Sang M3培养基中细胞迁移早,增殖率约达20%。对比Shields and Sang M3与Schneiders培养基的组成成分,发现两种培养基氨基酸组成相似,以必需氨基酸和非必需氨基酸为主,氨基酸含量较高,且培养基中均添加了酵母浸出液,作为多种维生素及嘌呤的主要来源;而Graces培养基中无酵母浸出液,但戊糖含量较高。因此,初步推测高含量的氨基酸及多种维生素和嘌呤物质对蚋类细胞培养尤为重要。激素和生长因子是动物细胞培养基中有益的添加剂(Freshney,2014),在Shields and Sang M3培养基中添加胰岛素(改良型Shields and Sang M3培养基)可有效促进葡萄糖和氨基酸的摄入和吸收,以利于细胞生长增殖。
Mitsuhashi(2003)对无脊椎动物细胞培养技术进行总结,认为昆虫细胞可在20~30 ℃范围内生长,适宜的培养基pH在6.4左右,大多数昆虫细胞对于培养基pH波动并不敏感,因而不需要使用CO2培养箱,一般生化培养箱即可达到培养要求。本研究以此培养条件为基准,结合蚋类的生长习性,筛选出兴义维蚋蚋卵(胚胎)原代细胞培养最适宜的培养方法为组织块法,培养基为改良型Shields and Sang M3,pH 6.0~6.5,培养温度28 ℃,有无CO2均可,培养器皿为经PLL处理的一次性塑料培养皿/板。
4 结论
兴义维蚋蚋卵(胚胎)原代细胞培养最适宜的培养方法为组织块法,培养基为改良型Shields and Sang M3,pH 6.0~6.5,培养温度28 ℃,有无CO2均可,培养器皿为经PLL处理的一次性塑料培养皿/板。该培养方法可在科研生产中进一步推广应用,为蚋类细胞系建立打下基础。
参考文献:
陈汉彬,张春林,杨明,温小军,寻慧. 2016. 中国蚋科昆虫[M]. 贵阳:贵州科技出版社:104-108.
Chen H B,Zhang C L,Yang M,Wen X J,Xun H. 2016. Chinese Blackflies(Diptera:Simuliidae)[M]. Guiyang:Guizhou Science and Technology Publishing House:104-108.
李守信,李長友,郑桂玲,周洪旭,吴文君,李国勋. 2005. 昆虫细胞培养研究进展[J]. 西北农业学报,14(3):41-48.
Li S X,Li C Y,Zheng G L,Zhou H X,Wu W J,Li G X. 2005. Progress in insect cell culture[J]. Acta Agriculturae Boreali-occidentalis Sinica,14(3):41-48.
唐芬芬,杨伟克,张永红,朱峰,邵榆岚,白兴荣. 2015. 喂食家蚕核型多角体病毒诱导家蚕抗菌肽基因表达[J]. 南方农业学报,46(12):2191-2195.
Tang F F,Yang W K,Zhang Y H,Zhu F,Shao Y L,Bai X R. 2015. Expression of antimicrobial peptide genes in Bombyxmori induced by feeding B. mori nucleopolyhedrovirus[J]. Journal of Southern Agriculture,46(12):2191-2195.
徐旭,杨明,陈汉彬. 2012. 内蒙古蚋类rDNA-ITS1序列分析[J]. 贵州科学,30(4):25-28.
Xu X,Yang M,Chen H B. 2012. Sequence analysis of rDNA-ITS1 of black flies from Inner Mongolia[J]. Guizhou Science,30(4):25-28.
杨明,毕光辉,陈汉彬. 2004. 五条蚋和双齿蚋nrDNA-ITS区序列分析(双翅目:蚋科)[J]. 寄生虫与医学昆虫学报,11(4):219-222.
Yang M,Bi G H,Chen H B. 2004. Sequences analysis of nuc-
lear ribosomal and ITS region of Simulium quinquestriatum and S. bidentatum(Diptera:Simuliidae)[J]. Acta Parasitologica et Medica Entomologica Sinica,11(4):219-222.
张寰,张永安,秦启联,王玉珠,曲良建,李瑄,苗麟,殷珍仙,张爱君,温发园. 2007. 昆虫细胞系的培养和建立技术[J]. 昆虫学报,50(8):834-839.
Zhang H,Zhang Y A,Qin Q L,Wang Y Z,Qu L J,Li X,Miao L,Yin Z X,Zhang A J,Wen F Y. 2007. Advances in establishment of insect cell lines[J]. Acta Entomologica Sinica,50(8):834-839.
周静,陈汉彬,杨明. 2010. 几种消毒剂对蚋卵原代细胞培养效果的比较[J]. 贵阳医学院学报,35(4):334-340.
Zhou J,Chen H B,Yang M. 2010. Comparison of sterilizing effects of several disinfectants on blackfly eggs in primary cell culture[J]. Journal of Guiyang Medical College,35(4):334-340.
Chi Q,Li F,Liu W,Xu Q,Hu J,Cheng Y,Jing X,Cheng L. 2016. Analysis of UB and L40 resistance related to deltamethrin in Drosophila kc cells[J]. Gene,575(2):399-406.
Cross D P,Sang J H. 1978. Cell culture of individual Drosophila embryos. I. Development of wild-type cultures[J]. Journal of Embryology and Experimental Morphology,45(1):161-172.
Freshney R I. 2014. Culture of Animal cells:A Manual of Basic Technique and Specialized Applications[M]. Wiley-Blackwell.
Gangnonngiw W,Kanthong N,Flegel T W. 2010. Successful propagation of shrimp yellow head virus in immortal mosquito cells[J]. Diseases of Aquatic Organisms,90(1):77-83.
Mena J A,Kamen A A. 2011. Insect cell technology is a versatile and robust vaccine manufacturing platform[J]. Expert Review of Vaccines,10(7):1063-1081.
Mitsuhashi J. 2003. Invertebrate Tissue Culture Methods (Springer Lab Manuals)[M]. Springer:102-114.
Mudiganti U,Hernandez R,Ferreira D,Brown D T. 2006. Sindbis virus infection of two model insect cell systems——A comparative study[J]. Virus Research,122(1-2):28-34.
Reid S,Chan L C,Matindoost L,Pushparajan C,Visnovsky G. 2016. Cell culture for production of insecticidal viruses[J]. Methods in Molecular Biology,1477:95-117.
Roest S,Kapps-Fouthier S,Klopp J,Rieffel S,Gerhartz B,Shrestha B. 2016. Transfection of insect cell in suspension for efficient baculovirus generation[J]. MethodsX,3:371-377.
Schneider I. 1972. Cell lines derived from late embryonic stages of Drosophila melanogaster[J]. Journal of Embryology and Experimental Morphology,27(2):353-365.
Shilo B Z. 2016. New twists in drosophila cell signaling[J]. Journal of Biological Chemistry,291(15):7805-7808.
Smagghe G,Goodman C L,Stanley D. 2009. Insect cell culture and applications to research and pest management[J]. In Vitro Cellular & Developmental Biology,45(3-4):93-105.
Xia X C,Mao Q Z,Wang H T,Zhou B F,Wei T Y. 2014. Replication of Chinese sacbrood virus in primary cell cultures of Asian honeybee(Apis cerana)[J]. Archives of Virology,159(12):3435-3438.
Xu M,Tan J,Wang X,Zhong X,Cui H J. 2015. Establishment and characterization of a new embryoniccell line from the silkworm,Bombyxmori[J]. Invertebrate Survival Journal,12:13-18.
Yang C F,Tu C H,Lo Y P,Cheng C C,Chen W J. 2015. Involvement of tetraspanin C189 in cell-to-cell spreading of the dengue virus in C6/36 cells[J]. PLoS Neglected Tropical Diseases,9(7):e0003885.
(責任编辑 兰宗宝)
