巴西橡胶树膜联蛋白基因家族成员的鉴定和表达分析
2016-05-30肖小虎隋金蕾戚继艳方永军王闯唐朝荣
肖小虎 隋金蕾 戚继艳 方永军 王闯 唐朝荣
摘 要 膜联蛋白是一个多基因家族,在植物逆境胁迫应答和生长发育等方面起重要作用。本研究以已发表的膜联蛋白氨基酸序列为探针,对橡胶树和其他5种植物的转录组和基因组进行搜索,鉴定得到14个橡胶树膜联蛋白基因家族成员,命名为AnnHb1-AnnHb14。基因结构分析发现,14个家族成员的内含子数目为3~6个,结构域的数目为2~4个。在进化上,橡胶树、木薯和蓖麻共3种大戟科植物的膜联蛋白具有较近的亲缘关系。表达方面,AnnHb1在各组织中普遍表达,而AnnHb6和AnnHb7主要在胶乳中表达,AnnHb10、AnnHb8和AnnHb13分别在树叶、树皮和雄花中特异表达,其他成员在各组织中低丰度表达或不表达;部分家族成员的表达还与叶片发育、乙烯利刺激、真菌侵染和低温胁迫等具有一定相关性。
关键词 巴西橡胶树;膜联蛋白;基因家族;结构和进化;表达分析
中图分类号 S794.1 文献标识码 A
膜联蛋白(Annexins)是一类Ca2+及磷脂结合型蛋白,广泛存在于真核生物中,在进化上是相对保守的多基因家族。早期对膜联蛋白的研究主要是针对动物,研究发现膜联蛋白参与调节动物细胞的多种生理生化过程[1-2]。1989年Boustead等[3]首次报道在高等植物中发现了膜联蛋白,随后有关学者陆续从玉米、豌豆、棉花等多种植物中得到了膜联蛋白[4-6]。2000年Hofmann等[7]利用X-射线衍射晶体学及多种生物物理学方法首次阐明了辣椒的Annexin三维结构。研究发现,植物膜联蛋白参与植物分泌作用、胞吐作用和低温信号转导等多种生物学功能[4,5,8]。近年来,随着植物基因组测序的进行,相关学者从多种植物中鉴定出膜联蛋白基因家族成员,并对家族成员的表达进行了分析,如拟南芥、番茄、水稻等[9-11]。但是关于膜联蛋白在橡胶树、木薯等大戟科植物中的研究却未见报道。本研究以已发表的膜联蛋白氨基酸序列为探针,对橡胶树、木薯、蓖麻、拟南芥、杨树和水稻等6种植物的基因组数据进行全面搜索,鉴定得到65个膜联蛋白基因家族成员,其中包括14个橡胶树膜联蛋白基因;并利用相关软件和数据库数据对这些家族成员的基因结构、进化和表达水平进行了系统分析。研究结果将有助于深入了解橡胶树膜联蛋白的生物学功能。
1 材料与方法
1.1 材料
本实验室Solexa测序所用的巴西橡胶树(Hevea brasiliensis)为热研7-33-97,根取自中国热带农业科学院橡胶研究所种质资源圃华玉伟老师赠送的热研7-33-9组培苗,其他组织(包括胶乳、树皮、树叶、种子、雌花和雄花)均取自中国热带农业科学院试验场三队的正常割胶橡胶树(开割2年以上);不同发育时期的橡胶树叶片取自中国热带农业科学院橡胶所种质资源圃一年生的热研7-33-97嫁接苗;乙烯利处理的材料主要取自海南省儋州市中国热带农业科学院试验场三队热研7-33-9正常开割树(3天一刀,不涂乙烯利刺激),用1.5%乙烯利在不同时间处理橡胶树,相应4个处理时间点为0 h、3 h 、12 h和24 h ,具体实验步骤参照肖小虎[12]的方法进行。
网上测序数据来自NCBI SRA数据库(http://www.ncbi.nlm.nih.gov/sra),包括不同组织(PRJNA201084)、真菌侵染(Corynespora cassiicola tolerance,PRJNA179126)、高低温干旱胁迫(PRJNA182078)和乙烯利处理(PRJNA182079)等数据,详细信息参见数据库中实验说明。
1.2 方法
1.2.1 基因家族成员的鉴定与序列分析 为了全面鉴定橡胶树、拟南芥、杨树、水稻、木薯和蓖麻的膜联蛋白基因家族成员,笔者从NCBI(http://www.ncbi.nlm.nih.gov/)和Phytozome(https://phytozome.jgi.doe.gov/pz/portal.html)数据库下载了6种植物的基因组和转录组数据;以已发表的膜联蛋白序列为探针,对6种植物的基因组和转录组进行搜索,得到候选膜联蛋白基因家族成员;利用InterProScan(http://www.ebi.ac.uk/Tools/pfa/iprscan/)对候选基因的结构域进行分析;再利用EMBOSS数据库的在线软件Pepstats(http://www.ebi.ac.uk/Tools/seqstats/emboss_pepstats/)对基因的等电点和分子量进行批量分析。
1.2.2 基因结构与进化分析 利用在线软件GSDS2.0(http://gsds.cbi.pku.edu.cn/)对橡胶树和其他5种植物膜联蛋白基因家族成员的外显子/内含子组织结构进行分析。利用MEGA 6.0软件构建橡胶树和其他5种植物膜联蛋白氨基酸序列的系统发育树,采用Neighbor-Joining方法分析分子系统学,进行1 000次bootstrap统计学检验。
1.2.3 基因的表达模式分析 利用本实验室和NCBI的solexa转录组数据對橡胶树膜联蛋白基因家族成员的表达模式进行分析[13]:首先,将NCBI的SRA数据库(http://www.ncbi.nlm.nih.gov/sra/)中橡胶树相关的solexa转录组数据下载到本地服务器,去除低质量序列,利用程序RSEM进行表达分析[14]。
2 结果与分析
2.1 膜联蛋白基因家族成员的鉴定与序列分析
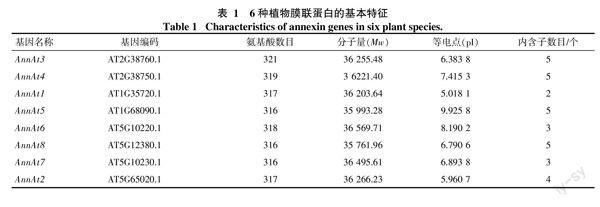
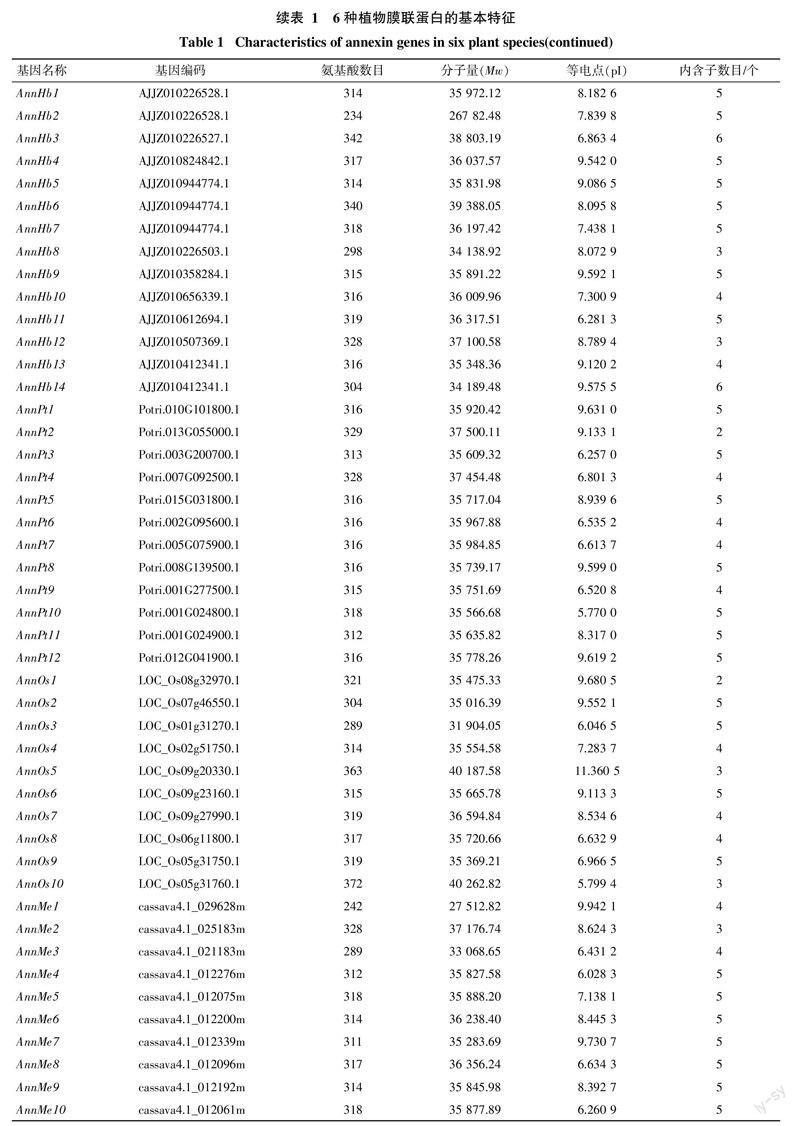
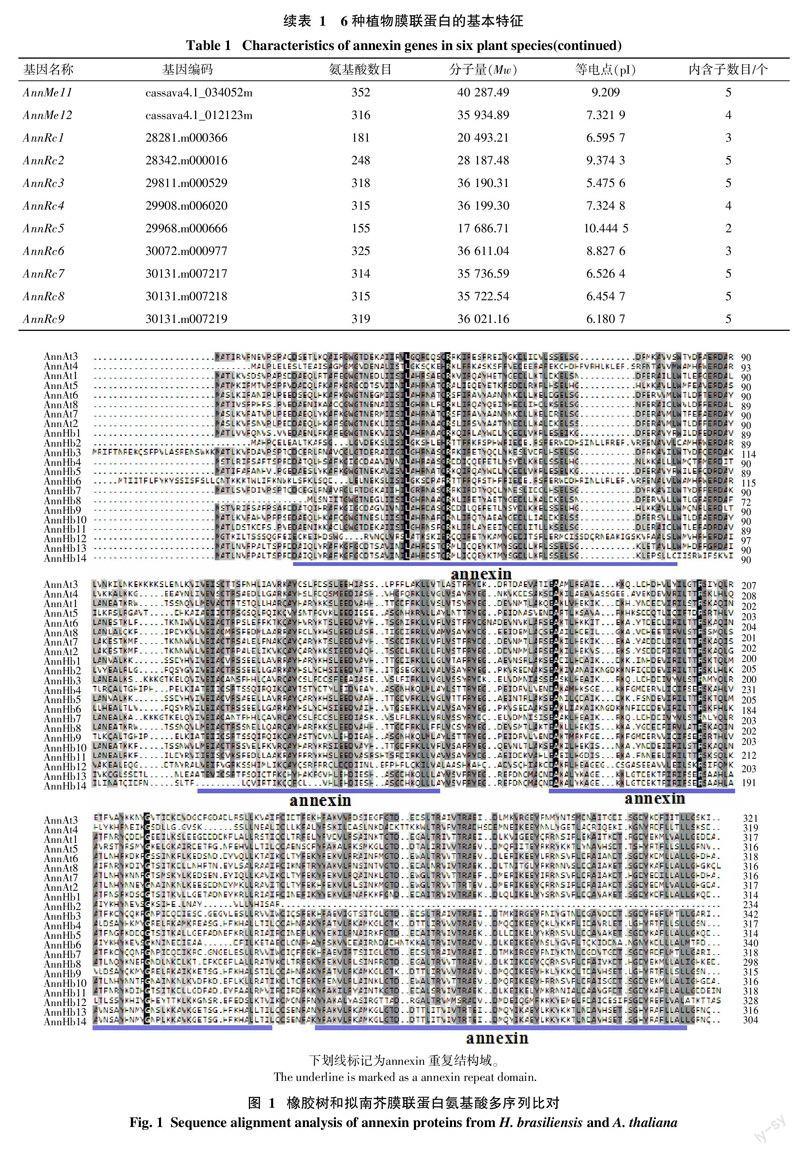
本研究利用tblastn搜索各植物转录组和基因组数据,共鉴定得到了65个膜联蛋白(表1),其中橡胶树14个,命名为AnnHb1~AnnHb14。通过序列分析发现,橡胶树膜联蛋白含234~342个氨基酸,分子量为27~39 ku,等电点在6.3~9.6,内含子数目为3~6个。氨基酸多序列比对发现,橡胶树膜联蛋白含有多个保守结构域(图1)。
2.2 基因结构和进化分析
对橡胶树和其他5种植物annexin基因的外显子/内含子的组织结构以及进化关系进行了分析(图2)。结果发现,同一进化分支上的家族成员在内含子数目和相对位置上以及结构域的相对位置上具有一定的相似性,如AnnMe9、AnnHb5、AnnRc7、AnnHb1、AnnMe6和AnnPt3聚在同一个分支,都含有5个内含子,其内含子和结构域的相对位置都非常一致; 也有一些分支存在较大差异,如AnnOs1和AnnOs6聚在同一个分支,其中AnnOs1仅有2个内含子,而AnnOs6含有5个内含子。在进化上,橡胶树annexin基因主要和木薯、蓖麻annexin基因聚在一起,这与此3种大戟科植物具有较近的亲缘关系的结论一致。
2.3 橡胶树膜联蛋白基因家族成员的表达分析
本实验室Solexa转录组测序数据分析结果表明,AnnHb1在所检测的组织中都普遍表达,在叶片发育过程中呈下调表达,而在乙烯利处理后的不同时间点呈上调表达;AnnHb10主要在叶片中表达,并且在叶片稳定期的表达要高于其他时期;AnnHb6和AnnHb7主要在胶乳中高丰度表达,并且AnnHb7在乙烯利处理后有一定的下调表达趋势;AnnHb8和AnnHb13分别在树皮和雄花中表达;其他家族成员,如AnnHb2、AnnHb3、AnnHb4、AnnHb9、AnnHb11、AnnHb12和AnnHb14在各组织中的表达丰度都很低或不表达(图3)。
转录组数据分析结果(图4)表明,AnnHb1在所分析的各组织中普遍表达,这和本实验室转录组数据的分析结果一致,在真菌C. cassiicola侵染的叶片中AnnHb1上调表达。AnnHb8、AnnHb10、AnnHb6和AnnHb7分别在树皮、树叶和胶乳中高丰度表达,其中AnnHb10在C. cassiicola侵染后下调表达,AnnHb7在乙烯利处理后下调表达。另外,AnnHb2在低温胁迫下呈下调表达,其它基因在所检测样品中低丰度表达或不表达。
从以上2部分实验数据的结果来看,橡胶树膜联蛋白基因家族成员的表达分为3种类型:第一种类型为普遍表达,如AnnHb1在各组织中均有表达,并且表达丰度也较高;第二种类型为组织特异性表达,如AnnHb8、AnnHb10、AnnHb6和AnnHb7分别在树皮、树叶和胶乳中特异表达;第三种类型为低丰度表达或不表达,如AnnHb4、AnnHb9、AnnHb11、AnnHb12等。从分析结果可以看出,橡胶树膜联蛋白的表达与橡胶树的生长发育以及逆境胁迫应答都有一定的相关性。另外,通过对2部分实验的结果进行比较可以看出,2部分实验结果非常一致,这也说明本研究结果的准确性。
3 讨论与结论
早期对膜联蛋白的研究主要集中于动物细胞,研究发现膜联蛋白对动物的分泌过程有一定的调节作用[1]。因而对植物膜联蛋白的研究早期也集中在分泌型细胞,随着功能研究的进行,结果发现膜联蛋白在植物生长发育调控和环境适应方面扮演重要角色。在拟南芥中,膜联蛋白基因家族成员有8个(AnnAt1~AnnAt8),研究发现这些成员在多种胁迫处理下表现出不同的表达模式,大部分基因受盐、干旱、脱落酸(ABA)以及高低温胁迫的诱导[15]。Breton等[16]在耐寒型小麦中发现2种可响应低温胁迫且不依赖于Ca2+的膜联蛋白基因。白杨叶片受低温胁迫可诱导膜联蛋白基因的上调表达[16-17]。利用本实验室和NCBI已有Solexa数据,笔者对14个橡胶树膜联蛋白的表达进行了分析,发现AnnHb1在各组织中普遍表达,推测该基因在进化上功能相对比较保守;AnnHb8、AnnHb10、AnnHb6和AnnHb7呈组织特异性表达,推测这些基因在进化过程中发生变异,在特异组织发挥功能。AnnHb7在乙烯利处理后下调表达,AnnHb1在真菌C. Cassiicola侵染的叶片中上调表达,而AnnHb10在C. Cassiicola侵染后下调表达,AnnHb2在低温胁迫下呈下调表达。从分析结果可以看出,橡胶树膜联蛋白的表达与橡胶树的生长發育以及逆境胁迫应答都有一定的相关性,这与已有研究中所述膜联蛋白的功能一致。本研究首次利用Solexa高通量数据对橡胶树膜联蛋白基因家族的表达进行分析,本实验室和NCBI数据的一致性证明了本研究结果的准确性。另外,本实验室的高通量数据已成功应用于橡胶树基因组数据分析以及橡胶树蔗糖合成酶基因家族相关分析,相关结果发表在Nature Plants[18]和 Febs Journal[13],这进一步证实了本研究数据结果的可靠性。随着高通量测序技术的不断发展,网上可利用的高通量数据越来越丰富,利用这些数据对全基因家族成员进行系统的分析,将为后续基因功能研究打下基础。本研究首次鉴定了14个橡胶树膜联蛋白基因家族成员,并对其基因结构、系统进化和表达模式进行了系统的分析,研究结果将有助于深入了解膜联蛋白在橡胶树生长发育和逆境胁迫应答过程中所起的作用,为后续研究打下基础。
参考文献
[1] Raynal P, Pollard H B. Annexins: the problem of assessing the biological role for a gene family of multifunctional calcium-and phospholipid-binding proteins[J]. Biochimica et Biophysica Acta(BBA)-Reviews on Biomembranes, 1994, 1197(1): 63-93.
[2] Gruenberg J, Emans N. Annexins in membrane traffic[J]. Trends in Cell Biology, 1993, 3(7): 224-227.
[3] Boustead C M, Smallwood M, Small H, et al. Identification of calcium-dependent phospholipid-binding proteins in higher plant cells[J]. Febs Letters, 1989, 244(2): 456-460.
[4] Clark G B, Dauwalder M, Roux S J. Immunolocalization of an annexin-like protein in corn.[J]. Advances in Space Research the Official Journal of the Committee on Space Research, 1994, 14(8): 341-346.
[5] Clark G B, Dauwalder M, Roux S J. Purification and immunolocalization of an annexin-like protein in pea seedlings[J]. Planta, 1992, 187(1):1-9.
[6] Andrawis A, Solomon M, Delmer D P. Cotton fiber annexins: a potential role in the regulation of callose synthase.[J]. Plant Journal for Cell & Molecular Biology, 1993, 3(6): 763-772.
[7] Hofmann A, Proust J, Dorowski A, et al. Annexin 24 from Capsicum annuum-X-ray structure and biochemical characterization[J]. Journal of Biological Chemistry, 2000, 275(11): 8 072-8 082.
[8] Breton G, Vazquez-Tello A, Danyluk J, et al. Two novel intrinsic annexins accumulate in wheat membranes in response to low temperature.[J]. Plant & Cell Physiology, 2000, 41(2): 177-184.
[9] Cantero A, Barthakur S, Bushart T J, et al. Expression profiling of the Arabidopsis annexin gene family during germination, de-etiolation andabiotic stress[J]. Plant Physiology & Biochemistry, 2006, 44(1): 13-24.
[10] Lu Y, Bo O, Zhang J, et al. Genomic organization, phylogenetic comparison and expression profiles of annexin gene family in tomato(Solanum lycopersicum)[J]. Gene, 2012, 499(1): 14-24.
[11] Jami S K, Clark G B, Ayele B T, et al. Identification and characterization of annexin gene family in rice[J]. Plant Cell Reports, 2011, 31(5): 813-825.
[12] 肖小虎. 巴西橡膠树蔗糖代谢相关基因家族的克隆、结构进化和表达分析[D]. 海口: 海南大学, 2013.
[13] Xiao X H , Tang C R, Fang Y J, et al. Structure and expression profile of the sucrose synthase gene family in the rubber tree: indicative of roles in stress response and sucrose utilization in the laticifers[J]. Febs Journal, 2014, 281(1): 291-305.
[14] Li B, Dewey C N. RSEM: accurate transcript quantification from RNA-Seq data with or without a reference genome[J]. BMC Bioinformatics, 2011, 12(1): 93-99.
[15] Cantero A, Barthakur S, Bushart T J, et al. Expression profiling ofthe Arabidopsis annexin gene family during germination, de-etiolation andabiotic stress[J]. Plant Physiology & Biochemistry, 2006, 44(1): 13-24.
[16] Breton G, Vazquez-Tello A, Danyluk J, et al. Two novel intrinsic annexins accumulate in wheat membranes in response to low temperature[J]. Plant & Cell Physiology, 2000, 41(2):177-184.
[17] Renaut J, Hausman J F, Wisniewski M E. Proteomics and low-temperature studies: bridging the gap between gene expression and metabolism[J]. Physiologia Plantarum, 2006, 126(1): 97-109.
[18] Tang C, Meng Y, Fang Y, et al. The rubber tree genome reveals new insights into rubber production and species adaptation[J]. Nature Plants, 2016, 2(6): 1-10.
