硅与青枯菌互作对茄子幼苗抗氧化酶活性的影响
2016-05-30李威高晓敏肖熙鸥李可吕玲玲
李威 高晓敏 肖熙鸥 李可 吕玲玲


摘 要 以抗性不同的2个茄子品种为试材,通过水培试验,探讨青枯菌侵染下外源硅对茄子青枯病的抗性及抗氧化酶活性的影响,为茄子青枯病的预防提供参考依据。结果表明:Si+Rs可显著降低病情指数,同时,显著提高茄子根系活力;对于感病品种而言,接菌前,加硅与否对茄苗叶片中的PAL和PPO活性无显著影响,接菌后,Si+Rs的PAL和PPO活性显著高于Rs;而在抗病品种中,不论接菌与否,加硅处理的茄苗叶片中PAL和PPO活性均显著高于不加硅处理。说明施加外源硅能提高叶片中相关抗氧化酶活性并增强茄子对青枯病的抗性。
关键词 硅;青枯病;茄子幼苗;抗病性;抗氧化酶活性
中图分类号 S651 文献标识码 A
青枯病是一种由青枯菌(Ralstonia solanacearum)引起的主要作用于茄科作物的细菌性土传病害,能侵染450多种单子叶和双子叶植物[1]。茄子生产中,该病在高温高湿、土壤酸化、连作等条件下极易大面积发生,已成为影响茄子生产的主要病害,并有向温带区域蔓延的趋势。青枯病病原菌变异大,寄主范围广,至今尚无有效的防治办法[2]。由于该病原菌变异快、生理小种多,导致抗病品种抗性易丧失且生产中的抗病品种难以达到抗病性与丰产性的统一,故抗病育種难度大,生产中可供选择的抗病品种少;化学防治的效果差且易对土壤环境和食品安全产生较大的影响;而生物防治存在田间防效不稳定的现象,至于其他防治措施也存在一定的局限,均不能满足生产的需求。因此,继续探究其他有效措施防治青枯病成为茄科作物生产的重要工作。
对植物正常生长而言,硅虽不是高等植物生长的必需元素,但对植物在逆境中的抗性有重要影响[3]。已有的研究结果表明,外源硅可提高多种植物对病害的抗性,如黄瓜炭疽病[4]、小麦白粉病[5]、水稻稻瘟病[6]、番茄根腐病[7]和香蕉黑叶斑病[8]等。Dannon[9]研究发现,硅的施用能缓解番茄青枯病的危害,感病和抗病品种的发病率分别降低26.8%和56.1%;同时,Diogo等[10]的试验结果也表明,硅对青枯病的防治效果能达到38.1%~100%。Ghareeh[11]认为,青枯菌侵染番茄后,外源硅可诱导植株产生抗性信号分子,增加与防御信号转导抗性有关的茉莉酸/乙烯标记基因(JERF3,TSRF1 and ACCO)氧化胁迫标记基因(FD-I and POD)的表达;增加了PGK、TUB和ACT这3个看家基因的表达,提高植株的逆境耐受能力[12]。目前,有关硅与茄科作物青枯病抗性的关系的研究主要集中在番茄上,对于木质化程度更高的茄子还少有研究;同时,以往相关的研究结果多集中于硅对青枯病的抗病效果及诱导相关基因表达的影响,而对于植物生理生态的影响涉及较少。本研究通过接种青枯菌和施加外源硅,从叶片相关防御酶和根系活力的变化等角度探究硅元素对茄子青枯病抗性的影响,拟为生产上茄子青枯病的防治提供有效途径和依据。
1 材料与方法
1.1 材料
供试茄子品种为13号(特亮紫光)和49号(泰茄一号),其中13号为高感青枯病品种;而49号为中抗青枯病品种。供试青枯菌菌种从大田茄子青枯病发病植株中分离获得,为生理小种1 生化型Ⅲ。
1.2 方法
1.2.1 水培 将催芽露白的茄子种子播于水培箱中并置于光照培养箱中培养,培养条件为:昼夜温度28 ℃(14 h)/25 ℃(10 h),光照强度为200 μmol/(m2·s),相对湿度为80%。待茄子幼苗长至3叶一心时,分别选取长势一致的植株移栽至塑料杯中,每个塑料杯中定植一株茄苗并浇灌营养液40 mL,用陶粒作为栽培介质进行固定。营养液参照Hoagland经典配方配制[13],每3 d更换1次营养液。试验共设4个处理,分别为:(1)接菌加硅(Rs+Si);(2)接菌不加硅(Rs);(3)不接菌加硅(Si);(4)不接菌不加硅(CK)。每个处理30株,3次重复。添加的硅为K2SiO3(分析纯),浓度为1.5 mmol/L(此浓度是在另一个试验的基础上确定的,由于该试验结果还未发表,故无法标注该浓度的引用出处),即不加硅处理的营养液中通过添加3.0 mmol/L的氯化钾来补充由于施硅带来的钾。各处理的试验材料分别用营养液培养20 d后进行接种。接种方法为伤根侵染法,接种青枯菌的菌液浓度为4×108 CFU/mL,未接菌处理则用蒸馏水代替。在接菌第2天后开始观察不同处理茄子幼苗的萎蔫症状并分级,计算病害指数,直至植株枯死为止,调查期间正常管理;同时,于接种后的0、1、3、5、7、9、11 d分别取不同处理的茄子根尖部位测定根系活力并分别取各处理植株的倒2叶用于测定苯丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)的活性。
1.2.2 测定方法及指标 病情指数的计算:根据刘富中等[14]的方法,可将茄子幼苗青枯病发病情况分为5级。0:无症状;1:1片叶萎蔫;2:2片叶萎蔫;3:3片及3片叶以上萎蔫;4:植株完全死亡。病情指数计算公式为:
DI=∑(病级×该病级株数)/(最高病级×调查株数)×100%。
茄子幼苗相关生理指标的测定:(1)根系活力的测定,茄子幼苗根系活力的测定采用三苯基四氮唑法(TTC)[15]。(2)PAL及PPO酶活性采用南京建成生物工程研究所研发的试剂盒测定。
1.3 数据处理
试验数据采用SPSS 统计软件进行相关分析,采用Duncan新复极差法进行差异显著性检验。
2 结果与分析
2.1 硅处理对茄子青枯病病情指数的影响
硅和青枯菌对茄子青枯病病情指数的影响见图1。由图1可知,Si+Rs对2个不同抗性品种茄苗的青枯病病害指数均有较大的影响。对于感病品种13(a)而言,在接菌9 d后,Rs的茄苗的病害指数即达到100%,而Si+Rs仅为49.78%;Si+Rs能明显的降低中抗品种49(b)的青枯病病情指数且推迟发病时间,在接种11 d后,其病情指数仅为20.61%,较Rs低16.91%。
2.2 不同处理对茄子幼苗根系活动的影响
根系是植物与外界进行物质交换的重要部位,植物根系活力的高低直接影响植物的生长。因此,根系活力可作为评判植物生长状况和潜力的重要生理指标。从图2(a)中可知,接菌前,加硅与否均对茄苗根系活力均无显著影响。接菌1 d后,Si+Rs的根系活力略有升高,而Rs的根系活力降低;接菌3 d至11 d后,Si+Rs与Rs的茄苗根系活力均大幅度下降,其中接菌5 d后的降幅最大,在此期间,Si+Rs的根系活力在同一接种时期均分别高于Rs,而CK和Si的根系活力均保持稳定。
对于中抗品种49而言,根系活力在Si+Rs和Rs中均呈下降趋势且Rs的根系活力始终低于Si+Rs;而CK和Si的根系活力均保持较高水平。在不同抗性的两个品种中,Si的根系活力总是高于CK,自接菌3 d后,不论加硅与否,中抗品种49的根系活力始终高于感病品种13号。
2.3 不同处理对茄苗PAL活性的影响
从图3(a)可知,未接种前,加硅与否对茄子叶片的PAL酶活性无显著影响。接菌1 d后,Si+Rs与Rs的叶片PAL酶活性均迅速升高;至接菌3 d后,二者的PAL酶活性均达到峰值且Si+Rs酶活性显著高于Rs;至接菌9 d后,Rs的酶活性急剧下降,显著低于其他处理,而Si+Rs仍保持较高活性;接菌11 d后,其酶活性为Si>CK>Si+Rs>Rs且各处理间差异显著。
未接种前,中抗品种(b)的PAL酶活性表现为Si显著高于CK;接菌1 d后,4个处理的酶活性均达到峰值且酶活性均呈现显著性差异,表现为Si+Rs>Rs>Si>CK;随后各处理的酶活性开始下降,以Si+Rs的酶活性降幅最小且保持在较高的水平;至接菌11 d后,Rs的酶活降至最低,仅有20.98 U/g,为Si+Rs活性的62.53%,显著低于其他处理。
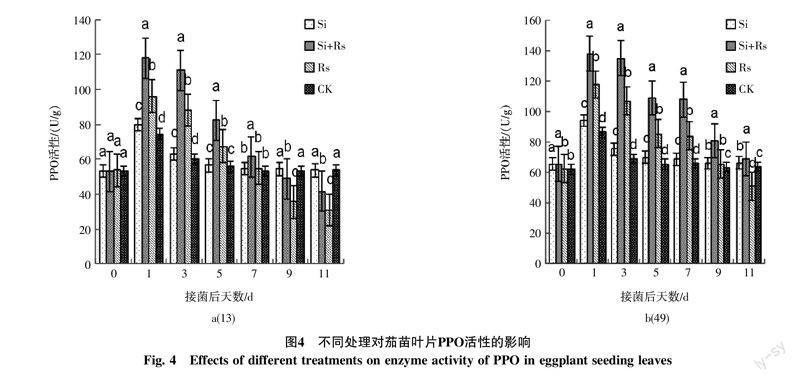
2.4 不同处理对茄苗PPO活性的影响
从图4(a)中可知,未接种前,4个处理的茄苗叶片中PPO活性均较低且差异不显著;在接种1 d后,4个处理的酶活性均达到峰值,Si+Rs与Rs的酶活性均迅速升高,增幅分别高达121.26%和78.16%,两处理的酶活性差异达显著水平,Si的酶活性也高于CK;随着接种时间的延长,4个处理的酶活性均处于下降趋势,其酶活性为Si+Rs>Rs>Si>CK;至接种11 d后,Si+Rs与Rs的酶活性均显著低于对照。
在图4(b)中,接种前,加硅处理的酶活性均显著高于不加硅处理;在接种1 d后,4个处理的酶活性均快速上升达到峰值,尤以Si+Rs增幅最大,其次为Rs,CK增幅最小;在接种3~7 d后,4个处理的酶活性均出现下降,其酶活性为Si+Rs>Rs>Si>CK且Si+Rs的酶活性降幅最小并仍保持较高的活性。接种11 d后,Si+Rs的酶活性仍处于较高水平且显著高于其他处理,而Rs的酶活性降至最低,显著低于对照。对于2个抗性不同的品种而言,同一时期,经Si+Rs处理的中抗品种的酶活性增幅均要高于感病品种,且在接种后其酶活性能保持较长时间。
3 讨论
目前,有关硅能提高植物抗病性的研究多聚焦于硅对水稻纹枯病[16]、小麦白粉病[5]、豇豆锈病[17]等真菌病害的抑制作用,而关于硅对茄科细菌性病害青枯病的研究亦逐步开展并主要以番茄为研究材料。Dannon和Wydra[9]研究发现,施硅能缓解番茄青枯病的危害,感病和抗病品种的发病率分别降低26.8%和56.1%。Diogo和Wydra[10]的試验则表明,硅对青枯病的防治效果能达到38.1%~100%。本研究结果表明,加硅处理(Si+Rs)可显著降低感病品种茄子幼苗的青枯病发病指数,同时,可推迟中抗品种的青枯病发病指数并显著降低发病率。而Getachew等[18]认为,加硅处理只对中抗番茄品种有显著的抗病及增产效果,但对中感青枯病的番茄品种的则抗病效果及丰产效果均不明显,这一结果与本研究的结论略有不同,可能因为试验材料的差异造成。
根系吸收一定的硅素后,能使根系细胞内线粒体数量增多,有利于氧化磷酸化的进行,使根的呼吸速率和ATP的含量增加,促进根系组织生长发育。在关于硅对四棱豆[19]和荞麦[20]的研究中,施用一定浓度的硅可显著提高四棱豆和荞麦幼苗根系活力,但硅对调节干旱胁迫下四棱豆及荞麦的根系活力的效果均存在剂量效应。黄益宗等[21]研究认为,在盐胁迫下,外源硅可显著提高盐胁迫下2种水稻的根系活力,与不加硅的对照相比,添加1.0 mmol/L的Si可分别使野生型和突变体水稻根系活力指数提高60.47%和42.42%。对高粱根系的研究表明,加硅可以提高根尖端和近尖端细胞壁的弹性和粘性,从而促进根的伸长生长,提高根系活力[22]。本研究中,接菌加硅处理的茄苗根系活力显著高于接菌不加硅处理并能保持较长时间的活力,与四棱豆、荞麦及水稻的结果一致。这一现象可能是由于根系吸收外源硅后在根表皮细胞富集,形成物理屏障角质-硅双层而阻止病菌的入侵,从而延缓青枯菌的侵染并在一定程度上保护了根表皮细胞,导致接种青枯菌后,较不加硅处理仍能保持较高的活力。
植物在受到胁迫时,硅可能通过调控植物体相关的生理生化反应并诱导植物组织中病程相关蛋白酶活性而产生一系列的抗性反应。PAL和PPO是植物体重要的相关防御酶,二者的酶活性与植物抗逆性密切相关,是评价植物对逆境抗性能力的重要指标。如黄瓜接种腐霉菌后,硅处理的植株病情指数较低,同时,POD和 PPO活性增强的远高于对照[23]。Cai等[6]和孙万春等[24]研究亦发现水稻感染稻瘟病后,硅处理可显著增加水稻叶片中过氧化物酶、多酚氧化酶、苯丙氨酸解氨酶的活性。王蕾等[25]以番茄为试材,研究外源硅对接种青枯病的番茄叶片抗氧化酶活性的影响,结果表明,青枯菌侵染条件下硅处理能显著增加番茄叶片抗氧化酶活性,同时,显著降低了番茄的青枯病发病指数。本研究结果表明,对于感病品种而言,接菌前,加硅与否对茄苗叶片中的PAL和PPO活性无显著影响,接菌后,加硅处理的PAL和PPO酶活性显著高于不加硅处理;而在抗病品种中,不论接菌与否,加硅处理的茄苗叶片中PAL和PPO活性均显著高于不加硅处理,这与前人研究结论一致。
综上表明,外源硅可显著降低不同抗性茄子幼苗的青枯病病情指数,同时,显著提高茄苗根系活力及叶片中PAL和PPO抗氧化酶活性,进而提高茄子对青枯病的抗性,这一结果可能是硅在植物体中发挥物理机械屏障作用[26]和诱导植物组织中病程相关蛋白酶活性[27]的综合结果。
参考文献
[1] Wicker E, Grassart L, Coranson R, et al. Ralstonia solanacearum Strains from Martinique exhibiting a new pathogenic potential[J]. Applied and Environmental Microbiology, 2007, 71: 6 790-6 801.
[2] 尹贤贵, 王小佳, 张 赟, 等. 我国番茄青枯病及抗病育种研究进展[J]. 云南农业大学学报, 2005, 20(2): 163-167.
[3] Epstein E. The anomaly of silicon in plant biology[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91: 11-17.
[4] 梁永超, 孙万春. 硅和诱导接种对黄瓜炭疽病的抗性研究[J]. 中国农业科学, 2002, 35(3): 266-261.
[5] 杨艳芳, 梁永超. 施硅对感染白粉病小麦叶片抗病相关酶活性及硅微域分布的影响[J]. 土壤学报, 2010, 47(3): 515-522.
[6] Cai K Z, Gao D, Luo S M, et al. Physiological and cytological mechanisms of silicon-induced resistance in rice against blast disease[J]. Physiologia Plantarum, 2008, 134(2): 324-333.
[7] Huang C H, Robe P D, Datnoff L E. Silicon suppresses Fusariumcrown and root rot of tomato[J]. J Phytopathol, 2011, 159(6): 546-554.
[8] Kablan L, Lagauche A, Delvaux B, et al. Silicon reduces black sigatoka development in banana[J]. Plant Disease, 2012, 96(2): 273-278.
[9] Dannon E A, Wydra K. Interaction between silicon amendment, bacterial wilt development and phenotype of Ralstonia solanacearum in tomato genotypes[J]. Physiological and Molecular Plant Pathology, 2004, 64: 233- 243.
[10] Diogo R V, Wydra K. Silicon-induced basal resistance in tomato against Ralstonia solanacearum is related to modification of pectic cell wall polysaccharide structure[J]. Physiological and Molecular Plant Pathology, 2007, 70: 120-126.
[11] Gharee B H, Bozs Z, Ott P G, et al. Silicon and Ralstonia solanacearum modulate expression stability of housekeeping genes in tomato[J]. Physiol Mol Plant Pathol, 2011, 75(4): 176-179.
[12] Gharee B H, Bozs Z, Ott P G, et al. Transcript ome of silicon-induced resistance against Ralstonia solanacearum in the silicon non-accumulator tomato implicates priming effect[J]. PhysiolMol Plant Pathol, 2011, 75(3): 83-89.
[13] Jiang J F, Li J G, Yuan H D. Effect of calcium nutrition on resistance of tomato against bacterial wilt induced by Ralstonia solanacearum[J]. Eur J Plant Pathol, 2013, 136: 547-555.
[14] 劉富中, 连 勇, 冯东昕, 等. 茄子种质资源抗青枯病的鉴定与评价[J]. 植物遗传资源学报, 2005, 6(4): 381-384.
[15] 张宪政, 陈凤玉, 王荣富. 植物生理学实验技术[M]. 沈阳: 辽宁科学技术出版社, 1994: 52-53.
[16] Rodrigues F A, Benhamou N, Datnoff L E, et al. Ultrastructural and cytochemical aspects of silicon-mediated rice blast resistance[J]. Phytopathology, 2003, 93: 535-546.
[17] Heath M C, Stumpf M A. Ultrastructural observations of penetration sites of the cowpea rust fungus in untreated andsilicon-depleted French bean cells[J]. Physiol Mol Plant, 1986, 29: 27-39.
[18] Getachew A, Chemeda F, Seid A, et al. Effects of soil amendment on bacterial wilt caused by Ralstonia solanacerum and tomato yields in Ethiopia[J]. Journal of plant protection research, 2011, 51(1): 72-76.
[19] 何淑平, 靳亞忠, 王 鹏. 硅对干旱胁迫下四棱豆幼苗生物量和生理特性的影响[J]. 水土保持学报, 2015, 29(2): 263-266.
[20] 陈 花, 王建军, 王富刚. 硅对荞麦种子萌发和幼苗生理特性的影响[J]. 作物研究, 2016, 30(3): 274-278.
[21] 黄益宗, 张文强, 招礼军, 等. Si对盐胁迫下水稻根系活力、 丙二醛和营养元素含量的影响[J]. 生态毒理学报, 2009, 4(6): 860-866.
[22] Hattori T, Inanaga S, Tanimoto E, et al. Silicon-induced changes in viscoelastic properties of sorghum root cell walls[J]. Plant and Cell Physiology, 2003, 44(7): 743-749.
[23] Liang Y C, Sun W C, Si J, et al. Effects of foliar and root applied silicon on the enhancement of induced resistance to powdery mildew in Cucumis sativus[J]. Plant Pathol, 2005, 54(5): 668-685.
[24] 孙万春, 薛高峰, 张 杰, 等. 硅对水稻防御性关键酶活性的影响及其与抗稻瘟病的关系[J]. 植物营养与肥料, 2009, 15(5): 1 023-1 028.
[25] 王 蕾, 陈玉婷, 蔡昆争, 等. 外源硅对青枯病感病番茄叶片抗氧化酶活性的影响[J]. 华南农业大学学报, 2014, 35(3): 74-78.
[26] Yoshida S. Chemical aspects of the role of silicon in physiology of the rice plant[J]. Bulletin of the National Institute Agricultural Sciences Series B, 1965, 15: 51-58.
[27] Sun W C, Zhang J, Fan Q H, et al. Silicon-enhanced resistance to rice blast is attributed to silicon-mediated defence resistance and its role as physical barrier[J]. European Journal of Plant Pathology, 2010, 128: 39-49.
