茉莉酸甲酯处理对采后芒果果实抗病性的影响
2016-05-30弓德强黄训才黄光平宋淑芳王爱平等
弓德强 黄训才 黄光平 宋淑芳 王爱平等
摘 要 以“红芒6号”芒果为试材,研究用0、1、10和100 μmol/L的茉莉酸甲酯(MeJA)采后處理对芒果果实在常温(22~25 ℃)贮藏期间抗病性的影响,并探讨其与相关防御酶和抗性物质的关系,为寻找控制芒果采后病害的新技术提供理论依据。结果表明,采后MeJA处理显著降低了贮藏期芒果的病情指数和接种炭疽病菌芒果的病斑直径,其中以10 μmol/L MeJA的处理效果最好。并且MeJA(10 μmol/L)处理显著促进了贮藏期接种炭疽病菌芒果果实内源乙烯的释放,提高了防御酶苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)和多酚氧化酶(PPO)的活性以及抗性物质总酚和木质素的含量。这些结果表明,内源乙烯、防御酶和抗性物质可能参与了MeJA诱导的芒果采后抗病性的过程。
关键词 芒果;茉莉酸甲酯;抗病性;乙烯;防御酶;抗性物质
中图分类号 S667.1 文献标识码 A
芒果品种‘红芒6号又称‘吉禄芒(Zill),是原产自美国的一种著名的晚熟红芒品种,目前在中国广东、广西、海南、四川和云南等省区均有种植[1]。该品种具有果皮红艳、稳产丰产的特点而受种植者的欢迎。但该品种果实抗病性差,容易受炭疽菌的侵染而发病,不耐贮运,造成较大的经济损失[2],严重制约了芒果产业的健康快速发展。目前,中国仍普遍采用一些化学杀菌剂(如噻菌灵和咪鲜胺等)浸果来控制芒果采后病害的发生,但长期使用化学杀菌剂会使病原菌产生抗药性和农药残留,不利于环境保护和食品安全,因此减少化学杀菌剂的使用量,积极寻找有效的安全防腐保鲜技术已成为防治芒果采后病害的热点。
抗病性诱导技术就是一种安全高效的果蔬防腐保鲜技术,即通过采用生物的或非生物的诱导因子处理果蔬产品来提高其抗病性,从而达到控制果蔬采后病害的目的,该技术有望能逐步取代化学杀菌剂在果蔬防腐保鲜中的应用[3]。茉莉酸甲酯(Methyl jasmonate,MeJA)是植物中天然存在的生长调节因子,在调节植物的生长发育和逆境胁迫过程中起着十分重要的作用[4-5]。已有研究表明,MeJA处理可以诱导香蕉[6]、枇杷[7]、番茄[8]和桃[9]等果实对病原菌侵染产生抗性,从而有效控制果实采后贮藏期间腐烂的发生。但是,MeJA作为诱抗剂在芒果果实上的抗病保鲜研究还不多,因此有必要不断进行深入研究。本试验以芒果品种‘红芒6号为材料,研究MeJA处理对采后芒果果实抗病性的诱导,并探讨芒果贮藏期间内源乙烯释放速率、防御酶[苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)和多酚氧化酶(PPO)]活性以及抗性物质(总酚和木质素)含量的动态变化规律。研究结果可望为MeJA在采后芒果抗病保鲜中的应用提供理论基础和技术指导。
1 材料与方法
1.1 材料
本试验选取的芒果材料采自广西百色市田阳县那满镇的一个芒果生产园,品种为‘红芒6号芒果(Mangifera indica L. cv. Zill),采收时间为2015年7月18日(大约芒果盛花后4个月),此时芒果成熟度为7~8成,可溶性固形物含量为6.5%。采后芒果装入纸箱运至当地冷库(12 ℃)预冷14 h,以除去果实田间热。次日用中型货柜车运至中国热带农业科学院南亚热带作物研究所实验室(广东湛江)备用。供试的诱抗剂MeJA购自Sigma公司,纯度为95%(V/V)。
1.2 方法
处理前先将芒果用自来水冲洗干净,然后剪留果柄约1~2 cm,挑选大小和色泽基本一致、无病虫害斑点和机械损伤的芒果果实作为试验用果。将试验芒果随机分成4组份(每组分90个果),用MeJA(内含0.05%的乳化剂Tween-80)水溶液进行均匀喷雾处理,处理浓度分别为0、1、10、100 μmol/L,用内含0.05%的乳化剂Tween-80的水溶液喷雾处理的芒果作为对照(CK)。以果实表面均匀喷湿为标准。待果实自然晾干后,每个处理取出60个果接种炭疽菌(孢子悬浮液浓度为106个/mL),用于测定病斑大小和取样,另外30个果不接菌用于调查常温贮藏中自然发病的病情指数。然后将芒果果实放置于小塑料筐内,外套厚度为0.02 mm的打孔聚乙烯(PEP)薄膜袋,最后置于温度为22~25 ℃、相对湿度为85%~95%的常温库中贮藏。本试验中每个处理设3次重复,每重复用果30个。在芒果贮藏期间定期调查果实的发病情况,即分别测定接菌果实的病斑直径/cm和统计不接菌芒果的病情指数。每3天取1次样,每次从处理组与对照组的接种炭疽菌的芒果中选取5个果实,先测定乙烯释放速率,然后用削皮刀分离果皮,切成小块混合均匀后立即用液氮速冻处理,于-80 ℃冰箱中保存。基于病情指数和病斑直径测定结果,选取10 μmol/L MeJA处理组和对照组样品用于生化指标的测定。
接种炭疽菌及病斑直径调查参照弓德强等[3]的方法,病斑直径以10个测定数据取平均值表示。
果实腐烂情况的分级标准及病情指数调查参照弓德强等[10]的方法,病情指数的值取0~100;乙烯释放速率测定参照Hong等[11]的方法,单位以μL C2H2/(kg·h)表示;防御酶(PAL、POD和PPO)活性和总酚含量测定参照Gong等[2]的方法,酶活性均以U/mg pro表示,总酚含量以每克鲜样质量含有没食子酸等效物的毫克数表示;木质素含量测定参照Lee等[12]的方法,结果以OD280/mg干重表示。上述各项指标的测定均重复3次,以3个测定数据取平均值表示。
1.3 数据处理与分析
试验数据统计和显著性差异(p<0.05)分析分别采用Microsoft Excel 2003软件和DPS v3.01数据分析系统进行。
2 结果与分析
2.1 采后MeJA喷施处理对芒果果实抗病性诱导效果的影响
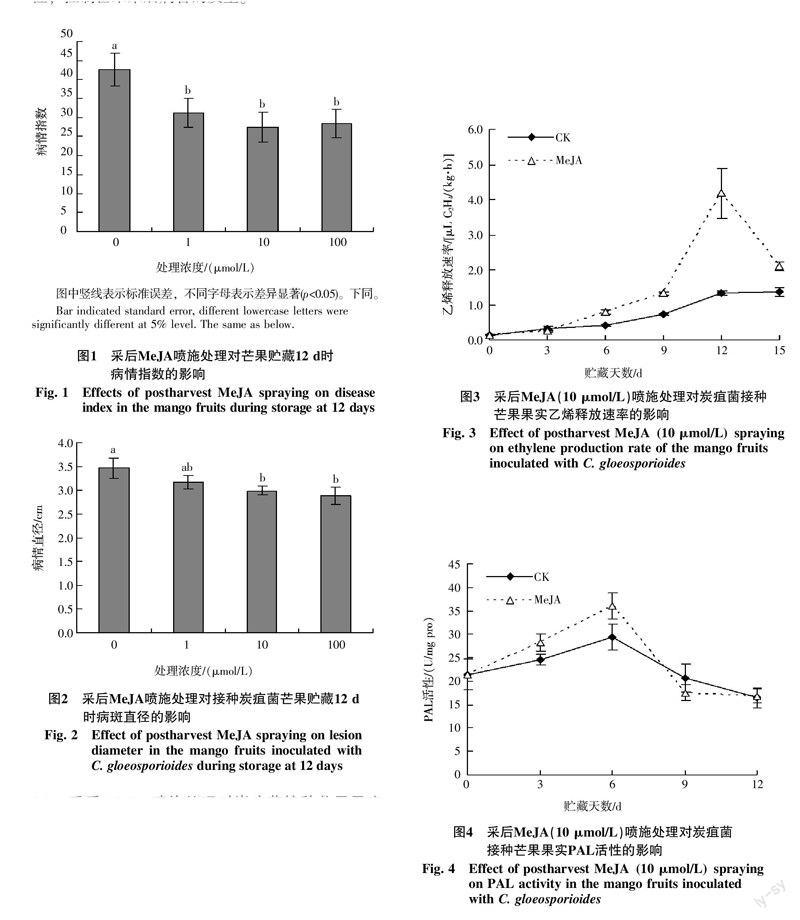
由图1可知,在1~100 μmol/L的浓度范围内,MeJA采后处理均显著降低了未接种炭疽菌的芒果在常温贮藏12 d时的病情指数(p<0.05),对控制采后芒果的病害具有明显的效果。由图2可知,对于接菌芒果,在贮藏12 d时,不同浓度的MeJA采后喷施处理均能在一定程度上抑制果实病斑直径的扩展,其中10、100 μmol/L MeJA处理芒果的病斑直径显著小于对照果(p<0.05),而1 μmol/L MeJA处理与对照差异没达到显著水平。结果表明适宜浓度的MeJA采后处理能够诱导芒果对炭疽菌侵染的抗性,控制芒果采后病害的发生。
2.2 采后MeJA喷施处理对炭疽菌接种芒果果实乙烯释放速率的影响
由图3可知,MeJA(10 μmol/L)处理果在接菌后贮藏过程中的乙烯释放速率在贮藏前期(0~9 d)缓慢升高,贮藏9 d后快速升高,12 d时达到峰值,随后又开始下降;而对照果乙烯释放速率前期逐渐升高,后期变化较为平缓。MeJA采后处理显著提高了接菌后芒果贮藏期间(6~15 d)的乙烯释放速率(p<0.05),其中贮藏12 d时,MeJA处理果的乙烯释放速率是对照果的3倍以上。表明MeJA采后处理能够促进芒果内源乙烯的释放。
2.3 采后MeJA喷施处理对炭疽菌接种芒果果实防御酶活性的影响
由图4可知,在芒果接菌后贮藏过程中,对照果和MeJA(10 μmol/L)处理果的PAL活性均呈先升后降的变化趋势,贮藏6 d时达到峰值,然后逐渐下降。在贮藏前期(3~6 d),MeJA处理果的PAL活性显著高于对照果(p<0.05)。
由图5可看出,在芒果接菌后贮藏过程中,对照果POD活性逐渐升高,而MeJA(10 μmol/L)处理果POD活性在贮藏前期逐渐升高,6 d后略有回落,9 d后又有所升高。并且在贮藏3~6 d,MeJA处理果的POD活性显著高于对照果(p<0.05)。
从图6可看出,在芒果接菌后贮藏过程中,对照果PPO活性变化较为平缓,而MeJA(10 μmol/L)处理果的PPO活性在贮藏前期(0~3 d)迅速升高,3 d后开始逐渐下降,并且在贮藏前期(0~3 d)高于对照果,后期(9~12 d)低于对照果(p<0.05)。
由以上结果可知,MeJA采后处理诱导了芒果贮藏前期的防御酶PAL、POD和PPO活性的提高。
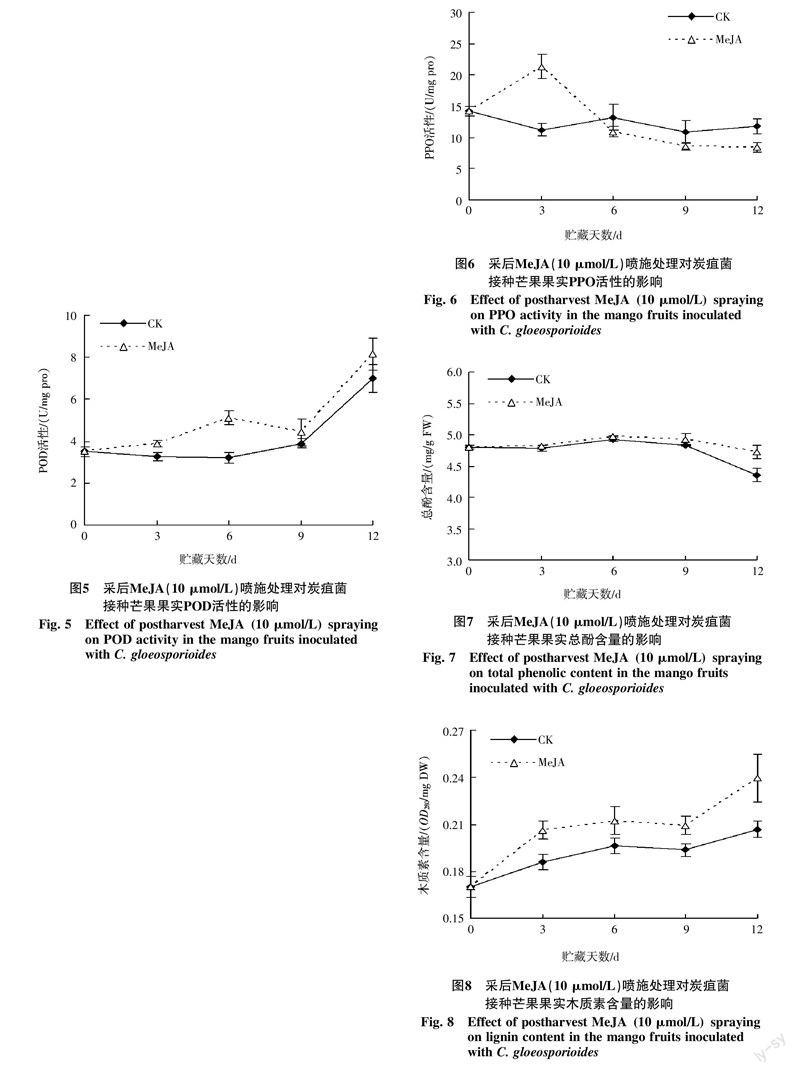
2.4 采后MeJA喷施处理对炭疽菌接种芒果果实总酚和木质素含量的影响
由图7可知,在芒果接菌后贮藏过程中,对照果和MeJA(10 μmol/L)处理果的总酚含量变化趋势大致相同,贮藏前期(0~9 d)变化波动较为平缓,9 d后逐渐下降,并且MeJA处理果的总酚含量下降速度较为缓慢,其中贮藏12 d时的总酚含量(鲜重)显著高于对照果(p<0.05)。结果表明MeJA采后处理能够提高芒果贮藏后期的总酚含量。
由图8可知,在芒果接菌后贮藏过程中,对照果和MeJA(10 μmol/L)處理果的木质素含量变化趋势基本一致,整体呈升高的变化趋势,贮藏6 d后略有回落,9 d后又有所升高。并且在整个贮藏过程中MeJA处理果的木质素含量(干重)均显著高于对照果(p<0.05)。结果表明,MeJA采后处理能够提高芒果贮藏期间木质素的含量。
3 讨论与结论
3.1 讨论
MeJA作为一种重要的抗性诱导物质,采后处理能诱导多种果实产生抗病性[6-9]。Zhu和Ma[6]在香蕉果实上的研究发现,采后经MeJA处理后的香蕉果实自然发病的病情指数以及接种炭疽菌的果实病斑直径和发病率均显著降低,达到了较好的防腐保鲜效果。也有研究表明,MeJA在芒果[3]、樱桃[13]和梨[14]上采前应用也表现良好的抗病保鲜效果。本试验结果表明,适宜浓度的MeJA采后处理对防治芒果采后病害有较为明显的效果,能够有效降低芒果贮藏期自然发病的病情指数,抑制接种炭疽菌芒果的病斑扩展,从而诱导芒果果实对炭疽菌侵染抗性的提高,并且在1~100 μmol/L的浓度范围内,10、100 μmol/L的MeJA采后处理均达到了较好的诱导抗病效果,考虑到实际生产中的应用成本问题,可选择10 μmol/L作为MeJA采后应用的最佳处理浓度。由于MeJA的使用浓度极低,同时具有安全环保的特点,因此在芒果的防腐保鲜中应用将具有广阔的前景。
已有研究表明,MeJA采前或采后处理诱导果实产生抗病性主要在于其可能激活了果实的防御系统[3,6]。PAL、POD和PPO是3种重要的防御相关酶类。PAL是植物抗病反应的次生代谢过程中苯丙烷类代谢途径的关键酶和限速酶,能够参与合成与植物的防卫反应和抗病性密切相关的次生抗菌物质如酚类、木质素、植保素和黄酮等[15]。POD属于植物病程相关蛋白(PRs)的PR-9家族,主要作用是在木质素的生物合成中催化过氧化氢(H2O2)分解而发挥作用[16]。POD在植物抵抗病原菌中发挥着重要作用,与植物的抗病性具有正相关关系[17]。PPO是一种含铜氧化酶,广泛存在于植物体内,能够将一些酚类物质氧化成毒性更强的醌类物质,而且还参与了木质素的生物合成,通过促进细胞壁的增厚来抵御一些病原菌的侵染和扩展从而抑制发病,其活性的高低与抗病性密切相关[18]。在香蕉果实上的研究表明,采后MeJA处理提高香蕉果实抗病性可能是通过激活香蕉的防御系统而发挥作用,提高了PAL、POD、PPO、过氧化氢酶(CAT)、β-1,3-葡聚糖酶和几丁质酶等6种防御酶的活性[6]。本试验中,采后MeJA处理能够显著提高芒果在贮藏前期的PAL、POD和PPO活性,这有利于促进酚的合成、氧化和木质素的合成,有利于增强果实对采后病害的普遍抗性,从而控制腐烂的发生。另外POD也是细胞内重要的一种活性氧清除酶,可避免活性氧的产生和积累[3],减轻对果实造成的膜脂伤害。本试验中,MeJA处理果的POD活性在贮藏后期(9 d后)又快速升高,这有利于清除多余的活性氧,减轻活性氧大量积累对芒果果实造成伤害。许多研究都证明,木质化反应是诱导抗病性产生的重要机制之一[19],病原物侵染植物时,常使侵染部位迅速木质化,即在细胞壁、胞间层和细胞质等不同部位产生和积累木质素类似物,阻止或延迟病原物的生长,形成一个阻碍病原菌侵染的物理障碍。木质素是由苯丙烷结构单元构成的具有三维网状的复杂天然大分子,其结构复杂,不易降解[20]。而木质素的前体--酚类物质的加速合成也能够降低病原物的膜、酶和毒素的生物活性。因此,植物体内酚类物质增加可使抗病性增强[2]。本试验中,采后MeJA处理能够保持较高的总酚含量,加速木质素含量的不断积累,有利于增强果实对病原菌侵染的防御能力。因此,采后MeJA处理的芒果中这些防御酶活性的增强和抗性物质含量的升高有利于提高采后芒果果实的抗病性,从而延缓或减轻采后芒果在贮藏期间的腐烂。这与早期在香蕉[6]、桃[9]和番茄[21]等果实上的研究结果相似。因此,本试验结果进一步表明防御酶系统的激活可能是MeJA诱导果实产生抗病性的重要机制之一。
MeJA诱导采后果实的抗病性也与乙烯生物合成有密切关系,已有研究表明,MeJA在诱导番茄果实对灰霉菌(Botrytis cinerea)侵染的抗性同时,能够促进果实内源乙烯的释放并提高乙烯的峰值,并提高乙烯生物合成的关键酶之一ACC氧化酶(ACO)活性及其基因的表达,即ACO参与了MeJA诱导的抗病性,而再用ACO抑制剂(α-氨基异丁酸)处理则削弱了这一作用[8,21]。表明乙烯作为信号分子在MeJA诱导的抗病性中起着重要作用。本研究中,MeJA采后处理不仅提高了芒果对炭疽菌侵染的抗性,而且促进了芒果内源乙烯的释放和乙烯峰值的提高,表明内源乙烯合成与MeJA诱导采后芒果的抗病性增强密切相关。早期研究表明,乙烯与MeJA在调节植物的抗病反应中起协同作用[22],MeJA可能作为一种早期的防御因子通过调节乙烯的合成从而在抗病性中起着重要作用[23]。同时,MeJA处理也能够通过促进乙烯释放从而促进果实成熟[24]。而本课题组在试验中发现,采后MeJA处理虽然促进乙烯释放,但增加的乙烯对芒果成熟的促进作用并不明显。因此,关于MeJA诱导芒果果实抗病性的机制比较复杂,其对果实成熟衰老的调控以及与乙烯信号之间的关系有待进一步深入研究。
3.2 结论
综上所述,采后MeJA处理能诱导芒果果实抗病性的增强,减轻芒果采后病害的发生,MeJA采后处理的最佳浓度为10 μmol/L。并且采后MeJA(10 μmol/L)处理显著促进了贮藏期芒果内源乙烯的释放,提高了防御酶PAL、POD和PPO的活性以及抗性物质总酚和木质素的含量,表明内源乙烯、防御酶和抗性物质可能在MeJA诱导的采后芒果抗病性中起着重要的作用。
参考文献
[1] 弓德强, 谷 会, 张鲁斌, 等. 不同采收期对芒果常温贮藏品质的影响[J]. 中国农学通报, 2012, 28(13): 200-203.
[2] Gong D Q, Zhu S J, Gu H, et al. Disease resistance of ‘Zill and ‘Keitt mango fruit to anthracnose in relation to defence enzyme activities and the content of anti-fungal substances[J]. Journal of Horticultural Science and Biotechnology, 2013, 88(3): 243-250.
[3] 弓德強, 谷 会, 张鲁斌, 等. 杧果采前喷施茉莉酸甲酯对其抗病性和采后品质的影响[J]. 园艺学报, 2013, 40(1): 49-57.
[4] Fung R W M, Wang C Y, Smith D L, et al. MeSA and MeJA increase steady-state transcript levels of alternative oxidase and resistance against chilling injury in sweet peppers (Capsicum annuum L.)[J]. Plant Science, 2004, 166(3): 711-719.
[5] 金 鹏, 吕慕雯, 孙萃萃, 等. MeJA与低温预贮对枇杷冷害和活性氧代谢的影响[J]. 园艺学报, 2012, 39(2): 461-468.
[6] Zhu S J, Ma B C. Benzothiadiazole or methyl jasmonate-induced resistance to Colletotrichum musae in harvested banana fruit is related to elevated defense enzyme activities[J]. Journal of Horticultural Science and Biotechnology, 2007, 82(4): 500-506.
[7] Cao S F, Zheng Y H, Yang Z F, et al. Effect of methyl jasmonate on inhibition of Colletotrichum acutatum infection in loquat fruit and the possible mechanisms[J]. Postharvest Biology and Technology, 2008, 49(2): 301-307.
[8] Yu M M, Shen L, Fan B, et al. The effect of MeJA on ethylene biosynthesis and induced disease resistance to Botrytis cinerea in tomato[J]. Postharvest Biology and Technology, 2009, 54(3): 153-158.
[9] Jin P, Zheng Y H, Tang S S, et al. Enhancing disease resistance in peach fruit with methyl jasmonate[J]. Journal of the Science of Food and Agriculture, 2009, 89(5): 802-808.
[10] 弓德强, 梁清志, 黄光平, 等. BABA处理对采后芒果果实抗病性的影响[J]. 热带作物学报, 2015, 36(11): 2 067-2 072.
[11] Hong K Q, Gong D Q, Xu H B, et al. Effects of salicylic acid and nitric oxide pretreatment on the expression of genes involved in the ethylene signalling pathway and the quality of postharvest mango fruit[J]. New Zealand Journal of Crop and Horticultural Science, 2014, 42(3): 205-216.
[12] Lee B R, Kim K Y, Jung W J, et al. Peroxidases and lignification in relation to the intensity of water-deficit stress in white clover(Trifolium repens L.)[J]. Journal of Experimental Botany, 2007, 58(6): 1 271-1 279.
[13] Yao H J, Tian S P. Effects of pre-and post-harvest application of salicylic acid or methyl jasmonate on inducing disease resistance of sweet cherry fruit in storage[J]. Postharvest Biology and Technology, 2005, 35(3): 253-262.
[14] 王英珍, 程 瑞, 張绍铃, 等. 采前茉莉酸甲酯(MeJA)处理对梨果实抗病性的影响[J]. 果树学报, 2016, 33(6): 694-700.
[15] 汪开拓, 郑永华, 唐文才, 等. 茉莉酸甲酯处理对葡萄果实NO和H2O2水平及植保素合成的影响[J]. 园艺学报, 2012, 39 (8): 1 559-1 566.
[16] Bruce R J, West C A. Elicitation of lignin biosynthesis and isoperoxidase activity by pectic fragnents in suspension cultures caster bean[J]. Plant Physiology, 1989, 91(3): 889-897.
[17] Joseph L M, Tan T K, Wong S M, et al. Antifungal effects of hydrogen peroxide and peroxidase on spore germination and mycelial growth of Pseudocercospora species[J]. Canadian Journal of Botany, 1998, 76(12): 2 119-2 124.
[18] Lin J H, Gong D Q, Zhu S J, et al. Expression of PPO and POD genes and contents of polyphenolic compounds in harvested mango fruits in relation to Benzothiadiazole-induced defense against anthracnose[J]. Scientia Horticulturae, 2011, 130(1): 85-89.
[19] 刘喜存, 刘红彦, 李洪连. 植物诱导抗病性及其研究现状[J]. 河南农业科学, 2006(4): 12-16.
[20] 冀玲芳, 石淑兰. 木质素的微生物降解[J]. 广西轻工业, 2002(1): 4-6, 10.
[21] Yu M M, Shen L, Zhang A J, et al. Methyl jasmonate-induced defense responses are associated with elevation of 1-aminocyclopropane-1-carboxylate oxidase in Lycopersicon esculentum fruit[J]. Journal of Plant Physiology, 2011, 168(15): 1 820-1 827.
[22] Turner J G, Ellis C, Devoto A. The jasmonate signal pathway[J]. The Plant Cell, 2002, 14: 153-164.
[23] Devoto A, Turner J G. Regulation of jasmonate-mediated plant responses in Arabidopsis[J]. Annals of Botany, 2003, 92(3): 329-337.
[24] Fan X, Mattheis J P, Fellman J K. A role for jasmonates in climacteric fruit ripening[J]. Planta, 1998, 204(4): 444-449.
