低pH和铝胁迫对胡椒根细胞存活和有机酸分泌的影响
2016-05-30祖超杨建峰李志刚王灿鱼欢邬华松
祖超 杨建峰 李志刚 王灿 鱼欢 邬华松

摘 要 以胡椒插条苗为研究对象,通过在低pH和正常pH营养液中添加不同浓度铝,研究胡椒根系细胞存活和有机酸分泌对低pH和铝胁迫的响应。结果表明:pH5.0(低pH)条件下,不添加铝时,胡椒根细胞即表现出坏死症状,当添加80 μmol/L铝时,胡椒根细胞开始凋亡,200 μmol/L铝添加导致胡椒根细胞全部死亡;pH6.0(正常pH)条件下,当添加80 μmol/L铝时,胡椒根细胞出现坏死症状,200 μmol/L铝添加导致根尖细胞大量凋亡。由此可见,低pH和铝的双重胁迫加速胡椒根细胞凋亡。低浓度铝添加致使胡椒根系分泌有机酸速率增加,柠檬酸为胡椒适应低pH和铝胁迫分泌的主要有机酸;在低pH和正常pH条件下,40 μmol/L铝添加均可诱导胡椒根系柠檬酸分泌速度的增加,苹果酸仅在正常pH条件下低浓度铝胁迫时分泌速率增加。因此,低pH条件下,铝胁迫引起胡椒根系分泌有机酸种类减少,分泌速率降低。研究还发现Al3+是对胡椒毒害最严重的铝形态,是pH<4.5土壤中的主要铝形态,目前海南省胡椒主要植区有50%的土壤pH低于4.5,所以对于胡椒园土壤的鋁毒害应引起足够重视。
关键词 胡椒;低pH;铝胁迫;根系;有机酸
中图分类号 S153.4 文献标识码 A
铝胁迫是酸性土壤或酸化土壤上作物生长最重要的限制因素[1]。自1980年至2000年,无机肥料的大量施用,导致中国土壤酸化加剧,酸化严重的南方地区经济作物种植区pH下降了0.3个单位[2]。对中国胡椒主产区海南省的胡椒主要种植区土壤调查发现,pH低于4.5和pH在4.5到5.5之间的土壤各占50%,显著低于胡椒适宜生长的土壤pH范围5.5~7.0[3],长期生长于该区域的胡椒已明显表现出早衰症状[4]。而且胡椒长期连作会显著降低胡椒园土壤pH[5],胡椒种植于pH<5.5的土壤上,胡椒蔓的生长受铝毒抑制,胡椒主蔓由绿变黄,叶片枯萎、根系死亡[6]。铝毒害的最初症状是抑制根系生长,对地上部的毒害是对根系毒害的间接伤害[7],因此,研究低pH和铝对胡椒的毒害作用应从根系研究开始。酸性土壤上种植胡椒,根系生长受到抑制[5],是低pH的作用或者铝的作用,还是二者的共同作用,有待研究。
植物在受到低pH和铝双重胁迫时,会通过体外排斥和体内忍耐2种机制来减缓铝毒害。前者主要包括:细胞壁对铝的固定、升高根际pH、分泌磷酸、黏液和有机酸阴离子等。体内忍耐机制主要是吸收到植物体内的铝离子被柠檬酸、草酸等有机酸螯合后贮存于液泡中[8-9]。玉米耐性品种的根冠细胞释放柠檬酸量是敏感品种的几倍[10];耐铝小麦品种的根尖比敏感品种释放出多5~10倍的苹果酸[11];抗铝荞麦分泌草酸[12]。有机酸在细胞内或细胞外螯合了铝,使铝失去活性,从而减轻了铝毒。但对胡椒根系如何适应低pH和铝的双重胁迫,目前未见相关报道。因此,本文通过研究低pH和铝对胡椒根系影响,分析了低pH下铝毒害对胡椒根系质子和有机酸阴离子分泌的影响,探明低pH和铝双重胁迫条件下胡椒根系生理适应机理,为深入理解低pH和铝胁迫条件下的根际过程以及植物抗酸铝胁迫的机制,进而进行深层土壤改良提供科学依据。
1 材料与方法
1.1 材料
1.1.1 植物材料 选取在沙池中培养30 d长势一致的胡椒(Piper nigrum L. cv. Reyin No. 1)插条苗,用去离子水将根系冲洗干净,称重后移至1 L的不透光玻璃桶中,通过营养液培养来研究低pH和铝对胡椒根系生理的影响及适应机理。培养条件:温度27 ℃,光照强度150 μmol/(m2·s),光照时间12 h/d,培养时间为12 d。
1.1.2 不同处理 试验分别设置2个pH(5.0、6.0)和4个铝浓度(AlCl3)(40、80、120、200 μmol/L)处理,每个处理6个重复,观察pH和铝的毒害症状,培养12 d后测定酸铝对胡椒根系活力和有机酸分泌的影响。营养液按以下组分和浓度配成(μmol/L):K2SO4(750),MgSO4(650),KCl(100),KH2PO4(250),Ca(NO3)2(2000),Fe-EDTA(100),H3BO3(100),MnSO4(1),ZnSO4(1),CuSO4(0.1),(NH4)6Mo7O24(0.005)[5]。每5天更换1次营养液,昼夜连续通气,每天用0.1 mmol/L HCl或NaOH调节营养液pH至相应处理阈值。
1.2 方法
1.2.1 根表皮细胞存活性的测定 取20 μL的PI母液(CyStainR PI Absolute P,sysmex partec)加入到1.5 mL高纯水中,配制成一定浓度的 PI 染色剂,均匀混合。用手术刀片切取相同直径的胡椒插条苗根段(自根末稍开始到根基部方向长度为2 cm,直径指根段的根基部方向一端的直径),用1 mL的移液器将根段的分泌物吸取干净,然后用吸水纸吸干,在环境温度27 ℃下,将植物材料放到高纯水中清洗3遍,每次清洗后都用吸水纸吸干,然后将不同处理的根段分别放入PI染色剂中,100 r/min的摇床上染色,染色时间为60 min,染色后的各根段放到高纯水中,100 r/min的摇床上漂洗20 min。将各根段放到载玻片上,滴2~3滴高纯水,盖上盖玻片在正立荧光显微镜(OLYMPUS BX51, Japan)下,采用WG荧光通道观测,可以观测到PI发射出的红色光[13]。
1.2.2 有机酸收集与测定 在pH分别为5.0和6.0的营养液中培养12 d的胡椒苗用去离子水洗净,然后将苗放于不同铝浓度的0.5 mmol/L CaCl2收集液中,处理时间为6 h,处理完后取收集液100 mL,加入2滴浓磷酸,-20 ℃冰箱中冷冻,后放于锡箔纸上冻干储存于-20 ℃冰箱中,待测与铝胁迫相关的柠檬酸、苹果酸、草酸和顺乌头酸4种有机酸。将锡箔纸剪碎,放入30 mL瓶中,加入15 mL去离子水中,超声30 min浸提。取适量浸提液过0.45 μm滤膜,待测。有机酸组分及含量使用高效液相色谱测定,流动相为pH=2.7,浓度为10 mmol/L的磷酸二氢钠水溶液,流速0.8 mL/min,紫外检测器214 nm,柱温35 ℃[14]。
1.3 数据统计分析
运用SPSS 13.0和SAS统计软件对数据进行统计分析。
2 结果与分析
2.1 低pH和铝胁迫下胡椒主要症状
胡椒根系最先表现出酸铝胁迫症状。酸铝胁迫根系生长时,吸收根的根尖先变黑,而后延伸到整条根变黑,pH为5和6处理的植株,用铝浓度为40 μmol/L的收集液处理6 h,然后重新放置于无铝营养液中培养,根系即出现毒害症状(图1-A),随着胁迫时间延长,叶片的叶缘和叶尖慢慢变黑直至整片叶子变黑脱落(图1-B)。pH为5和6处理的植株,在铝浓度高于80 μmol/L的收集液中处理6 h后,放回营养液中培养,地上部叶片即出现变黑脱落症状(图1-B)。
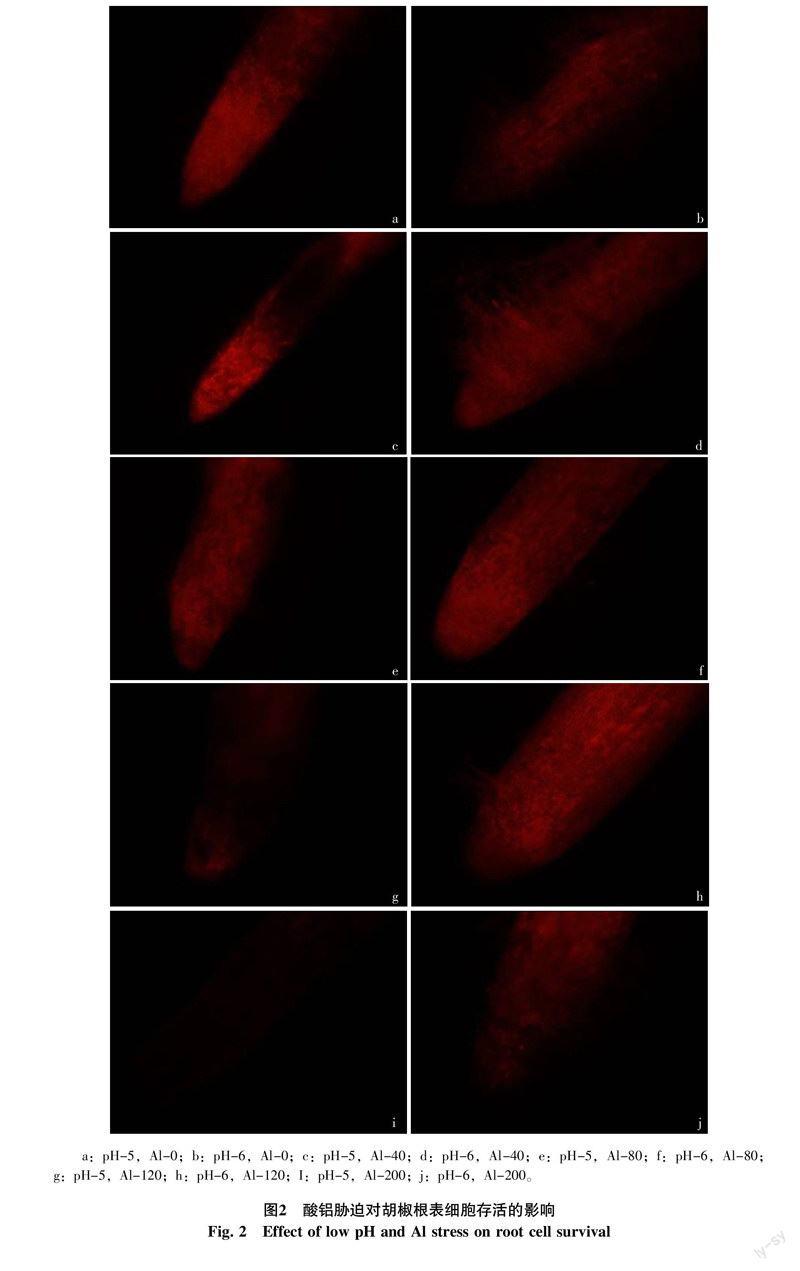
2.2 酸铝对胡椒根表细胞存活的影响
正常细胞和凋亡细胞在不固定的情况下对PI拒染,坏死细胞因细胞膜不完整性,PI可进入细胞与DNA结合,使细胞着色。不加铝条件下,pH为5的低pH处理下胡椒根尖已表现出坏死症状,被染色细胞明显多于正常pH处理(图2-a),在pH为6的正常酸度条件下,胡椒根系呈暗紅色,根尖对PI拒染(图2-b);在铝浓度为40 μmol/L,pH为5条件下,根尖细胞被染为亮红色,根系坏死症状加剧(图2-c),pH为6条件下,根系仍呈暗红色,只是相对于不加铝处理坏死细胞增多(图2-d);当铝浓度为80 μmol/L,pH为5条件下,根尖细胞开始凋亡(图2-e),pH为6条件下,根尖被染细胞增多,坏死程度加剧(图2-f);铝浓度为120 μmol/L,pH为5条件下,胡椒根系细胞大多数已凋亡(图2-g),pH为6条件下,亮度增加最大,根尖坏死细胞数目最多(图2-h);铝浓度为200 μmol/L,pH为5条件下,根尖细胞已完全凋亡(图2-i),pH为6条件下,根尖细胞大部分凋亡(图2-j)。
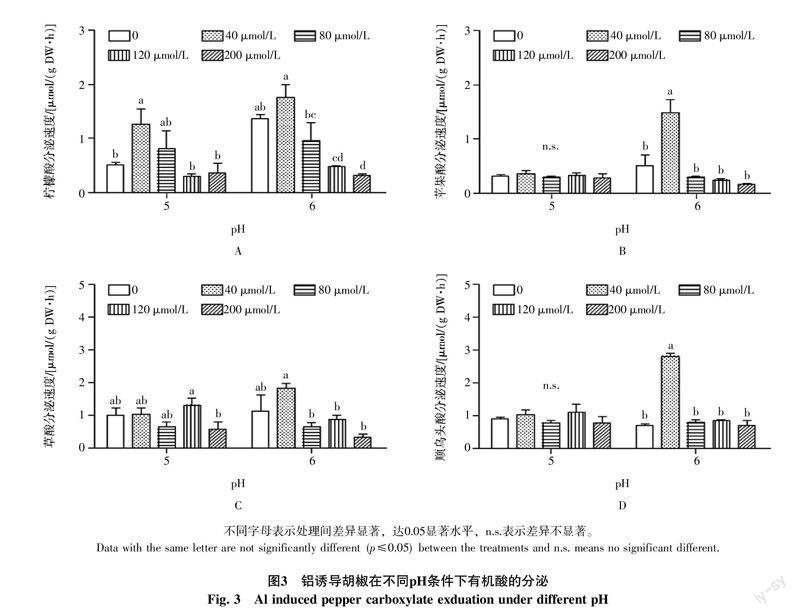
2.3 低pH和铝对胡椒根系有机酸分泌的影响
为了研究低pH和铝毒对胡椒有机酸分泌的交互作用,本试验研究了长期低pH和短期铝毒处理对胡椒有机酸分泌速度的影响。从图3-A可以看出,胡椒在低pH和正常pH条件下生长12 d后,低pH和正常pH生长条件下的胡椒根系都有柠檬酸分泌,但低pH处理下,柠檬酸分泌速度比正常pH处理低62.50%。用不同浓度铝处理6 h后,低pH和正常pH条件下,相对于无铝对照,40 μmol/L铝浓度处理使得柠檬酸分泌速度分别增加了147.06%和28.68%,80、120、200 μmol/L的铝浓度处理都没有显著提升柠檬酸分泌速度,而且,在正常pH条件下,120 μmol/L和200 μmol/L高铝浓度处理下,柠檬酸分泌速度还被显著抑制,分别比对照降低了64.71%和77.21%。胡椒在低pH和正常pH情况下生长12 d后,不加铝对照有苹果酸分泌。低pH条件下,采用不同铝浓度处理胡椒,发现并没有影响苹果酸分泌速度,正常pH条件下,40 μmol/L AlCl3处理可以显著提高苹果酸分泌速度,比对照提高186.54%,高浓度铝处理不仅不会提升苹果酸分泌速度,还有抑制作用(图3-B)。低pH条件下,铝毒没有显著提高草酸分泌速度,正常pH条件下,低浓度铝处理(40 μmol/L)可以提高草酸分泌速度,高浓度铝处理会降低草酸分泌速度(>80 μmol/L)(图3-C)。低pH条件下,顺乌头酸分泌速度不受铝浓度大小的影响,正常pH条件下,40 μmol/L浓度处理使顺乌头酸分泌速度相对于不加铝的处理提高了308.70%,其余铝浓度处理对顺乌头酸分泌速度没有显著影响(图3-D)。
综上所述,低pH条件下,低浓度铝胁迫诱导胡椒根系分泌大量柠檬酸,高浓度铝胁迫则抑制有机酸分泌,对苹果酸、草酸和顺乌头酸没有显著诱导;正常pH条件下低浓度铝胁迫可以诱导胡椒根系分泌柠檬酸、苹果酸、草酸和顺乌头酸,高浓度铝胁迫则抑制几种有机酸的分泌。这可能与低浓度铝诱导胡椒启动体外分泌有机酸排斥机制,高浓度铝导致根细胞坏死或者凋亡无法启动体外排斥机制有关。
3 讨论与结论
pH有很微小的变化也会影响到铝形态[15]。本研究中,pH为5.0和6.0条件下,采用40 μmol/L的铝处理6 h后pH分别变为4.91和5.14,pH为4.91时根系染色亮度明显高于pH为5.14的,可见胡椒根系对Al3+的敏感程度高于Al(OH)2+[16],这与已有研究认为的大豆等双子叶植物对Al(OH)2+和Al(OH)2+的敏感程度要高于Al3+不同[17],具体原因有待进一步研究;采用80 μmol/L的铝处理6 h后,pH分别变为4.49和4.65,pH为4.49条件下,胡椒根系细胞已经开始凋亡,有可能是多核Al13的作用,因为已有研究表明,pH为4.5时形成多核Al13,此时,Al13毒害作用极强,对根伸长速率的抑制作用显著高于其他形态铝[18];采用120 μmol/L的铝处理6 h后,pH分别变为4.24和4.27,pH为4.24条件下的根尖细胞大部分凋亡,但是pH为4.27条件下根尖细胞染色亮度显著增大,与pH为5时给予40 μmol/L的铝处理现象相似,可见,前期的低pH处理已胁迫根系生长,使得pH为5条件下采用120 μmol/L的铝处理,根尖细胞即出现大量凋亡现象,在不加铝的条件下pH为6时胡椒可以正常生长,所以,用浓度为120 μmol/L的铝处理6 h,胡椒根系细胞未出现大量凋亡。当采用200 μmol/L的铝处理6 h后,pH为5和6的培养液pH分别变为3.81和4.02,此时铝形态主要为Al3+,低pH处理的根系,根尖细胞全部凋亡,而正常pH培养的胡椒,根尖开始凋亡,该处理条件下,胡椒根系表皮细胞死亡率最高,所以Al3+是对胡椒根系胁迫最严重的铝形态。综上所述,长期在低pH条件下生长的胡椒,根系易受到铝胁迫。
2009年时海南省胡椒主要植区的土壤pH低于4.5的占50%[3],而且随着种植年限增加,胡椒园土壤pH显著降低[5],本研究发现铝浓度为40 μmol/L时,pH为5条件下即出现根尖细胞坏死症状,目前测定中国热带农业科学院香料饮料研究所胡椒试验基地12、23、28、38 a胡椒园土壤铝含量的平均值为7.6%,而中国土壤铝含量的平均值为3.8%,胡椒园土壤铝含量是中国土壤铝含量平均值的2倍,这在酸化土壤中应引起足够重视。
许多植物通过分泌柠檬酸、苹果酸、草酸来抵御铝毒胁迫[8,19],低浓度铝胁迫可以使胡椒根系分泌这几种有机酸的速度增加,可见,低浓度铝可以诱导胡椒启动体外排斥机制;高浓度铝胁迫则抑制几种有机酸的分泌,通过分析低pH和铝毒害对根细胞存活的影响发现高浓度铝胁迫胡椒根系使根系细胞坏死或者凋亡,这就使得高浓度铝胁迫胡椒根细胞坏死或者凋亡降低了有机酸分泌速度。所以,胡椒可以通过分泌有机酸来抵御低浓度铝胁迫。本研究发现无论在低pH还是正常pH条件下,40 μmol/L的低铝浓度都能诱导胡椒根系分泌柠檬酸速度显著增加,但是对其他几种有机酸分泌速度的影响大小不一,所以,柠檬酸是胡椒根系抵御低铝浓度胁迫分泌的主要有机酸。有研究认为,根据有机酸代谢的三羧酸循环途径,铝诱导柠檬酸分泌,是通过提高柠檬酸合成酶活性,或者降低异柠檬酸合成酶和顺乌头酸合成酶活性来实现的[20-21]。但是本研究发现低浓度铝胁迫在正常pH条件下,根系分泌柠檬酸和顺乌头酸的分泌速度均显著增加,可见铝毒胁迫胡椒根系分泌柠檬酸并不是通过降低顺乌头酸酶活性以改变代谢途径来实现的,这與在黑小麦上的研究结果相同,柠檬酸的分泌速度增加,有可能是柠檬酸运输蛋白基因在铝诱导下上调所致[22]。pH为5.0时,加铝和不加铝条件下都有苹果酸、草酸和顺乌头酸分泌,并没有影响这几种有机酸的分泌速度,pH为6.0时,低铝浓度诱导柠檬酸、苹果酸和顺乌头酸分泌速度增加,可见,低pH抑制铝对苹果酸和顺乌头酸的诱导,使铝胁迫加剧,具体抑制机理尚不清楚,还需进一步研究。
参考文献
[1] 刘 强, 郑绍建, 林咸永. 植物适应铝毒胁迫的生理及分子生物学机理[J]. 应用生态学报, 2004, 15(9): 1 641-1 649.
[2] Guo J H, Liu X J, Zhang Y, et al. Significant acidification in major Chinese croplands[J]. Science, 2010, 327: 1 008-1 010.
[3] 杨建峰, 邢谷杨, 孙 燕, 等. 海南典型胡椒园土壤化学肥力现状分析与评价[J]. 热带作物学报, 2009, 30(9): 1 291-1 294.
[4] 祖 超, 邬华松, 谭乐和, 等. 海南胡椒优势区土壤pH值与养分肥力指标的相关性分析[J]. 热带作物学报, 2012(7): 1 174-1 179.
[5] Zu C, Li Z G, Yang J F, et al. Acid soil is associated with reduced yield, root growth and nutrient uptake in black pepper(Piper nigrum L.)[J]. Agricultural sciences, 2014, 5: 466-473.
[6] Waard P W F and Sutton C D. Toxicity of aluminium to black pepper(piper nigrum L.)in Sarawak[J]. Nature, 1960, 188: 1 128-1 130.
[7] 刘 翠. 酸铝复合胁迫对杉木幼苗生理及矿质元素吸收的影响[D]. 福州: 福建农林大学, 2013.
[8] Ma J F, Ryan P R, Delhaize E. Aluminium tolerance in plants and the complexing role of organic acids[J]. Trends in Plant Sci, 2001, 6: 273-278.
[9] Kochian L V, Pineros M A, Hoekenga O A, et al. The physiology, genetics and molecular biology of plant aluminum resistance and toxicity[J]. Plant Soil, 2005, 274: 175-195.
[10] Pelledt D M, Grunes D L, Kochian L V. Organic acid exudation as an aluminum tolerance mechanism in maize(Zea mays L.)[J]. Planta, 1995, 196: 788-795.
[11] Delhaize E, Craig S, Beaton C D, et al. Aluminum tolerance in wheat(Triticum aestivum L.)I. Uptake and distribution of aluminum in root apices[J]. Plant Physio, 1993, 103: 685-693.
[12] Ma J F, Zheng S J, Matsumoto H, et al. Detoxifying aluminum with buckwheat[J]. Nature, 1997, 390: 569-570.
[13] 米国华, 高 坤. 一种植物根组织活体组织切片的荧光染色技术及其应用: 中国, 201310478787.8[P]. 2014.1.22.
[14] 李海港. 植物对低磷胁迫的适应机制及磷吸收间作优势的机理[D]. 北京: 中国农业大学, 2008.
[15] Blamey F P C, Edwards D G, Asher C J. Effects of aluminum, OH: Al and P: Al molar ratios, and ionic strength on soybean root elongation in solution culture[J]. Soil Sci, 1983, 136: 197-207.
[16] Kinraide T B. Identity of the rhizotoxic aluminium species[J]. Plant Soil, 1991, 134: 167-178.
[17] Umemura T, Usami Y, Aizawa S I, et al. Seasonal change in the level and the chemical forms of aluminum in soil solution under a Japanese cedar forest[J]. Sci Total Environ, 2003, 317: 149-157.
[18] 李春儉. 高级植物营养学[M]. 北京: 中国农业大学出版社. 2008.
[19] Ma J F. Role of organic acids in detoxification of Al in higher plants[J]. Plant Cell Physiol, 2000, 44: 482-488.
[20] Neumann G, Martinoia E. Cluster roots-an underground adaptation for survival in extreme environments[J]. Trends Plant Sci, 2002, 7: 162-167.
[21] Ryan P R, Delhaise E, Jones D L. Function and mechanism of organic anion exudation from plant roots[J]. Annu Rev Plant Physiol Plant Mol Biol, 2001, 52: 527-560
[22] Hayes J E and Ma J F. Al-induced efflux of organic acid anions is poorly associated with internal organic acid metabolism in triticale roots function and mechanism of organic anion exudation from plant roots[J]. J Exp Bot, 2003, 54: 1 753-1 759.
