利用SSR标记鉴定西瓜杂交种纯度的研究
2016-05-30刘子记詹园凤朱婕贺滉
刘子记 詹园凤 朱婕 贺滉
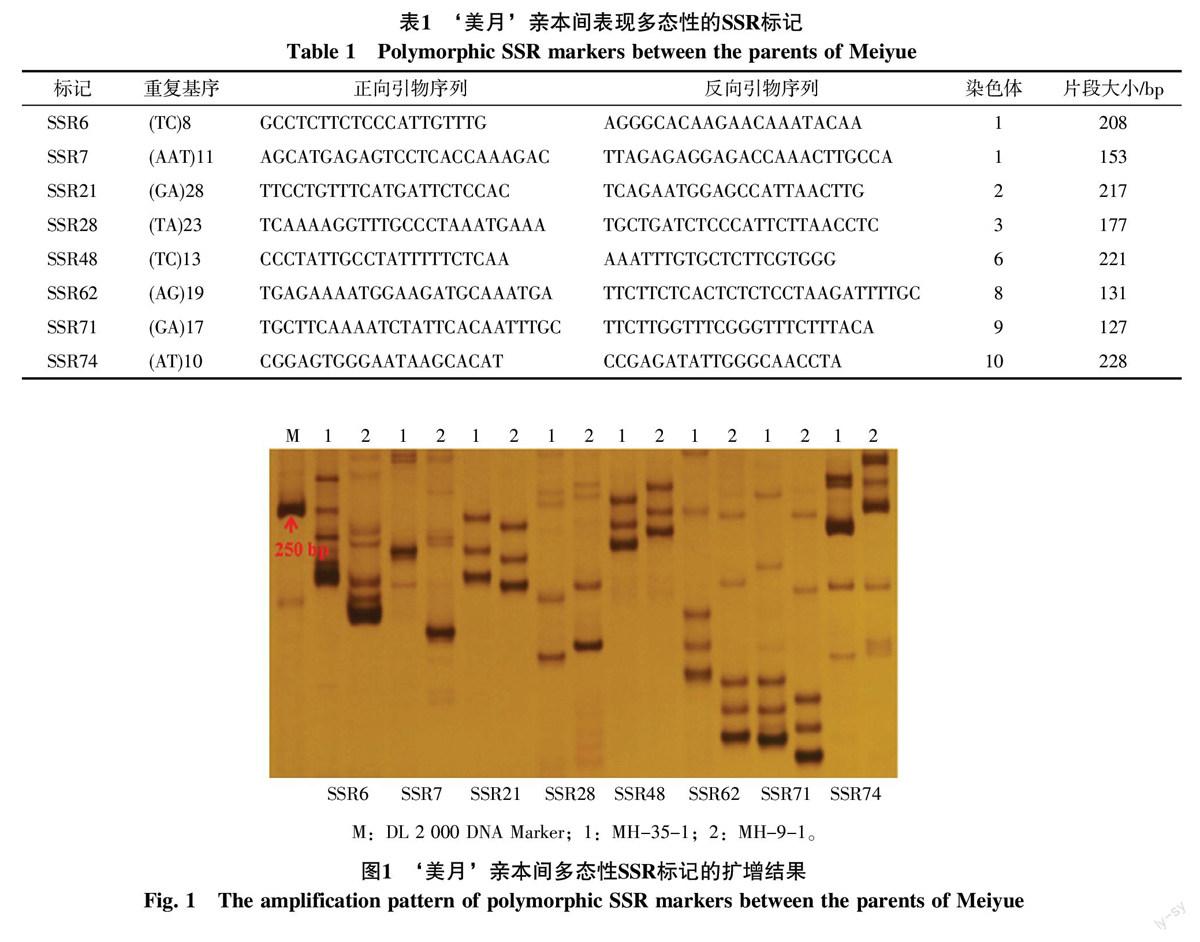
摘 要 建立快速、准确、稳定的种子纯度检测技术是保证西瓜杂交种质量的有效措施。利用分子标记技术对小型西瓜‘美月杂交种纯度进行鉴定。从均匀分布于不同西瓜染色体上的88对SSR引物中筛选出8对引物在‘美月亲本间表现明显的多态性,分别位于第1、2、3、6、8、9、10染色体上,多态性比率为9.09%,多态性标记均为共显性标记。为了提高检测效率,结合多态性片段大小,同时对标记SSR48和SSR62进行扩增,可成功获得221 bp和131 bp的两组特异性条带,成功建立了双重PCR体系。为了提高鉴定结果的准确性,选用位于西瓜不同染色体上的4对共显性标记对‘美月进行纯度检测,4对标记的检测结果高度一致,‘美月杂交种纯度为99.44%。标记鉴定结果与田间表型鉴定结果比较分析表明,2种鉴定结果高度一致。研究结果可为西瓜杂交品种纯度快速检测和品种权保护提供理论依据与技术支撑。
关键词 小型西瓜;杂交种;双重PCR技术;纯度鉴定
中图分类号 S651 文献标识码 A
\ 西瓜[Citrullus lanatus(Thunb.)Matsum. & Nakai]为葫芦科(Cucurbitaceae)西瓜属(Citrullus)一年生蔓性草本植物[1],原产非洲南部[2],广泛分布于热带、亚热带地区[3],包括3个亚种:C. lanatus subsp. lanatus L.,古老的栽培种群组,生长于南非;C. lanatus subsp. mucosospermus L.,籽用型西瓜群组;C. lanatus subsp. vulgaris L.,果肉具有甜味的西瓜群组,现代栽培的优良西瓜品种由此亚种衍生而来[4]。西瓜在中国已有上千年的栽培历史,中国是西瓜最大的生产国和消费国,平均年产量6 800万t[5]。其果实脆嫩,味甜多汁,营养丰富,富含多种矿物质和维生素。随着人民生活水平的提高,饮食习惯的变化,种植结构的调整,西瓜栽培面积逐渐扩大,已成为增加农民收人和促进农村经济发展的重要作物之一。选育适应不同地区和栽培模式的西瓜新品种是当今西瓜育种的主要任务。小型西瓜外形美观,单瓜重为1.0~2.5 kg,含糖量可达13%~14%,肉质多汁脆甜,生育期短。因其品质优良、早熟,市场价格较高,经济效益远远高于普通西瓜,种植面积呈现稳定增长的趋势。
中国西瓜生产用种已100%实现杂种化。种子是重要的农业生产资料,种子质量优劣直接影响农产品质量和优良品种的增产潜力,开展种子纯度检测对保证种子质量和提高生产效益具有重要意义。杂交种纯度检验的常用方法包括形态鉴定、田间鉴定和同工酶电泳技术鉴定等[6]。种子形态鉴定准确性较差;田间鉴定周期较长,表型易受栽培措施和环境条件影响;同工酶鉴定多态性不够丰富,且有组织和器官特异性[7]。西瓜遗传基础狭窄,传统的鉴定方法难以满足杂交种纯度鉴定在精确度方面的要求。近年来,随着测序技术的迅速发展,使得从基因组水平上检测杂交种纯度成为可能。分子标记技术能够从DNA水平上检测子代与亲本间的微小差异,不受时空限制,可以大大缩短检验时间[8]。欧阳新星等[9]利用RAPD标记对‘无籽京欣一号西瓜种子纯度进行鉴定,多态性引物可有效区分母本与杂交种。刘泽发等[10]采用SRAP标记开展了西瓜品种红小玉杂交种纯度鉴定,分子鉴定结果与大田鉴定结果高度吻合。周贤达等[11]以西瓜杂交一代品种黑宝、红与黑、黑优美及其亲本为试验材料,利用EST-SSR标记对西瓜杂交种纯度进行了快速鉴定,鉴定结果与田间鉴定结果一致。由于RAPD标记重复性和稳定性较差,SRAP标记多为显性标记,EST-SSR标记多态性较低,利用RAPD、SRAP、EST-SSR标记进行纯度鉴定具有一定的局限性。在真核生物基因组中SSR标记具有数量丰富、分布均匀、共显性遗传、操作简单等优点,是进行遗传多样性分析、杂交种纯度鉴定及分子辅助育种的理想标记类型[12]。SSR标记在小型西瓜杂交种纯度鉴定方面的研究鲜有报道。本研究以小型西瓜品种‘美月为研究对象,旨在利用SSR标记建立小型西瓜杂交种纯度鉴定技术,以期为小型西瓜育种、制种、良种的及时销售及品种保护提供科学依据。
1 材料与方法
1.1 材料
供试材料为小型西瓜[Citrullus lanatus(Thunb.) Matsum. & Nakai]杂交种一代‘美月、母本材料MH-35-1和父本材料MH-9-1。‘美月为中国热带农业科学院热带作物品种资源研究所选育的早熟小型西瓜杂交品种,全生育期冬播75~80 d,夏播63~65 d,果实平均发育期为28 d,植株生长势较强,第一雌花节位6~8节,雌花间隔4~5节。果实短椭圆形,果型指数为1.29,外观清秀,深绿果皮覆墨绿细齿条带14~15条,果肉鲜红色,色泽均匀,中心含糖量为12.5%~13%,最高可达14%,边缘含糖量为9%~10%,肉质细腻无纤维,口感极佳,果皮薄,皮厚0.4~0.5 cm,抗病性强,适于保护地栽培。将供试材料播种于营养钵中,待植株长至2片真叶时取材备用。
1.2 方法
1.2.1 基因组DNA提取 待植株长至2片真叶时,摘取1片真叶,利用Sharp等[13]的CTAB法提取MH-35-1、MH-9-1和‘美月单株的基因组DNA。
1.2.2 多态性标记分析 参考已开发的西瓜SSR标记和构建的遗传连锁图谱[14],选择了均匀分布于西瓜11条染色体上的88对SSR标记,其中11对位于1号染色体,9对位于2号染色体,7对位于3号染色体,8对位于4号染色体,9对位于5号染色体,7对位于6号染色体,7对位于7号染色体,5对位于8号染色体,8对位于9号染色体,8对位于10号染色体,9对位于11号染色体。以母本材料MH-35-1和父本材料MH-9-1基因组DNA为模板进行扩增,筛选在亲本间表现多态性的SSR标记。
PCR反应体系为10 μL,其中包括9 mmol/L Tris-HCl(pH7.6),55 mmol/L KCl,1.2 mmol/L MgCl2,
0.20 mmol/L dNTPs,55 ng引物,0.80 U Taq DNA聚合酶,75 ng模板DNA。扩增程序为:94 ℃预变性3 min;94 ℃变性35 s,55 ℃退火35 s,72 ℃延伸1 min,30个循环;72 ℃终延伸8 min。PCR产物保存于10 ℃。4 μL扩增产物与2 μL上样缓冲液混合经12%非变性聚丙烯酰胺凝胶(丙烯酰胺∶甲叉双丙烯酰胺=29 ∶ 1)于200 V电泳4 h,银染显色进行带型统计。
1.2.3 双重PCR技术建立 参考多态性标记目的片段大小及引物之间的互补性,进行引物组合,以母本材料MH-35-1和父本材料MH-9-1基因组DNA为模板进行扩增,结合单引物扩增结果,将多态性片段进行分组,建立双重PCR扩增技术。
1.2.4 分子标记种子纯度鉴定 以‘美月小型西瓜单株DNA为模板,利用在亲本材料间表现为共显性的SSR标记进行扩增,根据特异谱带的有无检测杂交种的纯度。品种纯度=(1-a/A)×100%,其中A为待测‘美月种子数目,a为单独具有母本谱带特征或单独具有父本谱带特征或既不同于‘美月谱带特征也不同于父母本谱带特征的植株数目。
1.2.5 田间纯度鉴定 将取材后的西瓜幼苗按照原顺序移栽到地势平坦、土质肥沃的试验基地,试验地的管理参照小型西瓜栽培措施,在果实成熟期依据品种的特征特性逐株进行鉴定,将标记鉴定结果与田间鉴定结果进行比较分析。
2 结果与分析
2.1 多态性标记筛选
以‘美月母本材料MH-35-1和父本材料MH-9-1为模板筛选88对均衡分布于西瓜11条染色上的SSR引物,其中8对引物在亲本间能扩增出明显的多态性,多态性比率为9.09%,多态性标记均为共显性标记,扩增出互补的特异谱带能将杂交种与亲本材料区分开来,多态性片段大小127~228 bp,分别位于西瓜第1、2、3、6、8、9、10染色体上(表1、图1)。
2.2 双重PCR技术建立
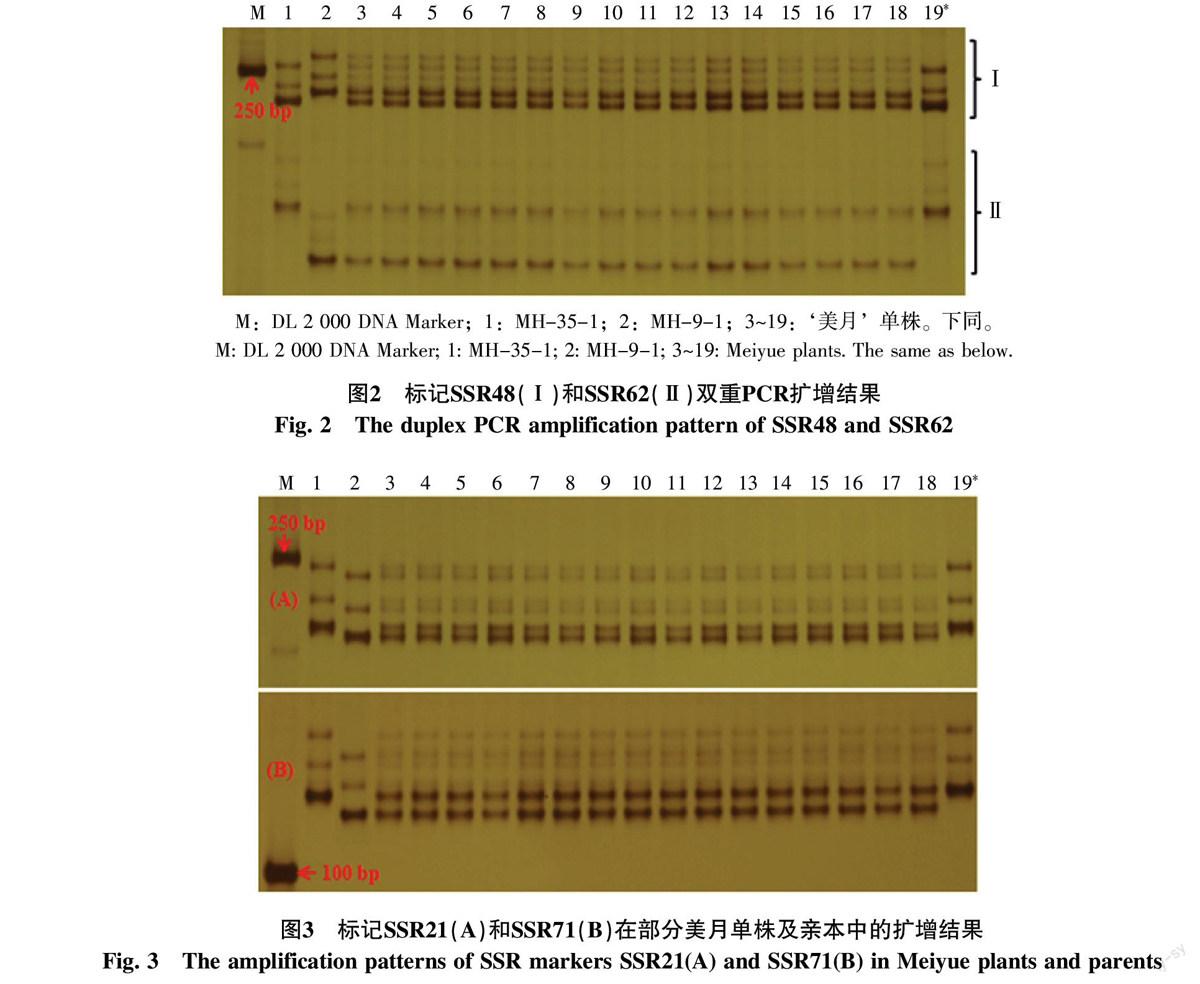
结合多态性引物扩增模式及多态性片段大小,将多态性标记进行组合。SSR48多态性片段大小为221 bp,SSR62多态性片段大小为131 bp,比较两对标记多态性片段对应区域发现,多态性片段区域杂带较少。分别以母本材料MH-35-1、父本材料MH-9-1和‘美月单株基因组DNA为模板,同时对引物SSR48和SSR62进行扩增,多态性片段分布在两个区域,第1个区段为引物SSR48多态性片段分布区域,第2个区段为引物SSR62多态性片段分布区域。从扩增结果发现,19号单株仅具有母本特异谱带,不具有父本特异谱带,为母本自交株(图2)。其余单株均同时具有母本特异谱带和父本特异谱带,为真实杂交种。两对标记的检测结果一致。
2.3 结合多对标记鉴定杂交种纯度
为了确保检测结果的准确性,采用另外2对位于西瓜不同染色体上的共显性标记SSR21和SSR71对180株‘美月小型西瓜进行纯度鉴定,从标记扩增结果发现,179个单株既具有母本特异谱带也具有父本特异谱带,属于真实的杂交种,19号单株缺少父本特异带,与母本扩增谱带一致,说明19号单株为母本自交株,与标记SSR48和SSR62检测结果一致(图3),‘美月小型西瓜品种的纯度为99.44%。
2.4 田间种子纯度鉴定
果实成熟期田间调查结果发现,母本MH-35-1植株生长势中等,主蔓第6~7节出现第1雌花,果实外形美观,果实圆球形,瓤肉鲜红色,皮厚0.45 cm左右,较韧。父本MH-9-1果实长椭圆形,花皮覆墨绿宽锯齿条带,瓤肉红色,皮厚0.5 cm左右,较脆,植株长势强。‘美月植株生长势强,果实整齐、外观漂亮,短椭圆形,深绿果皮覆墨绿细齿条带,瓤肉红色,果肉组织细腻,无纤维,口感极佳,抗病能力强,皮厚0.4~0.5 cm,较脆。19号植株与母本性状一样,易座果,果实圆形,皮较韧,植株长势较强。其余植株均具有‘美月小型西瓜品种的典型特征,生长一致,果实外观漂亮,短椭圆形,深绿果皮覆墨绿细齿条带,果皮较脆。田间形态学鉴定结果与分子标记鉴定结果高度一致,试验结果说明利用SSR标记进行小型西瓜杂交种纯度鉴定是可行的。
3 讨论与结论
3.1 分子标记技术的发展为高效、准确检测西瓜品种纯度提供技术支撑
我国西瓜的栽培面积及产量均居世界首位,自20世纪80年代以来,西瓜杂交品种在我国迅速普及推广,栽培面积逐年扩大,在人工制种过程中,常因生物混杂、母本自交和机械混杂导致种子不纯,给生产造成严重损失[15]。杂交种纯度检验的常用方法主要包括形态鉴定、田间鉴定和同工酶电泳技术鉴定等。种子形态鉴定很难将母本相同父本不同的西瓜品种区别开[16]。西瓜田间纯度鉴定周期长,占地多,费用高[17]。黄永红等[18]利用过氧化物同工酶对6个西瓜杂交组合进行了纯度鉴定研究,但同工酶具有组织和器官特异性,难以发掘统一的特征谱带来检测不同西瓜杂交种的纯度[19]。分子标记技术的发展能够从基因组水平检测微小遗传差异,能够将遗传差异较小的品种区分开来,为杂交种纯度精确鉴定带来契机。AFLP、RAPD、SRAP标记相继应用于西瓜品种纯度鉴定[9-10,20],但这几种标记在应用的过程中存在一定的局限性,如操作复杂、显性遗传、稳定性较差等。与前几种标记相比,采用SSR标记进行小型西瓜杂交种纯度鉴定具有无可比拟的优越性。本试验采用SSR分子标记技术鉴定小型西瓜‘美月品种纯度,能够准确地将母本自交种与杂交种区分开来,与田间纯度鉴定结果高度一致。
3.2 双重PCR技术构建可以显著提高检测效率
双重PCR技术与单一PCR相比,具有快速、准确、灵敏和可靠的优点。韩广涛等[21]建立了双重PCR技术,能够同时对马铃薯环腐病和黑胫病进行检测,大大节省了检测时间和费用。截止目前,采用双重PCR技术检测西瓜品种纯度的研究鲜有报道,本研究利用在‘美月亲本间表现多态性的SSR引物,在充分考虑多态性片段大小和多态性区域杂带存在与否的情况下进行组合,成功建立双重PCR技术,单次PCR过程可同时采用2对SSR标记对小型西瓜杂交种进行纯度鉴定,不仅能够节约检测时间,而且能够提高检测的准确性。该技术的建立能够对幼苗期的西瓜植株进行快速而准确的检测,对保证小型西瓜品种‘美月杂交种纯度和良种的及时销售具有重要意义。
3.3 多引物结合可以显著提高检测结果的准确性
采用单一引物进行杂交种纯度检测虽然可以有效区分混入杂交种中的亲本自交种,但对于混杂其中的其他品种很难区分开来,然而选取多对位于不同染色体上的标记进行检测,恰恰可以实现这一目的[22]。为确保鉴定结果的准确性和可靠性,进一步排除生物混杂和机械混杂,本研究选取4对位于西瓜不同染色体上的共显性SSR标记检测‘美月杂交种纯度,4对标记的检测结果完全一致,‘美月杂交种中仅混杂了母本自交种,这可能是由于同株雄花花粉被昆虫传到雌蕊柱头所致。分子标记鉴定结果与田间形态鉴定结果完全一致,该研究结果表明利用SSR分子标记技术检测‘美月杂交种纯度是切实可行的。
参考文献
[1] 莫言玲, 张 显, 张 勇, 等. 西瓜分子育种研究进展[J]. 北方园艺, 2012(8): 194-199.
[2] Guo S, Zhang J, Sun H, et al. The draft genome of watermelon(Citrullus lanatus)and resequencing of 20 diverse accessions[J]. Nat Genet, 2013, 45(1): 51-58.
[3] Levi A, Thomas C E. A genetic linkage map for watermelon based on randomly amplified polymorphic DNA markers[J]. J Amer Soc Hort Sci, 2001, 126(6): 730-737.
[4] Jeffrey C. Cucurbitaceae//Mansfeld's encyclopedia of agricultural and horticultural crops[M]. Hanelt P, et al. eds. Springer, 2001: 1 510-1 557.
[5] Ren Y, McGregor C, Zhang Y, et al. An integrated genetic map based on four mapping populations and quantitative trait loci associated with economically important traits in watermelon(Citrullus lanatus)[J]. BMC Plant Biol, 2014, 14: 33.
[6] 张体付, 葛 敏, 韦玉才, 等. 玉米功能性Insertion/Deletion (InDel)分子标记的挖掘及其在杂交种纯度鉴定中的应用[J]. 玉米科学, 2012, 20(2): 64-68.
[7] 兰 刚, 董军刚, 孟 倩, 等. 油菜杂交种合油杂2号纯度鉴定的SSR引物筛选[J]. 西北农业学报, 2012, 21(9): 74-78.
[8] 谭美莲, 严明芳, 汪 磊, 等. 蓖麻杂交种的SSR鉴定及遗传变异分析[J]. 西北植物学报, 2012, 32(8): 1 539-1 546.
[9] 欧阳新星, 许 勇, 张海英, 等. 应用RAPD技术快速进行西瓜杂交种纯度鉴定的研究[J]. 农业生物技术学报, 1999, 7(1): 23-27.
[10] 刘泽发, 孙小武, 董亚静. SRAP标记鉴定西瓜种子纯度方法研究[J]. 中国瓜菜, 2009(1): 5-8.
[11] 周贤达, 王凤辰, 周桂林, 等. 西瓜杂交种纯度SSR分子鉴定技术研究[J]. 中国瓜菜, 2012, 25(5): 13-16.
[12] Ren Y, Zhao H, Kou Q, et al. A high resolution genetic map anchoring scaffolds of the sequenced watermelon genome[J]. PLoS One, 2012, 7(1): e29453.
[13] Sharp P G, Kreis M, Shewry P R, et al. Location of β-amylase sequences in wheat and its relatives[J]. Theor Appl Genet, 1988, 75(2): 286-290.
[14] Ren Y, McGregor C, Zhang Y, et al. An integrated genetic map based on four mapping populations and quantitative trait loci associated with economically important traits in watermelon (Citrullus lanatus)[J]. BMC Plant Biol, 2014, 14: 33.
[15] 周先林, 樊 丹, 张淑霞, 等. 西瓜杂交种子纯度鉴定方法研究进展[J]. 中国瓜菜, 2011, 24(5): 46-49.
[16] 郑建礼. 西瓜杂交种纯度形态鉴定方法[J]. 北方园艺, 2002(5): 74.
[17] 张卫民, 张顺东. 西瓜种子纯度种植鉴定技术[J]. 新疆农业科技, 2003(3): 20.
[18] 黄永红, 韩 明, 王延波, 等. 西瓜杂交种纯度快速检测初探[J]. 黑龙江农业科学, l994(6): 21-25.
[19] 万云龙, 羊杏平, 曹碚生, 等. 应用PAGE梯度电泳技术鉴定西瓜杂交种纯度[J]. 江苏农业学报, 2007, 23(4): 326-329.
[20] 车克鹏, 许 勇, 梁春阳, 等. 西瓜核心种质的AFLP指纹图谱和SCAR标记[J]. 植物学报, 2003, 45(6): 731-735.
[21] 韩广涛, 杨志辉, 朱杰华, 等. 双重PCR技术检测马铃薯环腐病菌和黑胫病菌方法的建立[J]. 中国农业科学, 2011, 44(20): 4 199-4 206.
[22] 柳剑丽, 周寿春, 宋晓华, 等. 利用SSR标记鉴定甜瓜杂交种的种子纯度[J]. 分子植物育种, 2006, 4(6S): 23-26.
