人白介素24融合载体的构建、突变纠正和表达优化
2016-05-30范秋丽宋德贵
范秋丽,宋德贵
(广西师范大学生命科学学院,广西桂林541006)
人白介素24融合载体的构建、突变纠正和表达优化
范秋丽,宋德贵
(广西师范大学生命科学学院,广西桂林541006)
摘要:以武汉大学病毒学国家重点实验室保存的白介素24(IL-24)为模板,构建原核表达载体pET28a-IL-24,转化大肠杆菌DH5α,挑取单克隆,测序结果显示:在IL-24第18位A→G,21位C→T,412位G→A,18位和21位的突变没有使该位上的氨基酸发生改变,而412位的突变导致了该位点上的氨基酸发生改变——由丙氨酸A变为苏氨酸T。通过设计突变引物,二次PCR将其纠正,转化大肠杆菌BL21。通过改变诱导剂IPTG的浓度、诱导时间和诱导温度摸索最佳诱导条件,SDS-PAGE、Western blot检测显示有融合蛋白6his-IL-24表达。 结果表明:通过二次PCR成功构建了IL-24原核表达载体,表达产物主要以包涵体的形式存在,最佳诱导温度为28 ℃,最佳诱导剂浓度为1 mmol/L,最佳诱导时间是8 h。
关键词:大肠杆菌;人白介素24;原核表达;二次PCR;融合蛋白
白介素24(interleukin-24,IL-24)又称黑色素瘤分化相关基因7(melanoma differentiation associated gene7),最早是由Jiang等[1]通过差减杂交的方法发现。IL-24属于IL-10家族成员,位于人类第一条染色体上,由7个外显子和6个内含子组成,编码206个氨基酸,其中包括含有49个氨基酸的信号肽,主要在人的胸腺、脾脏和外周血单核细胞中表达。目前,许多研究证明IL-24具有选择性抑制多种肿瘤生长,诱导肿瘤细胞凋亡的作用[2-4],对正常细胞无作用[5-6]。IL-24作为一种新型的抗肿瘤药物,具有广阔的应用前景。近年来,较多的研究表明:通过联合用药或双基因共表达,IL-24能调节Bax、Caspase-3、p53、Bcl-2、Bak等基因的表达,有效地抑制肿瘤细胞的生长[7-8];IL-24诱导肿瘤细胞凋亡的作用不因p53、Rb、p16等抑癌基因的改变而改变。
1材料
1.1细菌和质粒
大肠杆菌E.coliDH5α、E.coliBL21、pET-28a、pET-ELP-Intein-IL-24为武汉大学病毒学国家重点实验室保存。
1.2主要试剂及来源
EcoRⅠ、Taq酶、DNA连接酶、蛋白marker购自美国Thermo公司,HindⅢ购自Fermentas公司,KOD-PLUs购自TOYOBO公司,DPN Ⅰ、dNTPs购自TaKaRa公司。引物合成和测序由武汉擎科创新生物科技有限公司完成。DNA marker购自深圳莱伯克生物科技有限公司,高纯度质粒小量提取试剂盒购自北京庄盟国际生物基因科技公司,胶回收试剂盒购自BioFlux公司,溶液回收试剂盒购自omega公司,721可见分光光度计购自上海菁华科技仪器有限公司。
2方法
2.1IL-24的基因克隆
根据GenBank中公布的人IL-24的基因序列,通过Primer Premier 5软件设计引物,并在引物的5′端引入酶切位点:
上游引物a:5′-CCGGAATTCATGGGGGCCCAGGGCCAAGAGTTTCACT-3′。
下游引物b:5′-CCCAAGCTTTCAGTGGTGGTGGTGGTGGTGGAGCTTGTAGAATTTCTGCA TC-3′(下划线部分分别为EcoRⅠ和HindⅢ的酶切位点),以本实验室保存的pET-ELP-Intein-IL-24为模板,扩增出的片段长520 bp。
PCR反应体系:ddH2O 15.5 μL,10×PCR buffer 2.5 μL,MgCl22 μL,dNTPs 2 μL,引物a、b各1 μL,pET-ELP-Intein-IL-24质粒0.5 μL,Taq酶0.5 μL,反应扩增条件:94 ℃预变性5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,共34个循环;最后72 ℃延伸10 min。120 V电压下7 g/L琼脂糖凝胶电泳鉴定,采用胶回收试剂盒回收目的片段。
2.2原核表达载体的构建及鉴定
将PCR产物和pET-28a载体分别用EcoRⅠ和HindⅢ进行2次单酶切,溶液回收试剂盒纯化,16 ℃下DNA连接酶连接过夜,CaCl2法转化E.coliDH5α感受态细胞,提取质粒,PCR和酶切鉴定,将阳性克隆送武汉擎科创新生物科技有限公司测序。
2.3pET-28a-IL-24点突变的纠正
IL-24 412位G突变为A,设计纠正引物c:5′-TTGGACGTAGAAGCAGCTCTGACCAAAGCC-3′,d:5′-GGCTTTGGTCAGAGCTGCTTCTACGTCCAA-3′(标有下划线的碱基是纠正点突变位置),以突变pET-28a-IL-24为模板,采用高保真的KOD-plus酶,通过PCR纠正其突变。扩增条件:94 ℃预变性5 min;94 ℃ 15 s,58 ℃ 30 s, 68 ℃ 6 min,共30个循环;最后68 ℃延伸10 min。胶回收试剂盒回收,加入DPN Ⅰ,37 ℃消化2.5 h,CaCl2法转化E.coliDH5α感受态细胞。提取质粒测序鉴定。
2.4融合蛋白的表达检测
将测序正确的重组载体转化E.coliBL21涂板,37 ℃培养,挑取单克隆于37 ℃摇瓶过夜培养,以1∶100比例转接至含有终浓度为50 mg/L卡那霉素的新鲜LB培养液中,37 ℃振荡培养至OD600约为0.5时加入IPTG,终浓度为0.5 mmol/L,37 ℃诱导培养5 h。离心收集菌体,20%功率下超声,工作1 s停2 s。50 g/L浓缩胶和150 g/L分离胶跑SDS-PAGE,考染分析结果。
2.5Western blot鉴定
IPTG诱导的表达产物包涵体经SDS-PAGE分离后转移到PVDF膜上;洗膜,50 g/L脱脂奶粉封闭1 h;洗膜,以his标签抗体孵育2 h;洗膜,辣根过氧化物酶标记的鼠抗IgG孵育1 h;洗膜,1∶1配制显影液淋膜3 min,闭光显色45 s。
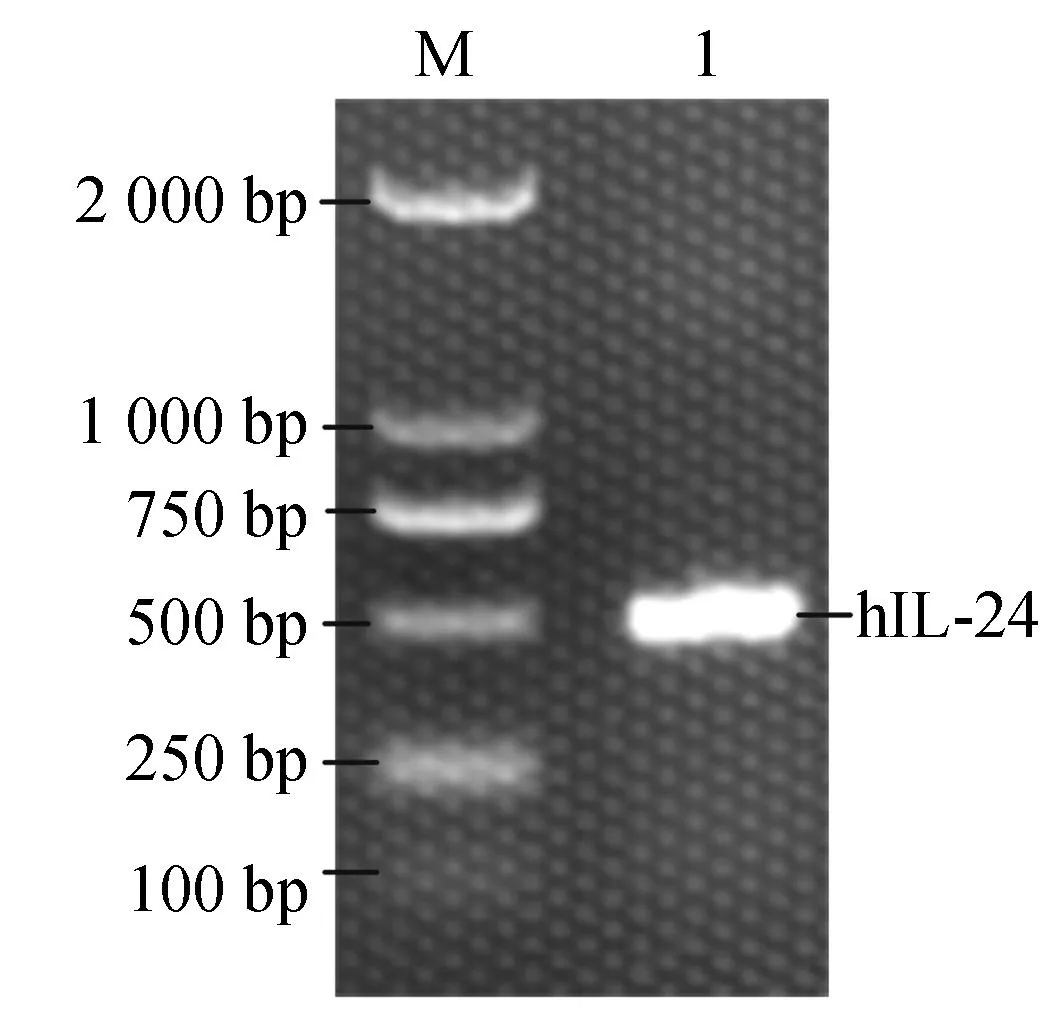
1: PCR product of IL-24图1 IL-24 PCR产物的琼脂糖凝胶电泳Fig.1 Identification of PCR product of IL-24cDNA by agarosr gel electrophoresis
2.6诱导表达条件的优化
将菌液按2.4节方法转接入新鲜培养液中,37 ℃振荡培养至OD600约为0.5时加入IPTG:第1组IPTG终浓度为0.5 mmol/L,分别于12、16、20、28 ℃诱导培养5 h;第2组IPTG终浓度分别为0.1、0.2、0.5、1 mmol/L,于28 ℃诱导培养5 h;第3组IPTG终浓度为1 mmol/L,于28 ℃下分别诱导表达5、8、12 h。同样方法收集处理菌体,考染分析结果,方法同上。
3结果
3.1IL-24基因的扩增
以pET-ELP-Intein-IL-24为模板,通过PCR扩增得到一条与目的片段大小相符的条带(图1)在1泳道,大小约为500 bp。
3.2原核表达载体的构建
pET-28a和回收的PCR产物分别用EcoRⅠ和HindⅢ进行2次单酶切,溶液回收、连接、转化,PCR和酶切初步鉴定显示构建成功(图2),测序结果与GeneBank中人IL-24基因序列对比后发现:在IL-24第18位A突变为G,21位C突变为T,412位G突变为A,18位和21位的突变没有使该位上的氨基酸发生改变,412位的突变导致了该位点上的氨基酸发生改变,由丙氨酸A变为苏氨酸T。
3.3pET-28a-IL-24点突变的纠正
针对突变位点设计突变引物,通过二次PCR纠正,PCR产物再经DPN Ⅰ酶切,去除模板,转化E.coliDH5α感受态细胞,提取质粒测序证实突变纠正成功(图3)。

图2 pET-28a-IL-24重组载体的PCR鉴定和酶切鉴定Fig.2 Identification of pET-28a-IL-24 by PCR and restrictin endonur lease digestion
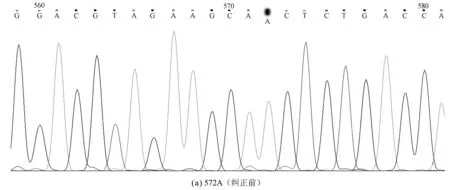
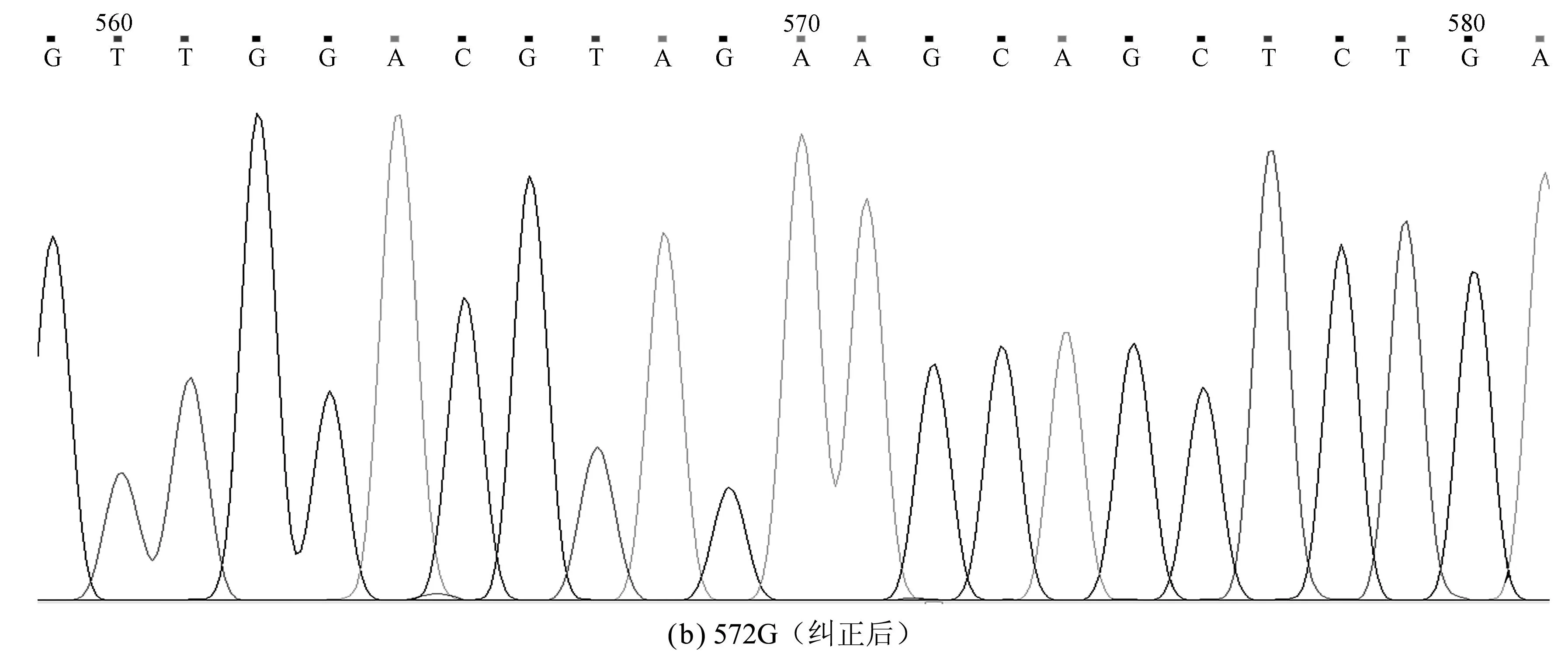
图3 突变纠正前后的测序结果Fig.3 Sequencing result of point mutation correction

1: the supernatant of induced pET-28a-IL-24 2: the precipitation of induced pET-28a-IL-24 3: the supernatant of non-induced pET-28a-IL-24 4: the precipitation of non-induced pET-28a-IL-24 5: the supernatant of induced negative control 6: the precipitation of induced negative control图4 融合蛋白表达的SDS-PAGE分析Fig.4 SDS-PAGE analysis of fusion protein expresssion
3.4融合蛋白的表达检测
将鉴定正确的菌株经IPTG诱导后,离心收集菌体,SDS-PAGE电泳,通过考染分析结果(图4),包涵体中在相对分子质量为17~26 kD有一条新生条带。
3.5Western blot鉴定
经IPTG诱导的带有重组表达蛋白的菌体裂解经SDS-PAGE电泳,转移到PVDF膜上,用检测his标签蛋白的抗体检测目的蛋白的表达,结果显示在目的蛋白的相应位置有特异条带出现,而在诱导的无载体菌体的泳道未出现条带(图5)。
3.6诱导表达条件的优化
收集不同温度、不同IPTG浓度和不同时间诱导的菌体,超声处理后经SDS-PAGE电泳,考染分析结果(图6、7、8),结果表明:不同诱导温度下,温度越高,重组蛋白表达量越高;在0.1-1 mmol/L IPTG浓度范围内,随浓度的增加,重组蛋白表达量增加;在加入IPTG 5 h、8 h和12 h后都有特异蛋白表达,在8 h时表达量最高。

1: Negative control 2: Non-induced pET-28a-IL-24 3: Induced pET-28a-IL-24图5 hIL-24的Western Blot分析Fig.5 Western-blot analysis of hIL-24 fusion protein

1、2: 5 h,3、4: 8 h,5、6: 12 h。图6 不同时间的诱导表达效果Fig.6 Induced expression resultsof different inducing time
4讨论
白介素24是IL-10家族新成员,具有广泛的抑制癌细胞生长、促进凋亡的作用,是目前发现的唯一一个对正常细胞没有毒性的细胞因子。正常情况下人IL-24的表达具有明显的组织特异性,大大限制了IL-24的研究和应用。基因工程技术因其可获得高产的表达产物而越来越受到研究工作者的青睐。常用的体外表达系统主要有真核和原核表达系统,原核表达系统由于具有操作简单、表达量高、周期较短、适于工业化生产等优点而被广泛应用。有研究表明,构建IL-24的原核表达载体,通过高密度发酵培养,获得高达1 800 mg/L的目的蛋白[9],但并不是每一种原核表达载体都能成功表达IL-24[10]。本研究采用原核表达载体pET-28a在大肠杆菌中成功表达了人IL-24蛋白。

1、2:12 ℃,3、4:16 ℃,5、6:20 ℃,7、8:28 ℃。图7 不同温度的诱导表达效果Fig.7 Induced expression result ofdifferent inducing temperature
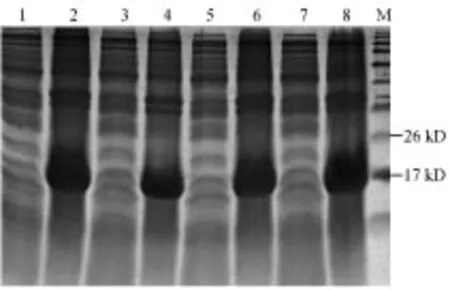
1、2:0.1 mmol/L,3、4:0.2 mmol/L,5、6:0.5 mmol/L,7、8:1 mmol/L。图8 不同IPTG浓度的诱导表达效果Fig.8 Induced expression result ofdifferent inducing concentration
本研究将人IL-24基因插入pET-28a载体,转化大肠杆菌BL21,经IPTG诱导后可表达带有his标签的IL-24融合蛋白;融合的IL-24蛋白主要以包涵体形式表达。本研究构建的重组载体经测序证实在IL-24第18位A→G,21位C→T,412位G→A,412位突变为有意突变,从而导致该位点的氨基酸发生改变,由丙氨酸A变为苏氨酸T。本文通过设计突变引物,经二次PCR将其成功纠正;通过比较诱导温度、不同IPTG浓度和诱导时间等影响因素,最终确定最佳诱导温度为28 ℃,最佳IPTG浓度为1 mmol/L,最佳诱导时间是8 h。实验结果为进一步的研究打下了良好的基础。
参考文献:
[1]JIANG H,LIN J J,SU Z Z,et al.Substraction hybridization identifies a novel melanoma-differentiation gene,mda7, modulated during human melanoma differentiation, growth and progression[J].Oncogene,1995,11(12):2477-2486.
[2]XIAO B,LI W,YANG J,et al.RGD-IL-24,a novel tumor-targeted fusion cytokine: expression,purification and functional evaluation[J].Mol Biotechool,2009,41(2):138-144.
[3]曹亚玲,黄茂涛,黄一,等.靶向肿瘤病毒介导IL-24抑制人胃癌细胞增殖[J].西南国防医药,2014,24(1):9-12.
[4]祁秋干,周清华,李印,等.人骨髓间充质干细胞表达外源IL-24基因对肺癌细胞A549增殖的影响[J].中国现代医学杂志,2014,24(9):11-16.
[5]SIEGER K A,MHASHIKLAR A M, STEWART A,et al.The tumor suppressor activity of MDA-7/IL-24 is mediated by intracellular protein expression in NSCLC cells[J].Mol Ther,2004,9(3):355-367.
[6]SAUANE M,GOPALKRISHNAN R V,SARKAR D,et al.MDA-7/IL-24: novel cancer growth suppressing and apoptosis inducing cytokine[J].Cytokine Growth Factor Rev,2003,14(1):35-51.
[7]李正袆,缪竞诚,盛伟华,等.Ad-ING4-IL-24对骨肉瘤生长抑制效应的实验研究[J].实用医学杂志,2014,30(3):349-353.
[8]马薇,李莉,王朝霞.IL-24基因联合顺铂对人宫颈癌Siha细胞淋巴转移抑制作用的研究[J].现代妇产科进展,2015,24(5):343-346.
[9]于明磊,依莫安,张家骊,等.人白介素24(IL-24)的表达与纯化及其初步活性评价[J].药物生物技术,2013,20(4):314-317.
[10]杨珺,张家敏,黄卫平,等.N-糖基化IL-24的表达及体外诱导肿瘤细胞凋亡的研究[J].中国药理学通报,2009,25(7): 915-919.
(责任编辑马殷华)
Prokaryotic Expression Optimization, Point Mutation Correction and Cloning of Human Interleukin-24
FAN Qiuli, SONG Degui
(College of Life Science,Guangxi Normal University,Guilin Guangxi 541006, China)
Abstract:Taking the interleukin (IL-24) in the lab as the template, recombinant prokaryotic vector of expressing pET28a-IL-24 was constructed, the vector was transferred into E.coli DH5α and the monoclones was picked out. The mutant(G→A in IL-24 cDNA)resulted in the change of IL-24 protein(A412T), The mutants(A→G, C→T, in IL-24 cDNA)did not change the amino acids on the bit. By designing mutation primers, correction of mutation was performed by a two-step PCR reaction, the correct recombinant vector was transformed into E.coli. BL21. The optimal condition was confirmed by changing the concentration of IPTG and induction time and temperature, the fusion protein 6his-IL-24 was detected by SDS-PAGE and Western blotting. As a result, by two-step PCR, the prokaryotic expression vector was constructed, the expression product was existed in the form of inclusion body, the best induction temperature was 28 ℃, the optimal IPTG concentration was 1 mmol/L and the best induction time was 8 h.
Keywords:Escherichia coli;interleukin-24(IL-24);prokaryotic expression;two-step PCR;fusion protein
中图分类号:Q51
文献标志码:A
文章编号:1001-6600(2016)02-0150-06
基金项目:“桂科重”研究项目 (14121003-3-1)
收稿日期:2015-09-29
doi:10.16088/j.issn.1001-6600.2016.01.024
通信联系人:宋德贵(1954—),男,广西博白人,广西师范大学教授。E-mail:sondegui@163.com
