茯苓的化学成分及生物活性研究进展
2016-05-28姜文清邝咏梅吴学军金鹏飞
徐 硕,姜文清,邝咏梅,吴学军,马 捷,金鹏飞
(北京医院药学部,北京 100730)
·综述·
茯苓的化学成分及生物活性研究进展
徐硕,姜文清,邝咏梅,吴学军,马捷,金鹏飞*
(北京医院药学部,北京100730)
摘要:目的了解茯苓的化学成分及生物活性研究进展。方法通过查阅国内外相关文献,进行归纳和分析,对茯苓的化学成分及生物活性进行综述。结果从茯苓中分离得到并鉴定的化学成分包括三萜类、二萜类、甾醇类、其他类及多糖类。现代药理研究表明,茯苓具有抗肝纤维化、利尿、免疫调节、调节肠道菌群、抗炎、抗肿瘤和增强机体免疫力等多种生物活性。结论茯苓的现代研究尽管取得了一定的进展,但仍存在一些问题,需要进一步探讨。
关键词:茯苓;化学成分;生物活性
茯苓为多孔菌科真菌茯苓Poriacocos(Schw.)Wolf的干燥菌核《中国药典》2010年版一部收载),为常用中药,具有利水渗湿、健脾、宁心之功效;用于水肿尿少、痰饮眩悸、脾虚食少、便溏泄泻、心神不安和惊悸失眠等症[1],在临床上具有广泛的应用[2]。茯苓由于含有丰富的化学成分和多种生物活性而受到药学工作者的关注,对其研究的范围和数量不断扩展。本文对近年来茯苓的化学成分及生物活性研究进行概述,为该药材的进一步研究提供依据。
1化学成分研究
1.1三萜类化合物目前从茯苓中分离得到三萜类成分40个,根据化学结构的差异,可分为4种类型(A~D):羊毛甾-8-烯型三萜10个(A)[3-7],如3β-乙酰氧基-16α-羟基-羊毛甾-8,24(31)-二烯-21-酸(茯苓酸)、3β-二羟基-羊毛甾-8,24(31)-二烯-21-酸(依布里酸)、3β-羟基-羊毛甾-8,24-二烯-21-酸等;羊毛甾-7,9(11)-二烯型三萜16个(B)[3-15],如3α,16α-二羟基-羊毛甾-7,9(11),24(31)-三烯-21-酸(3-表去氢土莫酸)、3α,16α,25-三羟基-羊毛甾-7,9(11),24(31)-三烯-21-酸(25-羟基-3-表去氢土莫酸)、3-酮基-16α-羟基-羊毛甾-7,9(11),24(31)-三烯-21-酸等;3,4-开环-羊毛甾-7,9(11)-二烯型三萜11个(C)[4,15-18],如16α-羟基-3,4-开环-羊毛甾-4(28),7,9(11),24-四烯-3,21-二酸、6α-羟基-3,4-开环-羊毛甾-4(28),8,24-四烯-3,21-二酸等;其他类3个(D)[7,18],如齐墩果酸等。见图1。
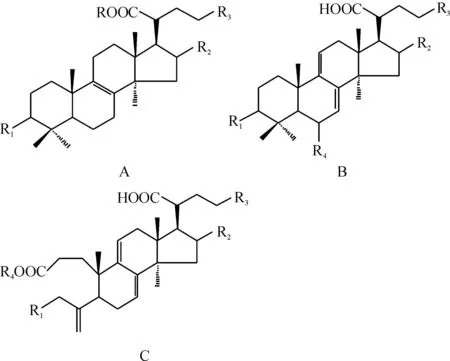
图1茯苓中三萜类化合物的结构母核
Fig.1 The skeleton of triperpenoids inPoriacocos(Schw.) Wolf
1.2二萜类化合物从茯苓中分离得到1个三环二萜类化合物,为去氢松香酸甲酯[17]。
1.3甾醇类化合物从茯苓中分离得到麦角甾醇类化合物10个,包括麦角甾醇[19]、ergost -7 - en - 3β-ol[20]、(22E) - ergosta -5,7,9(11),22 - tetraen -3β-ol[20]、ergosta -5,7 -dien-3β-ol[20]、(22E) - ergosta -6,8(14), 22 - trien -3β-ol[20]、(22E) - ergosta -7,22 - dien -3β-ol[20]、(22E) - ergosta -8(14),22 - dien -3β-ol[20]、麦角甾醇过氧化物(1)[21]、麦角甾 -7,22 -二烯 -3β,5α,6β-三醇[(22E) - ergosta -7,22 - dien -3β,5α,6β-ol](2)[21]、biemnasterol(3)[22],部分化合物的结构见图2。

图2茯苓中部分甾醇类化合物的结构
Fig.2 Parts of structures of sterols inPoriacocos(Schw.) Wolf
1.4其他类化合物从茯苓中也分离得到一些其他类化合物,包括乙基-β-D-吡喃葡萄糖苷[23]、L-尿苷[23]、柠檬酸三甲酯[23]、(R)-苹果酸二甲酯[23]、胡萝卜苷[23]。
1.5多糖类见表1。
表1茯苓中的多糖
Tab.1 Polysaccharides inPoriacocos(Schw.) Wolf

名称单糖的类型和组成方式 文献pachyman具有β-(1→6)吡喃葡萄糖为支链的(1→3)葡萄糖聚糖[24]polysaccharideHI1β-(1→3)-(1→6)-D-glucan[25]PC1,PC2,PC2-A,PC3,PC4β-(1→3)-D-glucan[26]PCSC22mannose92%,galactose6.2%,ar-abinose1.3%[27]PCM1,PCM2由鼠李糖,D-岩藻糖,D-木糖,D-半乳糖,D-葡萄糖,D-葡萄糖醛酸组成[28]PCM3,PCM4β-(1→3)-D-glucan,少量葡萄糖醛酸和D-葡萄糖组成[28]ab-PCM1,ab-PCM2-I,ab-PCM2-Ⅱ,ab-PCM3-I,ab-PCMO由α-(1→3)-D-葡萄糖,α-D-甘露糖,β-D-乳糖和乙酰葡萄糖胺组成[29]ab-PCM3-Ⅱ,ab-PCM4-Ⅰ,ab-PCM4-Ⅱβ-(1→3)-D-glucan[29]PCS1,PCS2,PCS3-I含D-葡萄糖,D-半乳糖,D-甘露糖,D-岩藻糖,D-木糖的杂多糖[30]PCS3-Ⅱβ-(1→3)-D-glucan[30]PCS4-Ⅱ由含β-(1→6)支链的(1→3)-D-葡聚糖组成[30]PCS4-II由含葡萄糖支链的β-(1→3)-D-葡聚糖组成[30]wc-PCM3-1α-(1→3)-D-glucan[31]PC-PS中性多糖[32]
2生物活性研究
2.1抗肝纤维化作用建立大鼠肝纤维化模型,将茯苓水提物用于该模型和大鼠肝星状细胞(HSC),结果显示,茯苓组的血清透明质酸和Ⅳ型胶原含量下降;HSC细胞增殖抑制率升高;减少了肝组织基质金属蛋白酶组织抑制因子-1(TIMP-1)、转化生长因子(TGFβ1)及血小板衍生生长因子(PDGF)的表达。结果表明,茯苓可以使大鼠肝纤维化的发生减缓,作用机制可能是抑制HSC增殖活化、下调 TGFβ1和 PDGF表达,促进细胞外基质的降解和减少肝纤维结缔组织的沉积[33]。
2.2利尿作用将茯苓水煎液分别给生理盐水负荷大鼠和小鼠灌胃。结果显示,茯苓有较为明显的利尿作用,且作用时间长。与阴性对照组相比,茯苓中、高剂量组动物尿中 K+排出量显著升高,Na+/K+排出量比值下降。研究表明,茯苓对电解质的影响比西药小,更适合高剂量长疗程用药[34]。
2.3免疫调节作用研究显示,茯苓水提物、碱提物和醇提物都能促进小鼠腹腔内巨噬细胞的吞噬指数和吞噬百分率,显著增加小鼠血清内免疫因子IL-2和TNF-α的含量,使胸腺及脾脏的质量增加。结果表明,茯苓发挥免疫调节作用的物质基础主要为三萜类、水溶性多糖和酸性多糖[35]。
2.4对小鼠肠道菌群的调节作用给小鼠灌胃茯苓水提物,检测小鼠粪便中双歧杆菌、乳杆菌、大肠杆菌和肠球菌的数量。结果表明,高剂量的茯苓能使肠道的双歧杆菌数量明显增加,说明茯苓对肠道菌群有良好的调节作用[36]。
2.5抗炎作用建立二甲苯致小鼠急性炎症及无菌棉球致大鼠慢性炎症模型,给予茯苓多糖。结果显示,小剂量茯苓多糖可以抑制二甲苯所致的小鼠耳肿,并抑制棉球所致的大鼠皮下肉芽肿。研究表明,茯苓多糖对急慢性炎症反应具有抑制作用[37]。
2.6抗肿瘤作用研究表明,茯苓多糖能通过提高自然杀伤(NK)细胞活性,促进淋巴细胞增殖,发挥抗肿瘤作用[38];茯苓多糖发挥抗肿瘤活性的作用机制是通过激活免疫监视系统,增强免疫功能,抑制肿瘤细胞DNA和RNA的合成[39]。对羧甲基茯苓多糖(CMP)口服液的抗肿瘤作用研究发现,CMP能显著提高荷瘤小鼠的肿瘤坏死因子含量,可使免疫低下小鼠的胸腺、脾脏质量及溶血素抗体含量显著升高,增强巨噬细胞的吞噬功能和NK细胞的活性,提高白细胞介素2(IL-2)至正常水平[40]。CMP对小鼠U-14宫颈癌、Lewis肺癌、S-180肉瘤细胞及h12肝癌细胞生长具有显著地抑制作用[41]。
2.7增强机体免疫力给小鼠静脉注射剂量为5,10和50 mg·kg-1的CMP,结果显示,在该剂量下,CMP能明显促进小鼠脾淋巴细胞的增殖及腹腔巨噬细胞的吞噬功能;当体外给药质量浓度在0.1~50 μg·mL-1时,可以直接促进小鼠脾淋巴细胞增殖。GMP对小鼠混合淋巴细胞反应具有明显的促进作用,还可显著增强刀豆蛋白A(conA)和磷酸脂多糖(LPS)活化的小鼠脾淋巴细胞的增殖反应,增强小鼠腹腔巨噬细胞吞噬中性红的作用。结果表明,羧甲基茯苓多糖体内外给药均可显著增强小鼠免疫功能[42]。CMP能上调人外周血源性树突状细胞CCR7的表达,并减少IL-10的分泌,增强其迁移能力[43]。
2.8抗衰老作用以正常小鼠和老龄大鼠为实验对象,研究茯苓多糖对丙二醛(MDA)含量、超氧化物歧化酶(SOD)和单胺氧化酶(MAO)的活性以及对动物抗寒和抗疲劳实验产生的影响。结果显示,茯苓多糖可以使血清中T-SOD和Cu- SOD的活性均有不同程度的增加,而不影响MAO的活性,同时还可以使小鼠游泳死亡时间延缓,说明茯苓多糖具有较好的抗动物衰老作用[44]。符辉等[45]研究显示,与空白对照组相比,CMP可以延长小鼠负荷游泳时间,CMP中、高剂量组可以显著降低血清尿素氮和血乳酸含量并提高肝脏SOD活性。结果表明,CMP对小鼠具有很好的抗疲劳作用,其机制可能与降低血清尿素氮、血乳酸含量以及提高肝脏SOD活性有关。
2.9治疗糖尿病郑彩云[46]用四氧嘧啶诱导糖尿病模型大鼠,观察了茯苓多糖灌胃后5,15和30 d的空腹血糖浓度(FBG)的改变以及肝脏中丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)的含量。结果显示,茯苓多糖可减缓糖尿病模型大鼠体质量的负增长,降低MDA,升高SOD,与模型组比较显著差异;降低糖尿病模型大鼠的血糖,且与处理浓度和时间呈正相关性,但茯苓多糖对GSH-Px无明显影响。结果表明,茯苓多糖具有降血糖和抗脂质过氧化作用。
3结语
从茯苓中分离并鉴定的化学成分包括三萜类、二萜类、甾醇类、其他类及多糖类。现代药理研究表明,茯苓具有抗肝纤维化、利尿、免疫调节、调节肠道菌群、抗炎、抗肿瘤、增强机体免疫力、抗衰老、抗糖尿病等多种生物活性,这些研究成果为临床更好地应用茯苓提供了依据。茯苓的研究尽管取得了一定进展,但目前仍存在一些问题,有待进一步探讨。在化学成分研究方面,报道较多的是脂溶性成分;水溶性成分报道较多的是多糖类。药理实验研究显示,茯苓水提物有多种生物活性,因此可加强对水溶性小分子化合物的分离鉴定,以期待进一步丰富茯苓的化学成分。在生物活性研究方面,目前的药理作用报道主要是茯苓粗提物,茯苓的传统功效主要是利水渗湿,但具体药效成分及其作用机制尚不明确,需加强对分离得到化学成分单体如三萜类、二萜类、甾醇类等的活性测试,发现更多的活性成分,进而更好地阐述药理活性的物质基础。因此,对于茯苓的研究尚待进一步深入,以便更好地开发利用该药材资源。
参考文献:
[1]国家药典委员会.中国药典2010年版[S].一部. 北京:中国医药科技出版社,2010: 224.
[2]付萌,黄执霞,王燕妮,等. 我院2006~2007年中药饮片使用情况分析[J].西北药学杂志, 2008,23(6): 398-399.
[3]Shingu T,Tai T,Akahori A. A lanostane triterpenoid fromPoriacocos[J]. Phytochemistry, 1992,31(7): 2548-2549.
[4]Tai T,Akahori A,Shingu T. Triterpenes ofPoriacocos[J]. Phytochemistry,1993,32(5): 1239-1244.
[5]Tai T,Shingu T,kikuchi T.Isolation of lanostane-type triterpene acids having an acetoxyl group from sclerotia ofPoriacocos[J]. Phytochemistry,1995,40(1): 225-231.
[6]Nukaya H,Yamashiro H,Fukazawa H,et al. Isolation of inhibitors of TPA-induced mouse ear edema from Hoelen,Poriacocos[J]. Chem Pharm Bull,1996,44(4): 847-849.
[7]王利亚,万惠杰. 茯苓化学成分的研究[J]. 中草药,1998,29(3): 145-148.
[8]Tai T,Akita Y,Kinoshita K,et al. Anti-emetic principles ofPoriacocos[J]. Planta Med, 1995,61(6): 527-530.
[9]Zhou L,Zhang Y,Gapter L A,et al. Cytotoxic and anti-oxidant activities of lanostane-type triterpenes isolated fromPoriacocos[J]. Chem Pharm Bull,2008,56(10): 1459-1462.
[10]Akihisa T,Uchiyama E,Kikuchi T,et al.Anti-tumor-promoting effects of 25-methoxyporicoic acid A and other triterpene acids fromPoriacocos[J]. J Nat Prod,2009,72(10): 1786-1792.
[11]Cuélla M J,Giner R M,Recio M C,et al. Two fungal lanostane derivatives as phoshpolipase A2 inhibitors[J]. J Nat Prod,1996,59(10): 977-979.
[12]许先栋,许津.茯苓环酮双烯三萜酸的晶体结构和分子结构研究[J].中国药物化学杂志, 1994,4(1): 23-27.
[13]Zheng Y,Yang X W. Two new lanostane triterpenoids fromPoriacocos[J]. J Asian Nat Prod Res,2008,10(3/4): 323-328.
[14]Yasukawa K,Kaminaga T,Kitanaka S,et al. 3β-p-hydroxybenzoyldehydro tumulosic acid fromPoriacocos,and its anti-inflammatory effect[J]. Phytochemistry,1998,48(8): 1357-1360.
[15]Tai T,shingu T,kikuchi T,etfal.Akahori A,Shingu T. Triterpenoids fromPoriacocos[J]. Phytochemistry,1991,30(8): 2796-2797.
[16]Tai T,Shingu T,Kikuchi T,et al. Triterpenes from the surface layer ofPoriacocos[J]. Phytochemistry,1995, 39(5): 1165-1169.
[17]Ukiya M,Akihisa T,Tokuda H,et al. Inhibition of tumor-promoting effects by poricoic acids G and H and other lanostane-type triterpines and cytotoxic activity of poricoic acids A and G fromPoriacocos[J]. J Nat Prod,2002,65(4),462-465.
[18]李典鹏,梁小燕,陈海珊,等.云南茯苓皮的化学成分研究[J].广西植物,1998,18(3): 267-270.
[19]Yokoyama A,Natori S,Aoshima K.Distribution of tetracyclic triterpenoids of lanostane group and sterols in the higher fungi especially of the polyporaceae and related families[J]. Phytochemistry, 1975,14(2): 487-497.
[20]Yasunori Y,Masafumi K,Masao K. Sterol constituents fromPoriacocos(Natural Medicine Note)[J]. Nat Meds, 2002,56(2): 63-67.
[21]王帅,姜艳艳,石任兵,等. 茯苓化学成分分离与结构鉴定[J].北京中医药大学学报, 2010,33(12): 841-844.
[22]杨丹, 程忠泉, 刘玉清, 等. 茯苓皮的化学成分研究[J]. 安徽农学通报, 2010, 16(19): 45-46.
[23]胡斌,杨益平,叶阳. 茯苓化学成分研究[J]. 中草药,2006,37(5): 655-658.
[24]Hoffmann G C,Simson B W,Timell T E. Structure and molecular size of pachyman[J]. Carbohyd Res,1971,20(1): 185-188.
[25]Kanayama H,Adachi N,Togami M . A new antitumor polysaccharide from the mycelia ofPoriacocosWolf[J]. Chem Pharm Bull,1983,31(3): 1115-1118.
[26]Zhang L N,Ding Q,Zhang P Y,et al. Molecular weight and aggregation behaviour in solution ofβ-D-glucan fromPoriacocossclerotium[J]. Carbohyd Res,1997,303(2): 193-197.
[27]Rhee S D,Cho S M,Park J S,et al. Chemical composition and biological activities of immunostimulants purified from alkali extract ofPoriacocossclerotium[J].Korean J Mycol, 1999,27(4): 293-298.
[28]丁琼,张俐娜,张志强.茯苓菌丝体多糖的分离及结构分析[J].高分子学报,2000,(2): 224-227.
[29]林雨露,张俐娜,金勇,等. 人工培养菌种茯苓菌丝体多糖的分离、组成和分子量[J]. 高分子学报,2003,(1): 97-103.
[30]Wang Y,Zhang M,Ruan D,et al. Chemical components and molecular mass of six polysaccharides isolated from the sclerotium ofPoriacocos[J]. Carbohydr Res,2004,339(2): 327-334.
[31]Jin Y,Zhang L N,Tao Y Z,et al. Solution properties of a water-insoluble(l,3)-D-glucan isolated fromPoriacocosmycelia[J]. Carbohydr Polym,2004,57(2): 205-209.
[32]Chen Y Y,Chang H M. Antiproliferative an differentiating effects of polysaccharide fraction from fu-ling(Poriacocos) on human leukemic U937 and HL-60 cells[J].Food Chem Toxicol, 2004,42(5): 759-769.
[33]何绮微,杨洁. 苦参与茯苓对肝纤维化的作用及机制的研究[J]. 热带医学杂志,2010,10 (8): 930-931.
[34]李森,谢人明,孙文基. 茯苓、猪苓、黄芪利尿作用的比较[J]. 中药材,2010,33(2): 264-267.
[35]邓媛媛,邵贝贝,王光忠,等.茯苓调节免疫功能有效物质的比较研究[J].中国医药指南,2012,10(12): 94-95.
[36]宋克玉,江振友,严群超,等. 党参及茯苓对小鼠肠道菌群调节作用的实验研究[J]. 中国临床药理学杂志,2011,27(2): 142-145.
[37]侯安继,彭施萍,项荣. 茯苓多糖抗炎作用研究[J].中药药理与临床, 2003,19(3): 15-16.
[38]王爱云,陈群,李成付,等. 茯苓多糖修饰物抗肿瘤作用及其机制研究[J].中草药,2009, 40(2): 268-271.
[39]霍文,孙广利,刘鹏. 正交实验法优选茯苓多糖提取工艺[J]. 西北药学杂志,2006,21(1): 18-19.
[40]徐琳本,肖梅英,樊湘红.羧甲基茯苓多糖口服液的免疫作用及抗肿瘤作用研究[J].中成药,2000,22(3): 222-223.
[41]陈春霞,赵大明,张秀军,等. 羧甲基茯苓多糖的抗肿瘤实验[J]. 福建中医药,2002,28(3): 38-40.
[42]张秀军,徐俭,林志彬.羧甲基茯苓多糖对小鼠免疫功能的影响[J].中国药学杂志,2002, 37(12): 913-915.
[43]钱高潮,丁志祥,潘薇,等. 羧甲基茯苓多糖增强人外周血源性树突状细胞迁移功能的研究[J]. 免疫学杂志,2014,30(7): 604-607.
[44]侯安继,陈腾云,彭施萍,等. 茯苓多糖抗衰老作用研究[J].中药药理与临床,2004,20(3): 10-11.
[45]符辉,吴奇辉,王广兰,等. 羧甲基茯苓多糖抗疲劳作用研究[J].天然产物研究与开发, 2014,26(3): 403-406.
[46]郑彩云. 茯苓多糖抗糖尿病作用的实验研究[J]. 中国医疗前沿,2010,5(14): 12-13.
Research advances on chemical constituents and bioactivities of Poria cocos (Schw.) Wolf
XU Shuo,JIANG Wenqing,KUANG Yongmei,WU Xuejun,MA Jie,JIN Pengfei*
(Department of Poria cocos(Schw.) Wolf Pharmaceutical Science,Beijing Hospital,Beijing 100730,China)
Abstract:ObjectiveTo summerize the advances on chemical constituents and bioactivities of Poria cocos(Schw.) Wolf.MethodsThe domestic and foreign researches on chemical constituents and bioactivities of Poria cocos(Schw.) Wolf were reviewed and analyzed.ResultsTriperpenoids,diterpenoids,sterols, and polysaccharides have been isolated from Poria cocos(Schw.) Wolf. Modern pharmacological investigations indicated that Poria cocos (Schw.) Wolf showed anti-fibrotic,diuretic,immunomodulatory,intestinal flora modulation, anti-inflammatory,antitumor and immunity enhancing effects.ConclusionAlthough much progress had been made,there were still some problems for the further exploration.
Key words:Poria cocos(Schw.) Wolf;chemical constituent;bioactivity
(收稿日期:2015-10-11)
中图分类号:R282
文献标志码:A
文章编号:1004-2407(2016)03-0327-04
doi:10.3969/j.issn.1004-2407.2016.03.032
*通信作者:金鹏飞,男,博士,副主任药师
作者简介:徐硕,女,博士,主管药师
