干旱胁迫对小麦花后不同器官果聚糖代谢和转运的影响
2016-05-27杨德龙栗孟飞程洪波柴守玺
杨德龙,栗孟飞,刘 媛,程洪波,常 磊,柴守玺
(1.甘肃省干旱生境作物学重点实验室/甘肃农业大学生命科学技术学院,甘肃兰州 7300702.甘肃农业大学农学院,甘肃兰州 730070)
干旱胁迫对小麦花后不同器官果聚糖代谢和转运的影响
杨德龙1,栗孟飞1,刘 媛1,程洪波1,常 磊2,柴守玺2
(1.甘肃省干旱生境作物学重点实验室/甘肃农业大学生命科学技术学院,甘肃兰州 7300702.甘肃农业大学农学院,甘肃兰州 730070)
摘要:为探索干旱胁迫对小麦花后不同器官果聚糖生理代谢和转运的影响,以抗旱性有显著差异的两个冬小麦品种为材料,在干旱胁迫(drought stress,DS)和正常灌溉(well watered,WW)条件下,研究了小麦花后主穗颖壳和主茎不同节位果聚糖代谢转运动态规律及其与籽粒灌浆的相关性。结果表明,小麦灌浆期不同器官果聚糖代谢转运受基因型、器官、花后天数和水分环境以及各因子互作显著影响;器官、花后天数和花后天数与水分互作是调控小麦花后果聚糖代谢转运的主要影响因子。小麦花后不同器官果聚糖含量均呈先升后降趋势。与正常灌溉处理相比,干旱胁迫缩短了果聚糖含量峰值出现的时间(提前5 d),对果聚糖代谢的影响表现为“先促积累、后促降解”效应,此效应在抗旱品种陇鉴19和小麦颖壳、穗下节和倒二节等器官中更显著。干旱胁迫显著抑制了小麦花后蔗糖:蔗糖果糖基转移酶(1-SST)活性,提高了果聚糖外水解酶(FEH)活性;果聚糖含量与FEH酶活性正相关。小麦粒重与不同器官的1-SST活性、倒二节和倒三节的FEH活性呈显著或极显著负相关;灌浆速率与不同器官的果聚糖含量、颖壳和穗下节的FEH活性呈显著或极显著正相关。干旱胁迫显著促进了小麦不同器官果聚糖的转运和再分配,其转运率和对籽粒粒重的贡献率分别达6.86%~70.52%和0.07%~4.93%,其中,花前显著高于花后,陇鉴19高于Q 9086,穗下节和倒二节高于颖壳和倒三节。
关键词:小麦;干旱胁迫;果聚糖代谢;积累转运;籽粒灌浆
小麦(TriticumaestivumL.)产量形成是源-流-库协同互作的结果[1],营养器官花前和花后暂贮性可溶性碳水化合物(WSC)主动代谢转运到籽粒对产量形成具有重要贡献[2-4]。研究表明,在适宜土壤水分条件下,小麦花前和花后营养器官暂贮性WSC对籽粒产量的贡献率分别可达3%~30%[5]和10%~25%[6]。在水分亏缺条件下,由于干旱胁迫加速小麦叶片衰老,光合作用受阻,致使光合产物量无法满足冠层呼吸消耗和保持籽粒正常灌浆需要,小麦花前暂贮性WSC成为籽粒产量形成的重要碳源[7-9],贡献率可高达70%~92%[10]。因此,干旱胁迫促进小麦花前暂贮性WSC向籽粒高效运转[11-12],对于旱地小麦稳产[7,10]和提高水分利用效率[13-14]具有重要意义。
果聚糖是小麦营养器官中暂贮性WSC的重要存在形式,在茎、叶、穗和种子中均有分布[2-3,15-16],其含量的高低直接反映营养器官蓄积贮藏WSC的能力[3]。研究表明,在小麦茎秆WSC达到峰值时,果聚糖含量可达茎秆暂贮性WSC的85%[17],占茎秆干重的40%以上[18]。果聚糖通过积极的生理代谢过程,不仅作为渗透调节物质或信号分子参与小麦抗寒[19]、抗氧化胁迫[20]和抗旱[15,21]等逆境生理代谢调控,对籽粒发育也具有重要作用[16]。现已证明,果聚糖代谢主要受蔗糖:蔗糖果糖基转移酶(1-SST)和果聚糖外水解酶(FEH)调控[16,22]。其中,1-SST起始果聚糖的合成,是控制碳素向果聚糖库分配的关键[2,22];FEHs控制果聚糖不可逆水解反应,经过复杂的生理代谢过程,果聚糖最终被降解为蔗糖,通过韧皮部输送到籽粒[3,16,22],对小麦高产稳产具有重要作用[3,23]。小麦果聚糖积累、转运和再分配是一个复杂的生理代谢过程,受基因型、环境、基因型×环境互作[22-25]、发育阶段[21-22]和器官[15-16]等因子的显著影响。目前对干旱胁迫条件下小麦灌浆期不同器官果聚糖代谢转运与籽粒灌浆和粒重形成间的内在关系研究甚少。为此,本研究选用不同抗旱性小麦品种为供试材料,研究不同水分条件下,小麦花后不同器官果聚糖生理代谢和转运与籽粒灌浆的关系,为雨养农业区小麦的抗旱改良及高效栽培提供理论依据。
1材料与方法
1.1试验材料
以抗旱性强的冬小麦品种陇鉴19和高水肥品种Q 9086为供试材料,2个品种在抗旱性、株高、千粒重、灌浆速率、茎叶WSC积累、转运等重要农艺性状上表型差异较大[4,26-28]。
1.2试验设计
试验于2013年10月至2014年6月在甘肃省榆中县金家营小麦试验点(35°51' N,104°07' E,平均海拔1 900 m,平均气温6.6 ℃,年降雨量450 mm,年蒸发量1 450 mm,无霜期140 d)进行。试验地地势平整,肥力均匀,前茬为大豆。小麦播前基施N 180 kg·hm-2、P2O5150 kg·hm-2、K2O 60 kg·hm-2,在整个生育期内均不再施肥。水分管理分为干旱胁迫(Drought stress,DS)和灌溉(Well-watered,WW)2个处理。播前试验地均统一灌底墒水(900 m3·hm-2)。灌溉处理在拔节期、抽穗期和开花期补充灌水,每次灌水量为750 m3·hm-2;干旱胁迫处理仅在拔节期灌水750 m3·hm-2,其后完全依靠自然降水(2013年10月-2014年6月小麦全生育期降水量为128 mm)。2种水分处理试验区间种植6 m宽的小麦隔离带,隔离带水分处理同干旱胁迫处理。随机区组设计,3次重复,条播,行长2 m,行距0.2 m,每行点播120粒,12行区,即每个小区4.8 m2。
1.3测定项目与方法
随机选择小麦开花期长势一致的主茎挂牌标记,从开花当天开始,每5 d取一次样直到成熟期。每个处理每次取15个主茎,取颖壳、穗下节、倒二节和倒三节,105 ℃杀青30 min,80 ℃烘干至恒重,取其平均值为测定值。将样品破碎成1~2 mm的碎片,贮存于干燥器中备用。
小麦成熟后,脱粒测定主穗粒重,计算灌浆速率[29];营养器官果聚糖含量测定参考姜 东[2]等方法;1-SST和FEH酶液提取及其活性测定参考Verspreet等[16]的方法。所有测定均3次重复。
果聚糖花前转运率=(花后当天果聚糖绝对含量-成熟期果聚糖绝对含量)/花后当天果聚糖绝对含量×100%;
果聚糖花后转运率=(最大果聚糖绝对含量-花后当天果聚糖绝对含量)/最大果聚糖绝对含量×100%;
果聚糖花前贡献率=(花后当天果聚糖绝对含量-成熟期果聚糖绝对含量)/(1 000×主穗粒重)×100%;
果聚糖花后贡献率=(最大果聚糖绝对含量-花后当天果聚糖绝对含量)/(1 000×主穗粒重)×100%;
果聚糖绝对含量=果聚糖浓度×干物质量。
1.4数据处理
采用DPS v7.05统计软件进行不同处理间各目标性状方差(ANVOA)分析和相关分析。
2结果与分析
2.1小麦果聚糖代谢和转运的影响因子
小麦花后不同器官果聚糖含量、1-SST和FEH活性、果聚糖转运率和果聚糖转运对粒重的贡献率受基因型、器官、花后天数及各因子互作显著(P≤0.05)或极显著(P≤0.01)影响(表1)。根据各变异来源占总处理变异的百分比(SSA/SST),可比较各因子对目标性状变异的相对贡献率[30]。从表1看出,器官和花后天数是影响果聚糖含量、1-SST和FEH活性表型变异的主要因素,二者对这三个性状表型变异的相对贡献率可达50.64%~73.84%。器官、花后天数与水分互作对果聚糖转运率和果聚糖对粒重的贡献率表型变异具有重要作用,对其表型变异的相对贡献率分别达74.42%和69.70%。其他因子及其互作对各目标性状影响相对较小。说明,器官、花后天数和花后天数与水分互作是影响小麦主茎花后果聚糖代谢和转运的主导因子。
2.2小麦花后不同器官果聚糖含量的变化
在两种水分条件下,小麦颖壳和不同节位的果聚糖含量随着小麦花后生育期推进,均呈不同程度先升后降的趋势(图1),但果聚糖含量峰值出现的时间因水分环境和花后天数的不同而异。在DS处理条件下,陇鉴19和Q 9086的果聚糖含量峰值出现时间(花后20 d)较WW处理的(花后25 d)提前5 d。颖壳、穗下节和倒二节的果聚糖含量在达到峰值前,DS处理显著高于对照(WW),陇鉴19显著高于Q 9086;在峰值后,处理间差异减小,但DS处理的更低。倒三节的果聚糖含量表现为WW处理显著高于DS;在达到峰值前,陇鉴19的果聚糖含量显著高于Q 9086,此后相反,且二者差异减小。从不同器官上看,倒二节的峰值较高(72.65~84.15 mg·g-1DW),穗下节次之(52.95~65.32 mg·g-1DW),颖壳(36.95~47.32 mg·g-1DW)和倒三节(33.22~40.29 mg·g-1DW)较小。以上结果说明,干旱胁迫能显著促进小麦主茎颖壳、穗下节和倒二节果聚糖含量峰值前的合成积累,促进峰值过后的降解转运,对抗旱品种陇鉴19的这种效应较水分敏感品种Q 9086更为显著。
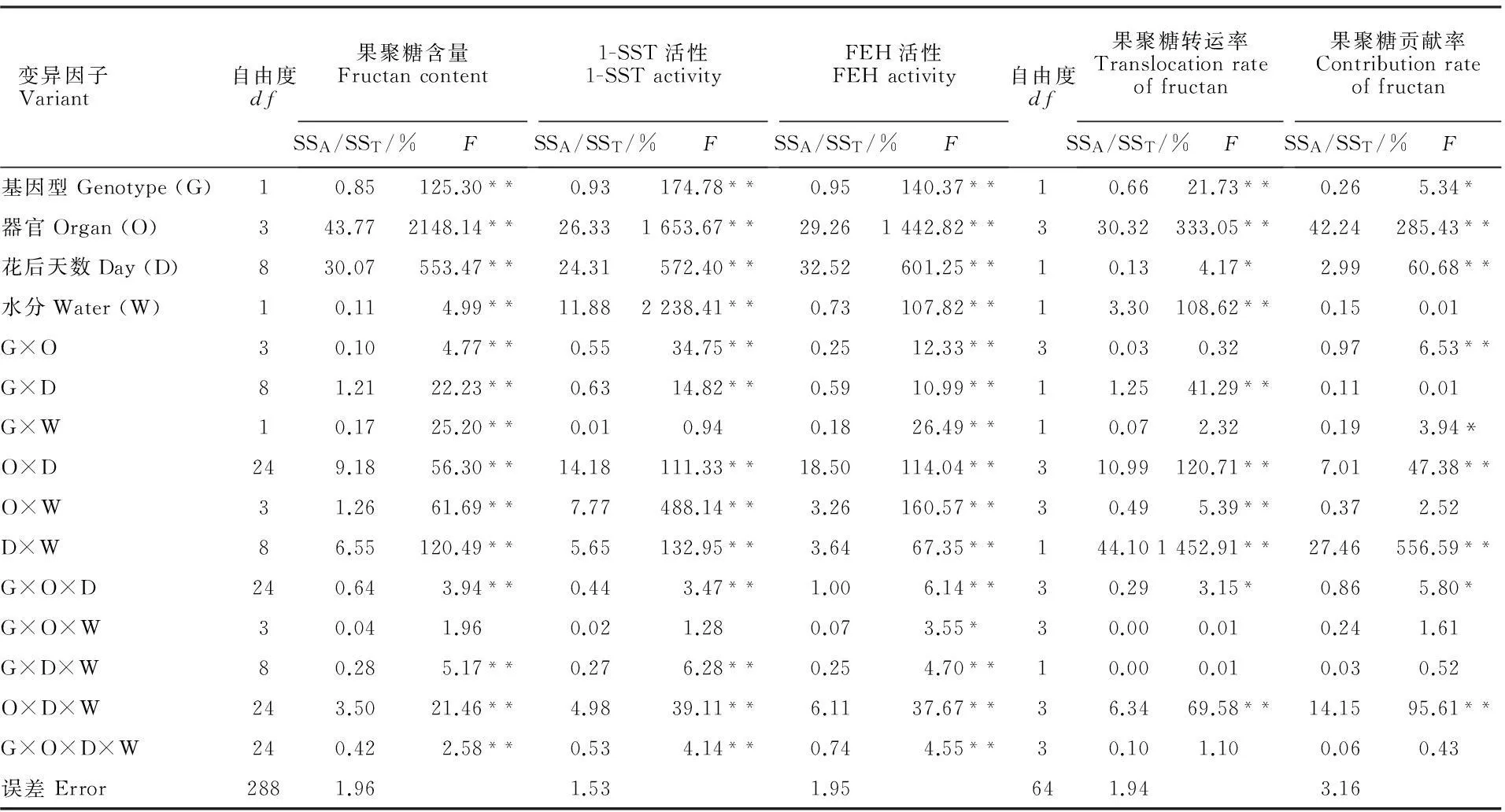
表1 小麦花后果聚糖代谢相关性状的方差分析
SSA/SST:各处理变异平方和(SSA)占总变异平方和(SST)的百分率;1-SST:蔗糖:蔗糖果糖基转移酶;FEH:果聚糖外水解酶。下同
SSA/SST:Percentage of mean square of every treatment variation (SSA) to total variation (SST); 1-SST: Sucrose/Sucrose 1-fructosyltransferase; FEH: Fructan exohydrolase. *:P≤0.05,**:P≤0.01. The same as following tables

DS: 干旱胁迫; WW: 正常灌溉; L: 陇鉴19; Q: Q 9086。下同
DS: Drought stress; WW: Well-watered; L: Longqian 19; Q: Q 9086. The same as following figures
图1不同水分条件下小麦花后不同器官果聚糖含量的变化
Fig.1Changes of fructan contents in different organs of wheat after anthesis under different water conditions
2.3小麦花后不同器官果聚糖代谢关键酶活性的变化
两种水分条件下,小麦颖壳和不同节位的1-SST酶活性差异显著(图2)。在WW处理条件下,两个小麦品种颖壳和穗下节的1-SST酶活性在花后15 d前均不同程度的缓慢上升,15 d后显著下降;在花后35 d失去酶活。两种水分处理下两个小麦品种的倒二节和倒三节、DS处理小麦的颖壳和穗下节的1-SST酶活性均随着花后天数的延长而急剧下降,器官、水分条件和品种不同,1-SST酶失活的时间不同,失活时间为花后10~30 d(图2)。整体看,WW处理小麦的1-SST酶活性显著高于DS处理,陇鉴19显著高于Q 9086;随着器官位置的降低,1-SST酶活性显著下降。以上结果说明,干旱胁迫能显著抑制小麦1-SST酶活性,这种抑制效应因基因型、器官位置和花后天数而异。
从图3可看出,小麦不同器官的FEH与1-SST酶活性有较大差异。两种水分条件下,两个小麦品种颖壳和穗下节的FEH酶活性、WW处理下的倒二节FEH酶活性均随花后时间的推移呈不同程度的先升后降趋势,颖壳和穗下节在DS处理下花后15~20 d、WW处理下25 d达到峰值,在花后30~35 d失去酶活。DS处理倒二节和倒三节、WW处理倒三节的FEH酶活性均随着生育期延长而急剧下降,下降幅度因器官、水分和小麦品种不同存在显著差异,在花后10~30 d失去酶活性。从整体来看,颖壳和穗下节的FEH酶活性在花后20 d前,DS处理显著高于WW处理;随后DS处理的FEH活性快速下降,在花后30 d小于WW处理,但差异变小。倒二节和倒三节的FEH酶活性基本表现为WW处理高于DS,倒三节差异明显。陇鉴19的FEH酶活性整体显著高于Q 9086(倒二节除外)。推测在小麦灌浆早期,干旱胁迫能显著提高颖壳和穗下节的FEH酶活性,增强果聚糖分解代谢,灌浆后期该酶活性受到不同程度的抑制;FEH酶活性受基因型、器官位置和花后天数影响显著。
2.4小麦花后果聚糖代谢与籽粒灌浆的相关性
WW处理下,两个小麦品种主茎倒三节的果聚糖含量与FEH和1-SST酶活性无显著相关性,其他被测器官的果聚糖含量均与FEH和1-SST酶活性呈不同程度的正相关(表2)。颖壳、穗下节和倒二节果聚糖含量与FEH酶活性的相关性(r=0.24~0.94**)明显高于与1-SST酶活性的(r=0.06~0.68*)相关性。

图2 不同水分条件下小麦花后不同器官1-SST酶活性的变化
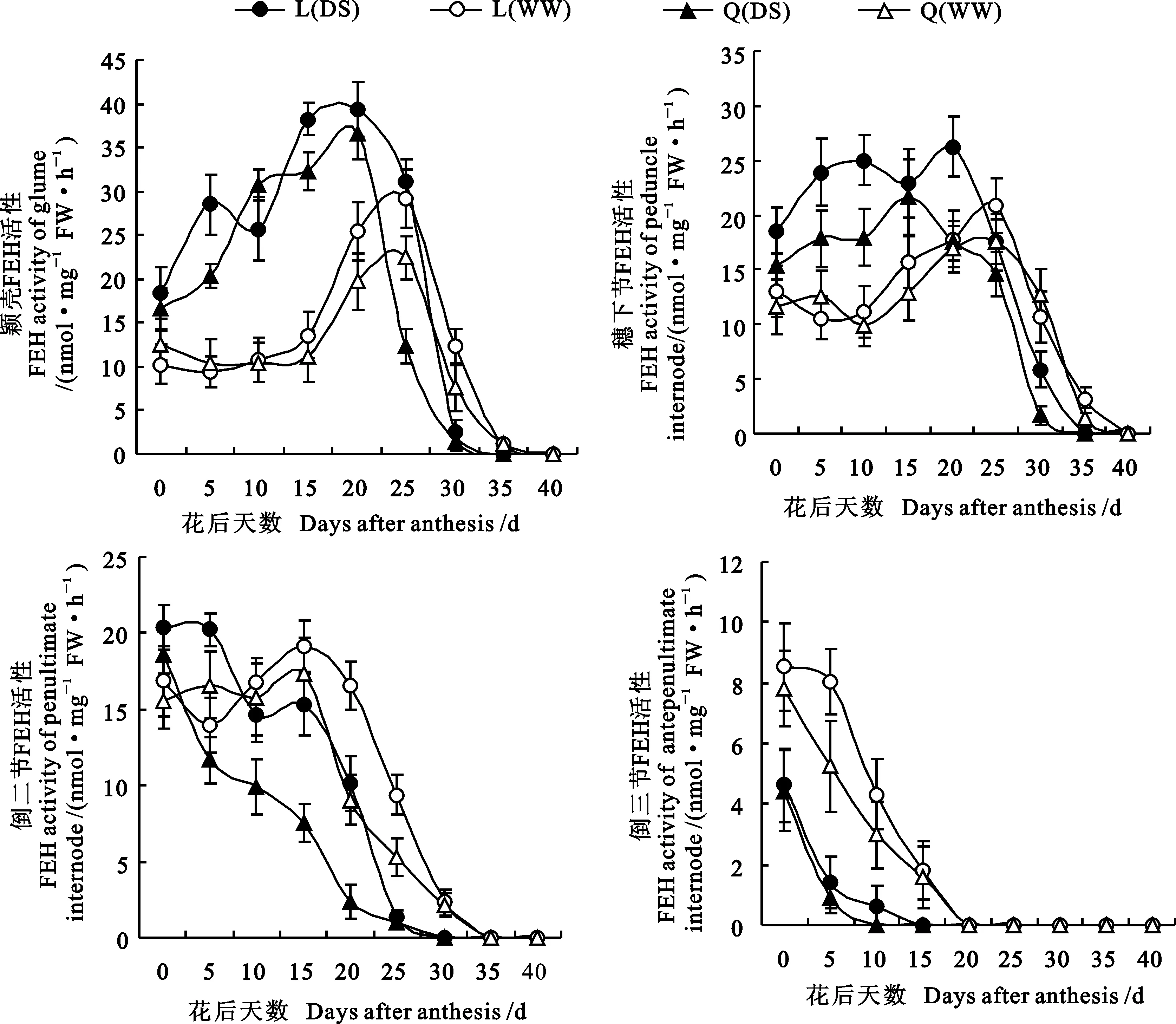
图3 不同水分条件下小麦花后不同器官FEH酶活性的变化
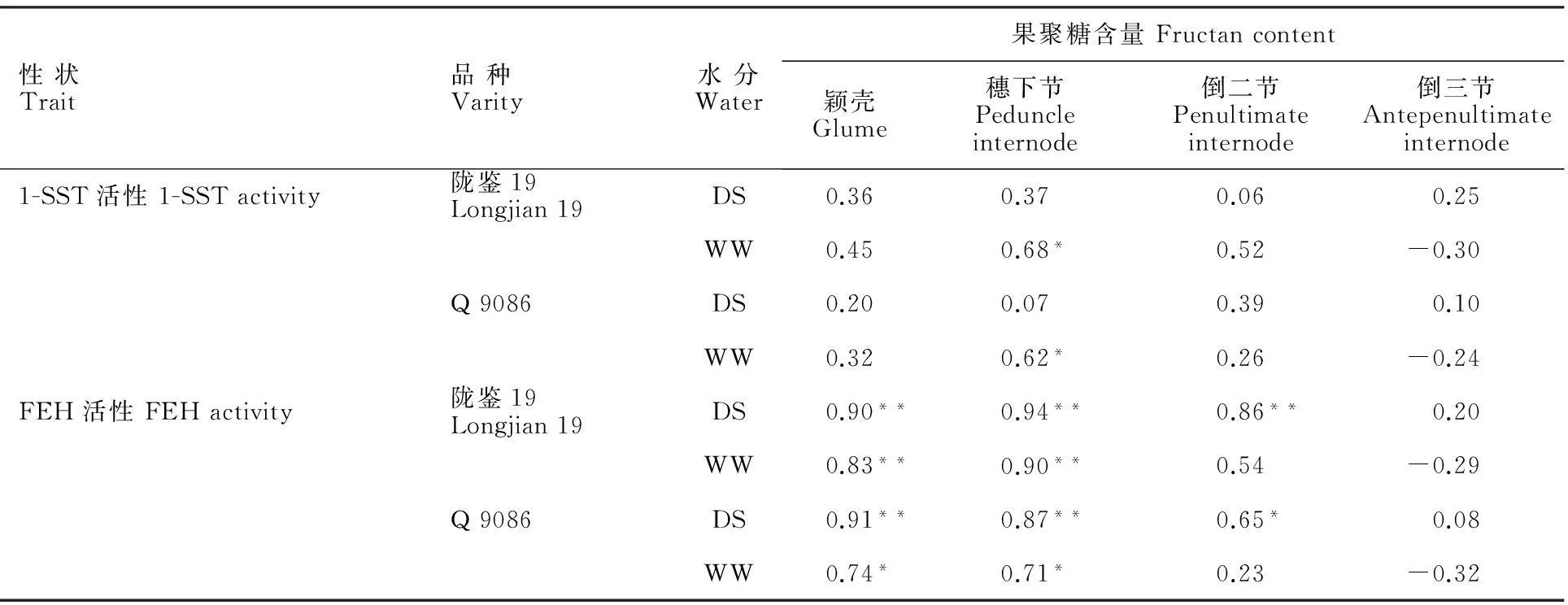
性状Trait品种Varity水分Water果聚糖含量Fructancontent颖壳Glume穗下节Peduncleinternode倒二节Penultimateinternode倒三节Antepenultimateinternode1-SST活性1-SSTactivity陇鉴19Longjian19DS0.360.370.060.25WW0.450.68*0.52-0.30Q9086DS0.200.070.390.10WW0.320.62*0.26-0.24FEH活性FEHactivity陇鉴19Longjian19DS0.90**0.94**0.86**0.20WW0.83**0.90**0.54-0.29Q9086DS0.91**0.87**0.65*0.08WW0.74*0.71*0.23-0.32
在DS处理下,颖壳、穗下节和倒二节果聚糖含量与FEH酶活性的相关性(r=0.65*~0.94**)明显高于WW处理(r=0.23~0.90**),但与1-SST酶活性的相关性却表现为WW处理(r=0.26~0.68*)明显高于DS(r=0.06~0.39)。就灌浆期不同器官果聚糖含量与FEH、1-SST酶活性间的相关性而言,陇鉴19普遍高于Q 9086。由此说明,在干旱胁迫条件下,小麦花后不同器官果聚糖含量与FEH活性密切相关,这种相关性在抗旱品种陇鉴19中更为突出。
在两种水分条件下,小麦粒重与花后不同器官果聚糖含量、1-SST活性和FEH活性呈不同程度的负相关(表3)。其中,DS处理下各性状间的相关系数(r=-0.27~-0.99**)显著高于WW(r=-0.02~-0.87**)。两品种不同器官1-SST活性,以及倒二节和倒三节FEH活性分别与小麦粒重表现为显著或极显著的相关性,相关系数(r=-0.66*~-0.99**)显著高于其他性状。倒二节和倒三节的1-SST活性与灌浆速率呈不显著的负相关,其余处理与灌浆速率均呈不同程度的正相关。不同器官的果聚糖含量、颖壳和穗下节的FEH活性与灌浆速率呈显著或极显著的相关性;相关系数普遍表现为DS处理(r=0.72*~0.98**)明显高于WW(r=0.66*~0.83**)处理。由此说明,在干旱胁迫条件下,粒重更多地取决于主茎不同器官1-SST活性、倒二节和倒三节的FEH活性;而灌浆速率更多地取决于不同器官的果聚糖含量、颖壳和穗下节的FEH活性。
2.5小麦花后不同器官的果聚糖转运对粒重的贡献率
在不同水分处理条件下,两个小麦品种不同器官花前和花后的果聚糖转运率及其对粒重的贡献率有显著差异,果聚糖转运率为2.72%~70.52%(图4),对粒重的贡献率为0.07%~4.93%(图5)。在DS处理下,两个小麦品种不同器官花前的果聚糖转运率和对粒重贡献率显著高于花后(Q 9086的颖壳果聚糖转运率除外)。WW处理下,两个小麦品种花后果聚糖转运率和对粒重的贡献率普遍高于花前。陇鉴19不同器官花前果聚糖转运率和对粒重的贡献率显著高于Q 9086。两个小麦品种不同器官花前和花后的果聚糖转运率差异显著,穗下节和倒二节果聚糖转运率(6.86%~70.52%)和贡献率(0.31%~4.93%)明显高于颖壳(8.30%~48.20%、0.14%~1.06%)和倒三节(2.72%~24.31%、0.07%~0.83%)。
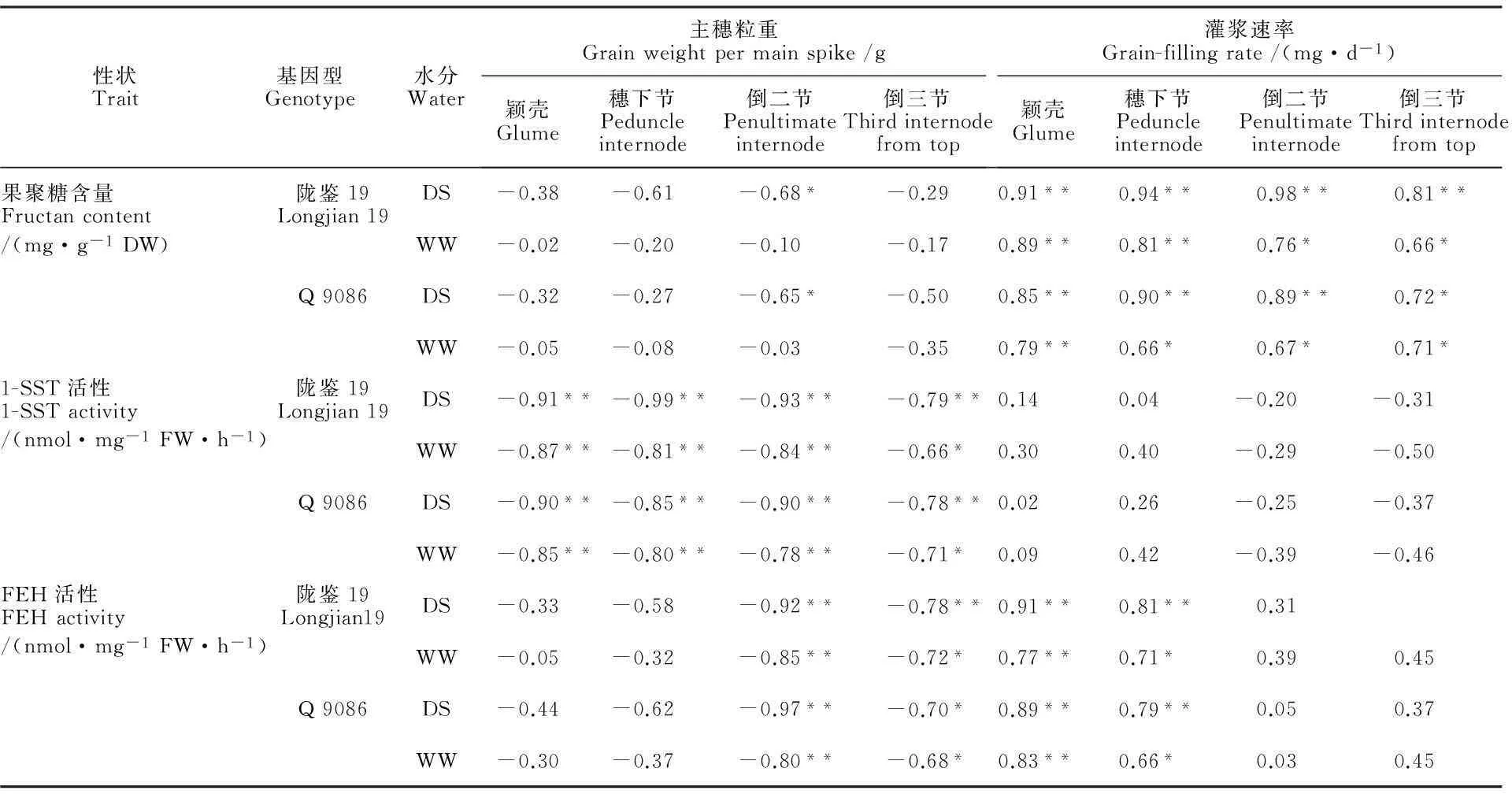
表3 不同水分条件下小麦花后不同器官果聚糖代谢相关性状与主穗粒重和灌浆速率的相关性
3讨 论
果聚糖是小麦营养器官中暂贮性WSC的重要存在形式[2-3],二者含量变化在小麦生育后期基本同步,呈显著正相关[31]。果聚糖的含量可直接反映营养器官蓄积贮藏WSC的能力[3],其代谢对调节小麦生长发育[16,19-21],促进籽粒灌浆和产量形成具有重要作用[3,22-23]。然而,小麦果聚糖代谢转运是一个复杂的生理过程,受自身生长节律和外部因子的调控[15,22]。本研究发现,小麦灌浆期果聚糖代谢转运受基因型、器官、花后天数和水分环境及各因子互作显著或极显著影响,其中,器官和花后天数是影响果聚糖含量、1-SST和FEH活性的主要因素;器官、花后天数与水分互作是影响果聚糖转运率和贡献率主要因素。与小麦灌浆期营养器官WSC积累规律相似[4,27]。研究发现,高产[2,23]、抗性较强[12]的小麦灌浆期高节位茎秆具有较高的果聚糖含量和输出能力[2-3],施用适量的氮肥[2,22-23]或给予适宜的胁迫条件[3,20,22]能显著提高果聚糖含量和转运率,这种效应与基因型、环境、基因型×环境互作显著相关。由此说明,小麦果聚糖代谢转运可能通过一定的表达调控,协调内外因子以最大限度适应环境,维系小麦正常发育和产量形成。
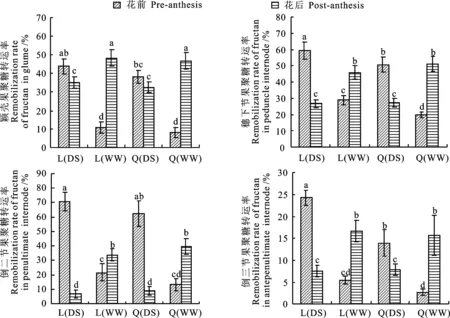
图中不同小写字母表示处理间差异显著(P<0.05)。下同
Different small letters mean significant difference among different treatments (P<0.05).The smae as below
图4不同水分条件下小麦不同器官花前和花后果聚糖的转运率
Fig.4Translocation rate of fructan in different organs during the pre- and
post-anthesis under different water conditions
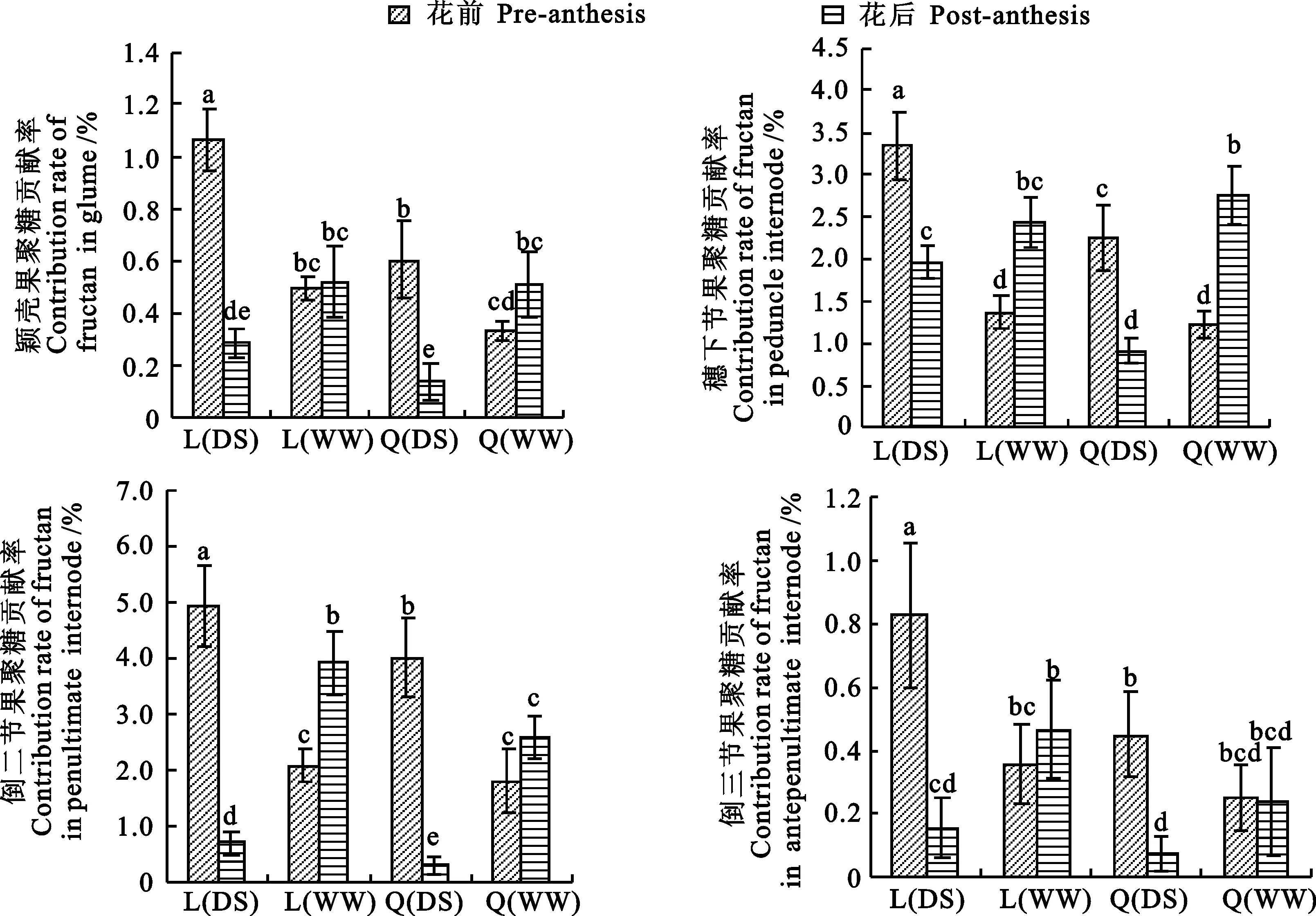
图5 不同水分条件下小麦不同器官花前和花后果聚糖的贡献率
前人就小麦整个茎秆水平的研究发现,干旱胁迫可加速小麦灌浆初期茎秆的果聚糖积累[3,15,23],其含量比正常灌溉提高2.5倍[32];并促进籽粒灌浆中后期茎秆果聚糖降解[3,22,32]。研究者认为此过程可有效提高小麦植株抗旱能力,降低干旱胁迫诱发的过氧化伤害[15,21];籽粒灌浆中后期茎秆果聚糖的快速降解,可释放大量的蔗糖,促进其向籽粒转运,为小麦籽粒灌浆提供一种“源足流畅”的有利格局[3,16,22]。本研究也得到类似结果,并且发现,干旱胁迫显著缩短了陇鉴19和Q 9086不同器官果聚糖含量峰值出现的时间(提前5 d);干旱胁迫对果聚糖“先促积累、后促降解”效应在颖壳、穗下节和倒二节中更显著,抗旱品种陇鉴19较水分敏感品种Q 9086表明更明显。在灌浆期,正常灌溉条件下小麦颖壳和穗下节的1-SST活性、两种水分条件下的颖壳和穗下节的FEH活性、正常灌溉条件下的倒二节的FEH活性均与果聚糖含量变化趋势较为一致,呈不同程度的正相关性。整体上,干旱胁迫能显著抑制小麦1-SST酶活性,显著提高FEH酶活性。陇鉴19的1-SST和FEH酶活性普遍高于Q 9086,与Yang等[22]的研究结果相同。由此说明,1-SST和FEH酶对小麦灌浆期果聚糖代谢具重要调控作用,干旱胁迫抑制1-SST酶活性和提高FEH酶活性,可能更有利于茎秆果聚糖在灌浆期的分解,使降解产物向籽粒转运。
小麦籽粒灌浆的碳源主要来源于营养器官花前和花后暂贮性WSC[2-4],依据基因型和水分环境的不同,二者对籽粒产量的贡献率为3%~92%[5-6,10],尤其在干旱胁迫条件下,小麦营养器官花前暂贮性WSC对籽粒灌浆尤为重要[7-9],在一定程度上表现出WSC含量[3,31,33]、WSC转运率[4,27]与籽粒产量呈显著的正相关。本研究中,不同处理小麦的果聚糖转运率为2.72%~70.52%,对籽粒的贡献率在0.29%~4.93%之间。在干旱胁迫条件下,不同器官花前果聚糖转运率和贡献率普遍高于花后,抗旱品种陇鉴19高于Q 9086,穗下节和倒二节高于颖壳和倒三节。这与前人在干旱调控小麦灌浆期WSC[4,27]和干物质[34]积累转运和再分配的结论一致。本研究发现,小麦灌浆期不同器官果聚糖代谢均与粒重负相关,与灌浆速率正相关。在干旱胁迫条件下,小麦灌浆速率与果聚糖含量、颖壳和穗下节的FEH活性呈显著或极显著的正相关,粒重与1-SST活性、倒二节和倒三节的FEH活性呈显著或极显著的负相关。该研究结果是对前人基于干旱调控小麦灌浆期营养器官暂贮性WSC积累、转运以补偿籽粒灌浆机制的补充,同时也充分说明了小麦果聚糖代谢导致的碳素在营养器官向生殖器官转运和再分配的生理调控复杂性。
参考文献:
[1]Borrás L,Slafer G A,Otegui M E.Seed dry weight response to source-sink manipulations in wheat,maize and soybean:a quantitative reappraisal [J].FieldCropsResearch,2004,86:131-146.
[2]姜 东,于振文,李永庚,等.高产冬小麦茎中果聚糖代谢及氮素水平的调控[J].作物学报,2002,28(1):79-85.
Jiang D,Yu Z W,Li Y G,etal.Study on fructans metabolism in stems of high-yielding winter wheat and effects of nitrogen levels applied on fructans metabolism [J].ActaAgronomicaSinica,2002,28(1):79-85.
[3]孟维伟,褚鹏飞,于振文,等.灌水对不同品种小麦茎和叶鞘糖含量及产量的影响[J].应用生态学报,2011,22(10):2487-2494.
Meng W W,Chu P F,Yu Z W,etal.Effects of irrigation on the water soluble carbohydrate contents in different wheat cultivars stem and sheath and the grain yield [J].ChineseJournalofAppliedEcology,2011,22(10):2487-2494.
[4]马召朋,栗孟飞,杨德龙,等.不同水分条件下冬小麦灌浆期茎叶可溶性碳水化合物积累转运与籽粒灌浆的关系[J].草业学报,2014,23(4):68-78.
Ma Z P,Li M F,Yang D L,etal.Relationship between grain filling and accumulation and remobilization of water soluble carbohydrates in leaf and stem of winter wheat during the grain filling in different water conditions [J].ActaPrataculturaeSinica,2014,23(4):68-78.
[5]Kuhbauch W,Thome U.Nonstructural carbohydrates of wheat stems as influenced by sink-source manipulations [J].JournalPlantPhysiology,1989,134:243-250.
[6]Pheloung P C,Siddique K H M.Gibberllins and reproductive development in seed plants [J].AnnualReviewPlantPhysiology,1985,36:517- 568.
[7]Blum A.Improving wheat grain filling under stress by stem reserve mobilization [J].Euphytica,1998,100:77-83.
[8]Ehdaie B,Alloush G A,Madore M A,etal.Genotypic variation for stem reserves and mobilization in wheat.I.Postanthesis changes in internode dry matter [J].CropScience,2006,46:735-746.
[9]Ehdaie B,Alloush G A,Madore M A,etal.Genotypic variation for stem reserves and mobilization in wheat:II.postanthesis changes in internode water-soluble carbohydrates [J].CropScience,2006,46:2093-2103.
[10]Gupta A K,Kaur K,Kaur N.Stem reserve mobilization and sink activity in wheat under drought conditions [J].AmericanJournalofPlantSciences,2011,2:70-77.
[11]Yang J C,Zhang J H.Grain filling of cereals under soil drying (Tansley review) [J].NewPhytologist,2006,169:223-236.
[12]Zhang J,Dell B,Conocono E,etal.Water deficits in wheat:fructan exohydrolase (1-FEH) mRNA expression and relationship to soluble carbohydrate concentrations in two varieties [J].NewPhytologist,2009,181:843-850.
[13]樊廷录,马明生,王淑英,等.限量灌溉不同品种冬小麦茎可溶性糖与产量和水分利用率的关系[J].中国农业科学,2010,43(12):2428-2434.
Fan T L,Ma M S,Wang S Y,etal.A study on the relatiaonship between stem soluble sugar with grain yield and water use efficiency in different winter wheat under limited irrigation condition [J].ScientiaAgriculturaSinica,2010,43(12):2428-2434.
[14]韩占江,于振文,王 东,等.测墒补灌对冬小麦干物质积累与分配及水分利用效率的影响[J].作物学报,2010,36(3):457-465.
Han Z J,Yu Z W,Wang D,etal.Effects of supplemental irrigation based on testing soil moisture on dry matter accumulation and distribution and water use efficiency in winter wheat [J].ActaAgronomicaSinica,2010,36(3):457-465.
[15]Kerepesi I,Bányai S,Galiba G.Fructans in wheat under stress conditions [J].ActaBiologicaSzegediensis,2002,46:101-102.
[16]Verspreet J,Cimini S,Vergauwen R,etal.Fructan metabolism in developing wheat (TriticumaestivumL.) kernels [J].PlantCellPhysiology,2013,54:2047-2057.
[17]Turner L B,Cairns A J,Armstead I P,etal.Does fructan have a functional role in physiological traits investigation by quantitative trait locus mapping [J].NewPhytologist,2008,179:765-776.
[18]Winzeler M,Dubois D,Nosberger J.Absence of fructan degradation during fructan accumulation in wheat stems [J].JouralPlantPhysiology,1990,136:324-329.
[19]Yoshida M,Abe J,Moriyama M,etal.Carbohydrate levels among winter wheat cultivars varying in freezing tolerance and snow mold resistance during autumn and winter [J].PhysiologiaPlantarum,1998,103:8-16.
[20]Peshev D,Vergauwen R,Moglia A,etal.Towards understanding vacuolar antioxidant mechanisms:a role for fructans [J].JournalofExperimentalBotany,2013,64:1025-1038.
[21]Wardlaw I F,Willenbrink J.Mobilization of fructan reserves and changes in enzyme activities in wheat stems correlate with water stress during kernel filling [J].NewPhytologist,2000,148:413-422.
[22]Yang J,Zhang J,Wang Z,etal.Activities of fructan- and sucrose-metabolizing enzymes in wheat stems subjected to water stress during grain filling [J].Planta,2004,220:331-343.
[23]赵万春,董 剑,高 翔,等.氮肥对杂交小麦果聚糖积累与转运及其杂种优势的影响[J].作物学报,2006,32(4):607-612.
Zhao W C,Dong J,Gao X,etal.Effects of nitrogen fertilizer on fructan accumulation,translocation and their heterosis in hybrid wheat [J].ActaAgronomicaSinica,2006,32(4):607-612.
[24]Ruuska S A,Rebetzke G J,Herwaarden A F,etal.Genotypic variation in water-soluble carbohydrate accumulation in wheat [J].FunctionalPlantBiology,2006,33:799-809.
[25]Huynh B L,Palmer L,Mather D E,etal.Genotypic variation in wheat grain fructan content revealed by a simplified HPLC method [J].JournalofCerealScience,2008,48:369-378.
[26]杨德龙,张国宏,李兴茂,等.小麦重组近交系群体株高和千粒重的抗旱遗传特性[J].应用生态学报,2012,23(6):1569-1576.
Yang D L,Zhang G H,Li X M,etal.Genetic characteristics associated with drought tolerance of plant height and thousand-grain mass of recombinant inbred lines of wheat [J].ChineseJournalofAppliedEcology,2012,23(6):1569-1576.
[27]李 丽,杨德龙,栗孟飞,等.不同水分条件下源库调节对小麦营养器官WSC及籽粒千粒重的影响[J].应用生态学报,2013,24(7):1879-1888.
Li L,Yang D L,Li M F,etal.Effects of source-sink regulation on WSC in vegetative organs and thousand-grain mass of wheat under different water conditions[J].ChineseJournalofAppliedEcology,2013,24(7):1879-1888.
[28]胡亮亮,叶亚琼,吕婷婷,等.不同水分环境下小麦粒重QTL定位及遗传分析[J].草业学报,2015,24(8):118-129.
Hu L L Ye Y Q,Lv T T,etal.QTL mapping and genetic analysis for grain weight in wheat (TriticumaestivumL.) under different water environments [J].ActaPrataculturaeSinica,2015,24(8):118-129.
[29]张海艳,董树亭,高荣岐,等.玉米籽粒淀粉积累及相关酶活性分析[J].中国农业科学,2008,41(7):2174-2181.
Zhang H Y,Dong S T,Gao R Q,etal.Starch accumulation and enzymes activities associated with starch synthesis in maize kernels [J].ScientiaAgriculturaSinica,2008,41(7):2174-2181.
[30]常 磊,柴守玺,杨德龙,等.我国旱地春小麦产量及主要农艺指标的变异分析[J].应用生态学报,2010,21(11):2821-2829.
Chang L,Chai S X,Yang D L,etal.Variation analysis on the grain yield and main agronomic traits of spring wheat in rainfed regions of China [J].ChineseJournalofAppliedEcology,2010,21(11):2821-2829.
[31]Xue G P,McIntyre C L,Jenkins C L D,etal.Molecular dissection of variation in carbohydrate metabolism related to water-soluble carbohydrate accumulation in stems of wheat[J].PlantPhysiology,2008,146:441-454.
[32]Goggin D E,Setter T L.Fructosyltransferase activity and fructan accumulation during development in wheat exposed to terminal drought [J].FunctionalPlantBiology,2004,31:11-21.
[33]Rebetzke G J,Herwaarden A F,Jenkins C,etal.Quantitative trait loci for soluble stem carbohydrate production in wheat [J].AustralianJournalofAgriculturalResearch,2008,59:891-905.
[34]Ma J,Huang G B,Yang D L,etal.Dry matter remobilization and compensatory effects in various internodes of spring wheat under water stress [J].CropScience,2014,54:331-339.
Effect of Drought Stress on Fructan Metabolism and Translocation in Different Organs of Wheat after Anthesis
YANG Delong1, LI Mengfei1, LIU Yuan1, CHENG Hongbo1, CHANG Lei2, CHAI Shouxi2
(1.Gansu Provincial Key Lab of Aridland Crop Science/College of Life Science and Technology,Gansu Agricultural University, Lanzhou, Gansu 730070, China; 2.College of Agronomy,Gansu Agricultural University, Lanzhou,Gunsu 730070, China)
Abstract:In order to reveal the influences of drought stress on fructan metabolism and translocation in different organs of wheat in the duration of post-anthesis, two winter wheat cultivars with different drought tolerance were used to investigate the dynamic rule of fructan metabolism, along with its relationship with grain filling in glume of main spike and different internodes of main stems after flowering under drought stress (DS) and well watered (WW) conditions.Results showed that fructan metabolism and translocation of different organs of wheat in filling stage were significantly affected by the genotype, water condition, organ, day after anthesis, and interactions between these factors. Especially, such factors as organ and day after anthesis, and interactions of day after anthesis with water condition were more critical to modulate the fructan metabolism and translocation. The fructan content of different organs were all rise first and then fall during the grain filling. Compared to the WW, DS could shorten the peak appearance of fructan content by five days.To fructan content, DS promoted its accumulation first, and then boosted its degradation.This effects were more remarkable in the drought cultivar Longjian 19, and in glumes, peduncle and penultimate internodes. DS observably inhibited the activity of sucrose:sucrose 1-fructosyltransferase (1-SST),but significantly enhanced the activity of fructan exohydrolase (FEH) during the grain filling. The fructan content showed higher positive correlation with the FEH activity. Furthermore, significantly negative correlations were observed between the grain weight with the 1-SST activity in different organs and the FEH activity in the penultimate internode and third internode,whereas the positive correlations were indicted between the grain-filling rate in different organs, the fructan content and the FEH activity in glume and peduncle internode. DS could markedly improve the translocation and reallocation of fructan. In this case, fructan translocation rate and contribution rate to grain ranged from 6.86% to 70.52%, and from 0.07% to 4.93%, respectively, of which before anthesis were significantly higher than those after anthesis, in Longjian 19 than in Q 9086, and in peduncle and penultimate internodes than in glumes and third internodes from the top as well.
Key words:Wheat (Triticum aestivum); Drought stress; Fructan metabolism; Accumulation and translocation; Grain filling
中图分类号:S512.1;S311
文献标识码:A
文章编号:1009-1041(2016)02-0190-10
基金项目:国家自然科学基金项目(31460348, 30960195);陇原青年创新人才扶持计划项目;甘肃省农业生物技术研究与应用开发项目(GNSW-2015-18);甘肃农业大学“伏羲人才”计划项目(FXRC20130102)
收稿日期:2015-10-09修回日期:2015-11-19
网络出版时间:2016-01-26
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160126.1945.020.html
第一作者E-mail:yangdl@gsau.edu.cn
