小麦籽粒DNA提取方法的比较及SSR反应体系的优化研究
2016-05-27丁海燕
丁海燕,丁 晨
(大庆师范学院生物工程学院,黑龙江大庆 163712)
小麦籽粒DNA提取方法的比较及SSR反应体系的优化研究
丁海燕,丁 晨
(大庆师范学院生物工程学院,黑龙江大庆 163712)
摘要:为了快速获得较高质量的DNA用于SSR分析,并建立一套稳定的SSR反应体系,以小麦单粒干种子为材料,比较了CTAB法和SDS法获得的DNA条带清晰度和RNA残留带的清晰度;同时,研究了模板DNA浓度、引物浓度、dNTPs浓度以及Taq酶用量对SSR结果的影响。结果表明,CTAB法微量提取小麦干种子DNA可获得理想的扩增结果;SSR的最佳反应体系是:模板DNA浓度为4.0~4.8 ng·μL-1,Taq酶用量为1 U,引物浓度为50~200 nmol·L-1,dNTPs浓度为50~500 μmol·L-1。
关键词:小麦;种子;CTAB法;SDS法;SSR
小麦SSR位点多,多态性丰富[1],被广泛应用于小麦及其近缘物种的遗传作图[2]、小麦遗传多样性研究和核心种质的构建[3]。SSR系谱分析能准确地鉴别大量等位基因,适合于区分同一物种的不同基因型,特别是亲缘关系非常近、而其他方法无法区分的品种或种质材料[4]。Lrlley等[5]利用小麦基因组的42条染色体的42对SSR标记分析了来自匈牙利、澳地利和德国的各20个小麦品种,用3个基因组中的1组SSR标记就可以清晰地将来自3个不同地方的小麦品种区分开来。此外,SSR标记为鉴定小麦及其外源染色体提供了新的途径[6]。舒焕麟等[7]利用黑麦SSR引物SCM-9、SCM-39、SCM-102以及小麦SSR引物Xgwm-106对来源于小麦-黑麦杂交组合的3个材料进行了分析,结果表明,这3个材料均为1R/1D代换系并伴有3RS的小片段插入。而SSR技术对反应条件要求比较严格[8],模板DNA质量、退火温度和引物浓度等是影响SSR扩增的重要因素。杨俊宝等[9]研究了从种子中获得的DNA对SSR扩增的影响,结果表明,从小麦干种子中快速获得的总DNA、产量和质量均适合进行SSR分析;代 芳等[10]探究了退火温度对小麦SSR的影响,结果表明,每对引物都有其合适的退火温度。李 勇等[11]探索了模板DNA、dNTPs和引物等对小麦SSR的影响,结果发现,对PCR扩增结果影响最显著的有引物、Mg2+和TaqDNA聚合酶。但目前,以小麦种子为材料,采用CTAB法和SDS法所提取的DNA不经RNA酶处理直接用于SSR-PCR扩增的研究尚未见报道。鉴于此,本研究以小麦单粒干种子为材料,对提取DNA的两种主要方法进行比较;同时,对影响SSR结果的模板DNA浓度、引物浓度、dNTPs浓度以及Taq酶用量进行探讨,旨在建立一套适合小麦SSR分析的最佳反应体系。
1材料与方法
1.1材 料
供试材料为普通小麦中国春,由哈尔滨师范大学遗传实验室提供。
1.2DNA提取方法
1.2.1CTAB 法
取一粒小麦干种子,放入经-20 ℃冰箱冷冻过的研钵内,加入适量液氮研成粉末,分装于1.5 mL离心管,加入700 μL已预热到65 ℃的2×CTAB提取液(2%CTAB;1.4 mol·L-1NaCl;10 mmol·L-1Tris-HCl,pH 8.0;20 mmol·L-1EDTA)。置65 ℃水浴中保温50 min,不时轻轻倒转离心管以混匀。从水浴中取出离心管,冰上冷却5 min,加入等体积的酚-氯仿-异戊醇(酚∶氯仿∶异戊醇=25∶24∶1)抽提,轻轻混匀20 min。13 000 r·min-1离心10 min,取上清液。再次加入等体积酚-氯仿-异戊醇,轻轻混匀20 min。13 000 r·min-1离心10 min,取上清液,加入等体积径-20 ℃冰箱预冷的异丙醇,轻轻混匀,置-20 ℃冰箱30 min,13 000 r·min-1离心10 min,弃上清液,70%酒精冲洗2次,稍气干(空气干燥),溶于30 μL 1×TE中,测DNA 浓度,并经琼脂糖凝胶电泳检测DNA质量。
1.2.2SDS法
取一粒小麦干种子,放入经-20 ℃冰箱冷冻过的研钵内,加入适量液氮研成粉末,分装于1.5 mL离心管,加入700 μL已预热到65 ℃的提取缓冲液(100 mmol·L-1Tris-HCl,pH 8.0;50 mmol·L-1EDTA,pH 8.0;500 mmol·L-1NaCl;10 mmol·L-1β-巯基乙醇,此成分是以上成分混合灭菌后加入),轻轻混匀。加入20%SDS裂解液,混匀后65 ℃水浴保温30 min,不时轻轻倒转离心管以混匀。从水浴中取出离心管,加入140 μL 5 mol·L-1醋酸钾,混匀置冰上20 min,13 000 r·min-1离心10 min。取上清液加入等体积的氯仿-异戊醇(氯仿∶异戊醇=24∶1)抽提,混匀,13 000 r·min-1离心10 min。取上清液加入等体积经-20 ℃冰箱预冷的异丙醇,置-20 ℃冰箱30 min沉淀DNA,13 000 r·min-1离心10 min。倒掉上清液,用70%酒精清洗2次,气干,溶于30 μL 1×TE中,测DNA浓度,并经琼脂糖凝胶电泳检测DNA质量。
1.3SSR反应
1.3.1引 物
选用Saal等[12]所用引物Xgwm212、Xgwm114和Xgwm205,并交由大连宝生物公司合成。
1.3.2反应体系和反应程序
SSR程序优化研究中,DNA浓度、引物浓度、Taq酶用量和dNTPs浓度分别设置5个梯度。其中,DNA浓度分别为1.6、2.4、3.2、4.0和4.8 ng·μL-1;引物浓度分别为50、70、100、200和500 nmol·L-1;Taq酶用量分别为0.5、1.0、1.5、2.0和3.0 U;dNTPs浓度分别为50、100、200、300和500 μmol· L-1。PCR程序:95 ℃预变性5 min;95 ℃变性1 min,50 ℃/55 ℃/60 ℃退火30 s(退火温度因引物不同而异[13]),72 ℃延伸1 min,40个循环[14];72 ℃延伸10 min。反应在Cene 9700 PCR仪上进行[15],扩增产物在 6%非变性聚丙烯酰胺凝胶上稳压120 V电泳,银染显色,然后用Umax型扫描仪扫描观察。
2结果与分析
2.1不同DNA提取方法对扩增结果的影响
由图1、图2可知,CTAB法得到的DNA条带整齐且清晰,虽然有RNA带残留,但是RNA带比较弱,这种方法获得的DNA可以直接用于PCR扩增,效果比较理想;而SDS法得到的DNA,除DNA带清晰外,RNA带也很亮很强,因此这种方法获得的DNA需去除RNA,才能用于PCR扩增。此外,SDS法试验结果稳定性差,虽然图中1~6点样孔加样量均为15 μL,且均是单次试验获得的DNA,但SDS法三次重复效果差异较大。

1、2和3:SDS法所提取的DNA;4、5和6:CTAB法所提取的DNA
1, 2 and 3: DNA extracted with SDS method; 4, 5 and 6: DNA extracted with CTAB method
图1不同方法提取的DNA
Fig.1DNA extraction with different methods
2.2SSR反应体系的优化
利用CTAB法获得的DNA对SSR反应体系进行了优化,结果如图3所示。当Taq酶用量为1 U、引物浓度为50 nmol·L-1及dNTPs浓度为50 μmol·L-1时,模板DNA浓度为3.2、4.0和4.8 ng·μL-1时均可扩增出清晰的条带,而模板DNA浓度为1.6和2.4 ng·μL-1时并未扩增出特异性条带。当模板DNA浓度为4.0 ng·μL-1、Taq酶用量为1 U及dNTPs浓度为50μmol·L-1时,引物浓度为50、70、100和200nmol·L-1时均可扩增出清晰的条带,而当引物浓度为500 nmol·L-1时,扩增条带不清晰;当模板DNA浓度为4.0 ng·μL-1、Taq酶用量为1 U及引物浓度为50 nmol·L-1时,dNTPs在所有浓度梯度均可扩增出清晰条带;当模板DNA浓度为4.0 ng·μL-1、引物浓度为50 nmol·L-1及dNTPs浓度为50 μmol·L-1时,Taq酶在所有用量梯度也均能扩增出清晰条带。以上结果说明,模板DNA浓度和引物浓度对扩增结果影响较大。

1和2:以SDS法所提取的DNA为模板进行扩增的结果;3和4:以CTAB法所提取的DNA为模板进行扩增的结果
1 and 2: The fragments amplified with DNA extracted with SDS method; 3 and 4: The fragments amplified with DNA extracted with CTAB method
图2利用Xgwm205引物对不同提取方法
所提取DNA进行扩增的结果
Fig.2PCR amplification with Xgwm205 primer from
DNA extracted with different methods
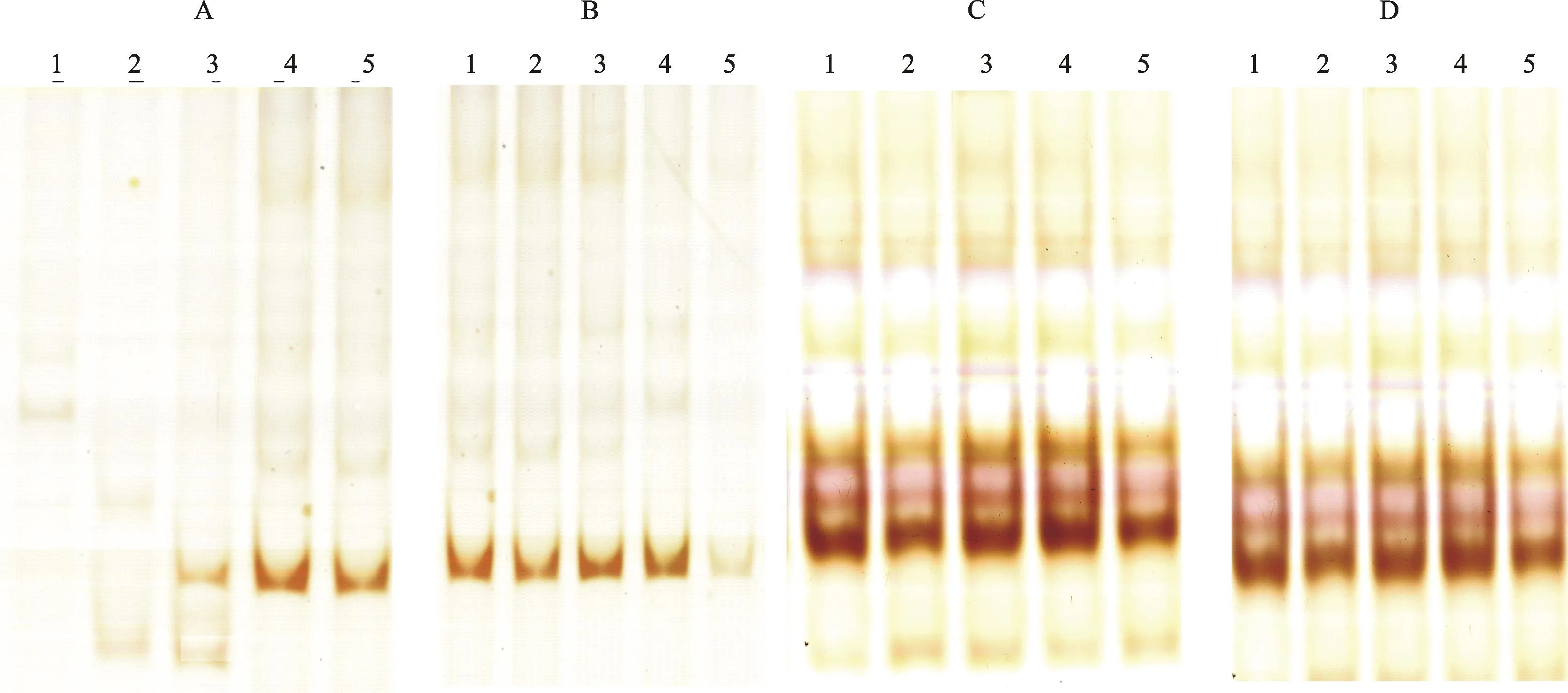
A图中1~5表示模板DNA浓度分别为1.6、2.4、3.2、4.0和4.8 ng·μL-1;B图中1~5表示引物浓度分别为50、70、100、200和500 nmol·L-1;C图中1~5表示dNTPs浓度分别为50、100、200、300和500 μmol·L-1;D图中1~5表示Taq酶用量分别为0.5、1.0、1.5、2.0和3.0 U;图A~D扩增所使用引物分别是Xgwm212、Xgwm212、Xgwm114和Xgwm114
1-5 in Fig.A repesented template DNA concentration as 1.6, 2.4, 3.2, 4.0 and 4.8 ng·μL-1, respectively; 1-5 in Fig.B repesented primer concentration as 50, 70, 100, 200 and 500 nmol·L-1, respectively; 1-5 in Fig.C repesented dNTPs concentration as 50, 100, 200, 300 and 500 μmol·L-1, respectively; 1-5 in Fig.D repesentedTaqenzyme concentration as 0.5, 1.0, 1.5, 2.0 and 3.0 U, respectively; The primers was Xgwm212 for Fig.A and B, and Xgwm114 for Fig.C and D, respectively
图3不同浓度或用量梯度的模板DNA(A)、引物(B)、dNTPs(C)和Taq酶(D)SSR扩增结果
Fig.3SSR amplification results with different concentrations or usage
of template DNA(A), primer(B), dNTPs(C) andTaqenzyme(D)
3讨 论
SSR分析对模板DNA质量要求较高,高质量DNA是试验结果可靠并具有良好重复性的保证。本研究的结果表明,CTAB法提取的DNA纯度高,SSR扩增效果好;SDS法步骤较简单,但DNA纯度低,扩增效果差。魏琦超等[16]利用CTAB法提取小麦干种子总DNA,试验结果也证明该法获得的DNA纯度较好,完全能够满足分子标记等分子生物学实验;旦 巴等[17]比较了CTAB法和SDS法提取西藏黄籽油菜干种子DNA,结果也表明CTAB法提取的DNA纯度更高、质量更好,更适用于SSR分析。另外,在PCR反应中,蛋白质、盐类、多糖及RNA干扰引物与模板结合,影响扩增效果。
模板浓度是SSR分析的一个制约因子,其浓度过低,没有扩增产物,但模板浓度在相当大的范围内不会影响SSR分析结果。引物浓度高,每次复性模板可被饱和结合,从本研究电泳图谱看带型丰富,但以加入适量为好。此外,本研究结果表明,dNTPs浓度和Taq酶用量对扩增产物影响不明显。当然,出于经济考虑,Taq酶以适量为好。
PCR中的诸多因素都会对其结果产生影响,所以在操作过程中应该严格控制试验条件,包括反应体系、试剂型号、试剂来源和反应程序等,保证其一致性,也是试验成功不可忽略的因素。
参考文献:
[1]倪中福,张义荣,梁荣奇,等.普通小麦D染色体组微卫星分子标记遗传差异研究 [J].作物学报,2003,29(1):145-151.
Ni Z F,Zhang Y R,Liang R Q,etal.Genetic diversity of D-genome revealed by SSR markers in wheat(TriticumaestivumL.) [J].ActaAgronomicaSinica,2003,29(1):145-151.
[2]景蕊莲,昌小平.SSR标记在小麦种质资源研究中的应用 [J].作物品种资源,1999(2):17-20.
Jing R L,Chang X P.Application of SSR markers in wheat germplasm resources [J].ChinaSeedIndustry,1999(2):17-20.
[3]武 军,王 辉,刘伟华,等.小麦新种质4844中外源P染色质的GISH与SSR分析 [J].西北植物学报,2006,26(6):1093-1097.
Wu J,Wang H,Liu W H,etal.GISH and SSR analysis of exogenous P chromatin in the new wheat germplasm 4844 [J].ActaBotanicaBoreali-OccidentaliaSinica,2006,26(6):1093-1097.
[4]郭光艳,李瑞芬,张敬原,等.利用SSR鉴定普通小麦-多枝赖草二体异附加系Line24中外源染色体同源群的归属 [J].华北农学报,2004,19(4):14-17.
Guo G Y,Li R F,Zhang J Y,etal.Identifying the homoeologous groups of the alien chromosomes ofTriticumaestivum-Leymusmulticaulis disomic chromosome addition line Line24 using SSR markers [J].ActaAgriculturaeBoreali-Sinica,2004,19(4):14-17.
[5]崔国惠,倪中福,刘志勇,等.利用微卫星分子标记对小麦杂种优势群III遗传多样性的研究 [J].农业生物技术学报,1999,7(4):333-338.
Cui G H,Ni Z F,Liu Z Y,etal.Stuy on wheat heterotic group III genetic diversity revealed by microsatellite marker in wheat [J].JournalofAgriculturalBiotechnology,1999,7(4):333-338.
[6]王黎明,林小虎,张平杰,等.小麦-中间偃麦草二体异代换系山农0095的选育及其鉴定 [J].中国农业科学,2005,38(10):1958-1964.
Wang L M,Lin X H,Zhang P J,etal.Breeding and characterization of wheat-Thinopyrumintermediumalien substitution line shannong 0095 [J].ScientiaAgriculturaSinica,2005,38(10):1958-1964.
[7]舒焕麟,杨足君,李光蓉.几个具黑麦遗传物质的小麦材料的遗传分析 [J].四川农业大学学报,2000,18(3):223-227.
Shu H L,Yang Z J,Li G R.Genetic analysis of wheat lines with rye chromatin [J].JournalofSichuanAgriculturalUniversity,2000,18(3):23-227.
[8]丁海燕,郑茂波,徐英博,等.一个大穗型小麦-黑麦异代换系的细胞学和SSR鉴定 [J].麦类作物学报,2008,28(2):202-205.
Ding H Y,Zheng M B,Xu Y B,etal.Identification of a rye alien substitution line with big ear by cytology and SSR analysis [J].JournalofTriticeaeCrops,2008,28(2):202-205.
[9]杨俊宝,彭正松,赵 梅,等.一种从小麦干种子中快速提取DNA的优化方法 [J].西华师范大学学报:自然科学版,2006,27(1):48-52.
Yang J B,Peng Z S,Zhao M,etal.An optimum and rapid DNA extraction method from dry seeds of wheat [J].JournalofChinaWestNormalUniversity:NaturalSciences,2006,27(1):48-52.
[10]代 芳,刘光辉,黄可兵,等.退火温度Tm对小麦SSR扩增结果的影响探究 [J].种子,2013,32(6):15-18.
Dai F,Liu G H,Huang K B.etal.Study on the effects of annealing temperature on wheat SSR amplification results [J].Seed,2013,32(6):15-18.
[11]李 勇,牛永春.基于琼脂糖凝胶电泳的小麦SSR扩增体系优化 [J].华北农学报,2009,24(6):174-177.
Li Y,Niu Y C.Optimization of SSR amplification system and agarose gel electrophoresis of amplificons [J].ActaAgriculturaeBoreali-Sinica,2009,24(6):174-177.
[12]Saal B,Wricke G.Development of simple sequence repeat markers in rye(SecalecerealeL.) [J].Genome,1999,42:964-972.
[13]丁海燕,于永忠,陈 霞,等.小麦-黑麦易位系的研究 [J].植物研究,2009,29(1):86-90.
Ding H Y,Yu Y Z,Chen X,etal.Study on wheat-rye translocation line [J].BulletinofBotanicalResearch,2009,29(1):86-90.
[14]丁海燕,张利敏,郑茂波,等.小麦-黑麦代换系间杂交后代的SSR分析 [J].中国农学通报,2011,27(7):46-49.
Ding H Y,Zhang L M,Zheng M B,etal.Analysis on the offsprings from crossing between wheat-rye substitution lines by SSR [J].ChineseAgriculturalScienceBulletin,2011,27(7):46-49.
[15]丁海燕,郑茂波,张利敏,等.小麦-黑麦易位系的细胞学和SSR检测 [J].安徽农业科学,2011,39(3):1315-1317.
Ding H Y,Zheng M B,Zhang L M,etal.Cytological and SSR detection of wheat-rye translocation line [J].JournalofAnhuiAgriculturalSciences,2011,39(3):1315-1317.
[16]魏琦超,畅丽萍,周 岩,等.利用改良CTAB 法提取小麦干种子总DNA [J].山西农业科学,2009,37(6):30-32.
Wei Q C,Chang L P,Zhou Y,etal.Extraction of total DNA from dry seeds of wheat with improved CTAB method [J].JournalofShanxiAgricultureScience,2009,37(6):30-32.
[17]旦 巴,何 燕,卓 嘎,等.SDS法和CTAB法提取西藏黄籽油菜干种子DNA用于SSR分析 [J].西藏科技,2011(8):9-11.
Dan B,He Y,Zhuo G,etal.DNA extraction by SDS and CTAB method from dry yellow-seededBrassicaNapusseeds in Tibet for SSR analysis [J].Tibet’sScienceandTechnology,2011(8):9-11.
Comparison of DNA Extraction Methods from Wheat Grain and the Optimization of SSR System
DING Haiyan,DING Chen
(Daqing Normal University,Daqing, Heilongjiang 163712,China)
Abstract:In order to obtain high quality DNA for SSR analysis and to establish a stable SSR technology system,DNA extraction and optimal conditions of SSR procedure were studied by using single dry grain of wheat as experimental material.The definition of DNA band and RNA residual band extracted with CTAB and SDS methods were compared.The effects of DNA concentration, primer concentration, dNTPs concentration and Taq enzyme concentration on the results of SSR were investigated.The results showed that the effective amplification products could be obtained with the DNA templates extracted from dry grain with CTAB buffer.SSR optimal reaction system was: 4.0-4.8 ng·μL-1of template, 1 U of Taq emzyme, 50-200 nmol·L-1of primer, and 50-500 μmol·L-1of dNTPs.
Key words:Wheat; Grain; CTAB method; SDS method; SSR
中图分类号:S512.1;S330
文献标识码:A
文章编号:1009-1041(2016)03-0287-05
基金项目:黑龙江省教育厅科学技术研究项目(12513004);大庆师范学院科学研究基金项目(12ZR04);大庆市科技局科技计划项目(szdfy-2015-65)
收稿日期:2015-09-25修回日期:2015-12-18
网络出版时间:2016-03-01
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160301.1338.010.html
第一作者E-mail:dinghaiyan2004@126.com
