二穗短柄草异戊烯基转移酶(IPT)编码基因的进化及功能分析
2016-05-27李艳花李婷婷王中华
周 雪,李 嘉,李艳花,李婷婷,王中华,权 力
(西北农林科技大学农学院,陕西杨凌 712100)
二穗短柄草异戊烯基转移酶(IPT)编码基因的进化及功能分析
周 雪,李 嘉,李艳花,李婷婷,王中华,权 力
(西北农林科技大学农学院,陕西杨凌 712100)
摘要:细胞分裂素(CTK)是一类重要的植物激素,主要作用是引起细胞分裂,诱导芽的形成和促进芽的生长。此外, CTK能够通过参与细胞分化来调控根分生组织大小,对根系生长有负调控作用。异戊烯基转移酶(IPT)是CTK合成过程中的一个关键的限速酶,在高等植物中均以多同源拷贝形式存在。为了探寻二穗短柄草IPT基因的进化起源,并阐明同源基因间潜在的功能分化及其在根系生长过程中的生物学功能,首先,对拟南芥及二穗短柄草的IPT基因进行了序列比对和进化分析,其次,利用荧光定量的方法对二穗短柄草中各IPT基因在不同组织不同发育阶段的转录水平进行了定量分析,最后,通过构建IPT基因RNAi的表达载体,对二穗短柄草中多个IPT基因的转录进行了沉默干扰。结果表明,tRNA-IPT可能代表了IPT祖先基因的功能,而且是ATP/ADP-IPT基因的供体基因。二穗短柄草各IPT基因具有一定的组织表达特异性,大部分ATP/ADP-IPTs处于转录不活跃状态,而tRNA-IPTs在根部和叶部的表达量都很高。因此,IPT基因在单子叶模式植物二穗短柄草中可能采用了不同于拟南芥的方式发挥功能,其主要的发挥功能形式是tRNA类型。二穗短柄草转IPT-RNAi植株表现出根系增强的表型,说明在根系早期发育阶段,二穗短柄草ATP/ADP型IPT基因起到了一定的调节作用。由于IPT基因在早熟禾亚科物种中较为保守,本研究可为增强麦类作物根系发育与提高抗旱性提供必要理论基础。
关键词:二穗短柄草;IPT基因;细胞分裂素;RNAi;根系
干旱是制约粮食增产的主要原因,不仅持续时间长,影响范围广,而且出现的频率高,给农业造成了严重的危害,威胁着国家粮食安全[1-3],每年因干旱造成的损失达60~90亿美元[4]。因此,如何更大限度地发挥作物自身的生命潜力和生产能力,提高作物适应恶劣环境的能力及对有限资源的利用效率,成为应对粮食危机的重要手段。根系作为植物最重要的营养器官之一,其生理形态、数量、位置与分布等特征直接决定营养物质摄取及运输方式,进而决定植物生长模式,影响产量。剖析植物根系生长发育的调控机理,运用生物技术手段改良根系,是促进粮食增产的必要途径。
多项研究表明,植物生长发育由遗传控制,且受各种环境因素影响,同时也受内源性植物激素调节。细胞分裂素(CTK)作为植物五大重要激素之一,是腺嘌呤的衍生物。当第6位氨基、第2位碳原子和第9位氨原子上的氢原子被取代时,则形成各种不同的CTK,其活性因侧链的长度和不饱和度等差异而有很大不同。CTK具有促进细胞分裂、衰老和根分化等作用[5],在种子萌发、根系生长和叶绿体分化等众多生物学过程中发挥着重要功能[6]。其中,CTK对植物根系生长的影响主要表现在抑制主根伸长上,外源施加CTK能抑制拟南芥主根的伸长和侧根的起始[7-9]。有研究表明,在超表达CTK氧化酶基因的转基因植株中,内源性CTK含量降低,而根系生长得到增强,主根的延伸加快,抗旱能力增加[10-11]。
植物体内CTK的合成主要依靠异戊烯基转移酶(IPT)进行。IPT最先在根癌农杆菌中得到鉴定[12]。IPTs由于催化的底物不同而分为两类:一类是腺嘌呤磷酸-IPT(ATP/ADP-IPT),另一类是tRNA-IPT。在拟南芥中,两个tRNA-IPT编码基因突变体中未能检测出顺式玉米素(cis-zeatin,cZ),因此该类细胞分裂素基本都是由tRNA类IPT催化合成的。而ATP/ADP-IPT则完全参与了反式玉米素(trans-zeatin,tZ)和异戊烯基腺嘌呤(iP)的合成[13-14]。过量表达IPT基因的烟草植株出现根系发育明显迟缓的现象[15],说明IPT基因的过量表达能抑制侧根的形成[16]。
IPT基因在植物基因组中均以多同源拷贝的形式存在。其中拟南芥基因组含有9个IPT基因,7个ATP/ADP型及2个tRNA型。单个IPT基因缺失突变后对CTK的合成影响不大,至少缺失掉其中三个基因(AtIPT3,5,7)后,植株才表现出矮小单薄的地上组织表型[17],说明IPT各基因间有较强的功能互补性。目前就CTK合成代谢的分子遗传学研究主要集中在双子叶模式植物,而针对单子叶植物CTK编码基因的认知了解甚少。由于主要粮食作物多为单子叶植物,这些植物究竟是采取何种机制进行CTK合成的,就成为本领域亟需解决的关键问题。由于二穗短柄草与众多谷类作物同属早熟禾亚科,且与多个麦类作物有很好的亲缘关系,以二穗短柄草为对象开展IPT基因的分子遗传学研究成为更深层次认知CTK合成、进行作物根系改良的合理选择。
二穗短柄草基因组共编码10个IPT基因,相关功能未曾报道。本研究通过序列和进化分析,对二穗短柄草各IPT基因的起源和分化进行推测;并通过鉴定各IPT基因不同发育时期在不同组织中转录表达的异同,解析二穗短柄草各IPT基因在发育过程中的功能差异。此外,由于IPT基因拷贝数众多且可能功能高度互补,依靠传统单基因突变手段无法获取有显著表型的突变体[18]。故采用RNAi的方法,以各IPT基因共享的功能保守区为靶目标,对目的基因在转录水平上进行特异干扰,能够同时高效地降解多个目标基因,达到多基因功能缺陷的效果,造成内源性细胞分裂素降低,使得根系生长增强,实现分析基因功能的目的。由于IPT基因在早熟禾亚科植物中高度保守,此研究同时也可为加快作物根系遗传改良、培育抗旱型作物提供理论支持。
1材料与方法
1.1材 料
供试材料为二穗短柄草Bd21,由本实验室保存。表达载体Pcambia1301和农杆菌EHA105由本实验室保存;RNAi的载体pUCCRNAi由中国科学院遗传与发育生物学研究所储成才研究员提供;RNA提取、cDNA合成试剂盒购于TIANGEN(北京)公司;荧光定量试剂盒购于Takara公司;引物由上海立菲生物技术有限公司合成。
1.2方 法
1.2.1二穗短柄草IPT基因序列的获得及进化分析
以拟南芥各IPT蛋白序列为查询序列,通过tBLASTn程序在phytozome 10.3中的二穗短柄草数据库中进行比对(http://phytozome. jgi. doe. gov/ pz/ portal. html)。继而对获得的候选蛋白序列进行蛋白结构域分析验证(http://pfam.xfam.org/)。拟南芥和二穗短柄草cDNA序列通过MAFFT程序(http:// mafft. Cbrc. jp/ alignment/ server/)进行序列比对。比对序列进而通过Genedoc 2.7.000(http://iubio. bio. indiana. edu/ soft/ molbio/ ibmpc/ genedoc-readme. html)进行编辑。最终通过MEGA 6.06软件进行进化分析。进化分析采用Neighbor-joining方法,并以1 000次循环进行计算及泊松分布进行运算。
1.2.2材料的培养及收集
将剥好的成熟二穗短柄草种子置于铺有湿润滤纸的培养皿中,在4 ℃下春化2 d,然后置于22 ℃光照培养箱(16 h光照/8 h黑暗)培养1周,待两片叶子长出后,将一部分幼苗插入漂浮板水培10 d,分别收集叶片和根部组织,剩余幼苗则移栽到培植土中,从第20天开始每隔10 d取1次叶片和根部组织,直至第50天。所取的材料均在液氮中速冻,并于-80 ℃冰箱保存。
1.2.3二穗短柄草基因组总DNA及总RNA的提取
采用SDS法提取二穗短柄草叶片基因组总DNA。依照植物基因组RNA提取试剂盒说明书提取1.2.2中所保存的不同处理方式及其不同时期的根和叶片组织的总RNA,并用1%的琼脂糖凝胶电泳检测RNA的完整性,然后用FastQuant cDNA第一链合成试剂盒将其反转录成cDNA,于-20 ℃保存备用。
1.2.4实时荧光定量PCR(qRT-PCR)分析
以1.2.3中得到的cDNA为模板,以二穗短柄草Actin基因为内参进行qRT-PCR分析。qRT-PCR试验操作在BIO-RAD CFX实时荧光定量PCR仪上进行,其反应体系及程序参照TaKaRa公司SYBR○RPremix ExTaqTM(Perfect Real Time)试剂盒说明书。试验设定3次重复,反应完成后进行熔解曲线分析,然后按照2-ΔΔCt法计算基因的相对表达量。具体引物信息见表1。
1.2.5以ATP/ADP型IPT基因为干扰靶基因的RNAi表达载体的构建
基于序列比对结果,截取各ATP/ADP型IPT基因编码区相对保守的区域,以二穗短柄草Bradi1g619601.1序列为参考模板设计引物,并在正反向引物两端分别引入BamHI和XhoI酶切位点(表1)。以生长25 d的二穗短柄草叶片DNA为模板,进行PCR扩增。获取的目的片段经过测序验证序列准确性后,分别被正反向插入沉默载体pUCCRNAi中。通过PstI酶切回收后,将含有正反向重复的表达片段插入双元表达载体pCambia1301中。
1.2.6RNAi表达载体转化二穗短柄草
将ATP/ADP-IPTRNAi的表达载体及pCambia1301空载体分别转入农杆菌EHA105,再通过农杆菌侵染二穗短柄草愈伤,并诱导成苗。利用潮霉素(Hgy)引物通过PCR法检测T0代转化植株。
2结果与分析
2.1二穗短柄草中IPT基因的序列及进化分析
以已知拟南芥中IPT蛋白序列进行BLAST搜索,获取二穗短柄草基因组中全部IPT基因序列。

表1 本研究所用引物
下划线部分表示酶切位点;HPT表示潮酶素抗性基因
The underlined parts represent restriction enzyme cutting sites;HPTrepresents hygromycin resistance gene
通过序列比对,发现在拟南芥(AtIPT1/3/4/5/6/7)及二穗短柄草(Bradi1g04580/Bradi1g29490/Bradi1g54060/Bradi2g13410/Bradi2g17400/Bradi2g46920/Bradi4g27860)中,绝大多数ATP/ADP型IPT基因不含内含子;而tRNA型的IPT基因均有9~10个内含子,且内含子和外显子分布形态非常相似。前人研究已表明,在拟南芥中AtIPT9和AtIPT2均属tRNA型IPT基因[17],从进化树的结构(图1)可以看出Bradi1g29490及Bradi1g70200分别与拟南芥的两个同源基因形成单系群,且各单系群中均只有一个基因拷贝得到保留。所以,这些基因的共同祖先可能早在单双子叶植物分离前既已出现。其中,AtIPT9/Bradi1g29490所在的分支可能形成的更早,可能代表着IPT祖先基因的功能。
与之形成对比的是ATP/ADP类型IPT基因,采用了不同的进化方式形成。拟南芥与二穗短柄草在物种形成分离后,各自独立经历了若干次的基因复制事件,从而形成了多拷贝的模式,也可能进一步造成了IPT基因间较强的功能互补性。鉴于ATP/ADP型IPT基因与AtIPT2所在分支的进化关系,极有可能AtIPT2/Bradi1g70200的祖先基因是ATP/ADP型IPT基因的供体基因。
2.2二穗短柄草IPT基因组织表达谱分析
拟南芥的研究表明,在物种形成分离后,经过若干次独立基因复制事件,ATP/ADP型IPT基因形成了多拷贝。但是,遗传学结果表明,各IPT基因的单突变不能造成植株的明显异常,说明IPT基因的基本功能较为相似且存在较强的互补性。然而不同的突变组合造成了不同的植物表型,说明IPT基因间可能也存在功能差异。为了解析各IPT基因对二穗短柄草发育的时空调控作用,本研究采用qRT-PCR的方式对各IPT基因在不同发育阶段、不同组织中的表达情况进行了分析。结果(图2、图3)表明,二穗短柄草各IPT基因具有一定的组织表达特异性,根部表达量普遍低于叶部。ATP/ADP-IPTs中只有Bd1g15770表达量较高,其他基因的表达量极低,说明二穗短柄草中大部分ATP/ADP型IPT基因要么处于转录不活跃状态,要么只在特定时间、组织瞬时表达。而tRNA-IPTs(Bd4g29490、Bd1g70200)在根部和叶部的表达量都很高,说明这两个基因可能在二穗短柄草细胞分裂素合成过程中发挥着驻家基因的重要作用。

图1 IPT基因的系统发生分析
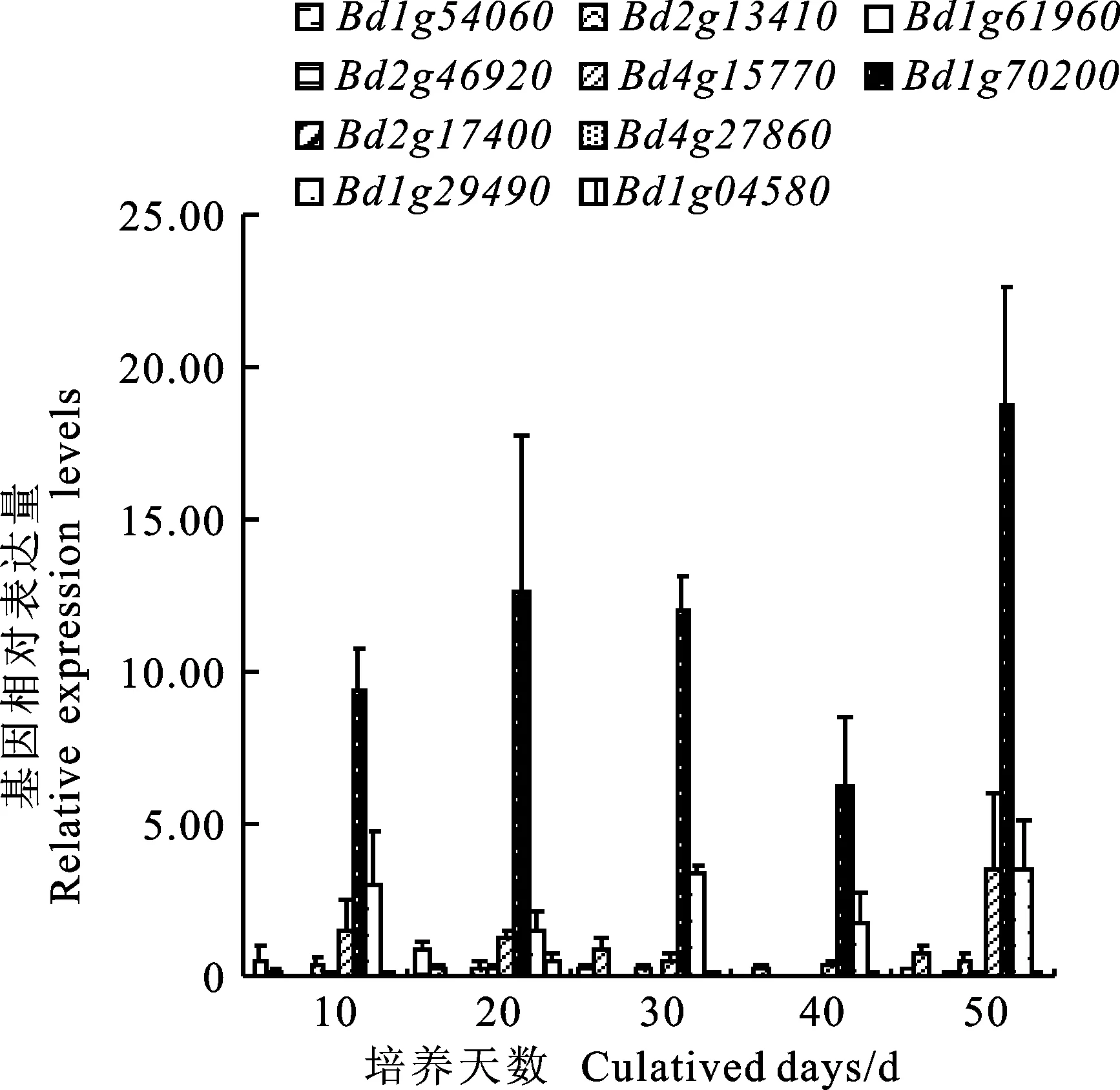
图2 二穗短柄草IPT基因在根部
2.3ATP/ADP-IPTRNAi沉默载体的构建及其转化
拟南芥的研究表明,AtIPT3/5/7在根系中表达量很高,三个基因同时缺失的情况下植物发育异常,表明这三个基因对细胞分裂素的合成起主要作用。tRNA型IPT在细胞分裂素合成中也有一定作用,但主要是在增生组织中表达[19]。因此,挑选与AtIPT3/5/7同源性较高的基因作为靶基因进行沉默干扰是研究二穗短柄草IPT基因对根系作用的首要选择。基于序列比对结果,筛选合适的保守序列作为靶区域设计引物,利用PCR扩增得到了570 bp的目的靶片段(图4A),将目的片段插入沉默载体并进行了酶切验证,结果如图4B所示,说明ATP/ADP-IPTRNAi沉默载体构建成功。通过农杆菌侵染幼胚愈伤组织培养方式,进行遗传转化。提取T0代植株DNA,并用Hyg引物检测,扩增出374 bp的片段(图5),说明这些植株为阳性植株,可用于后续根系表型观察。

图3 二穗短柄草IPT基因在叶部
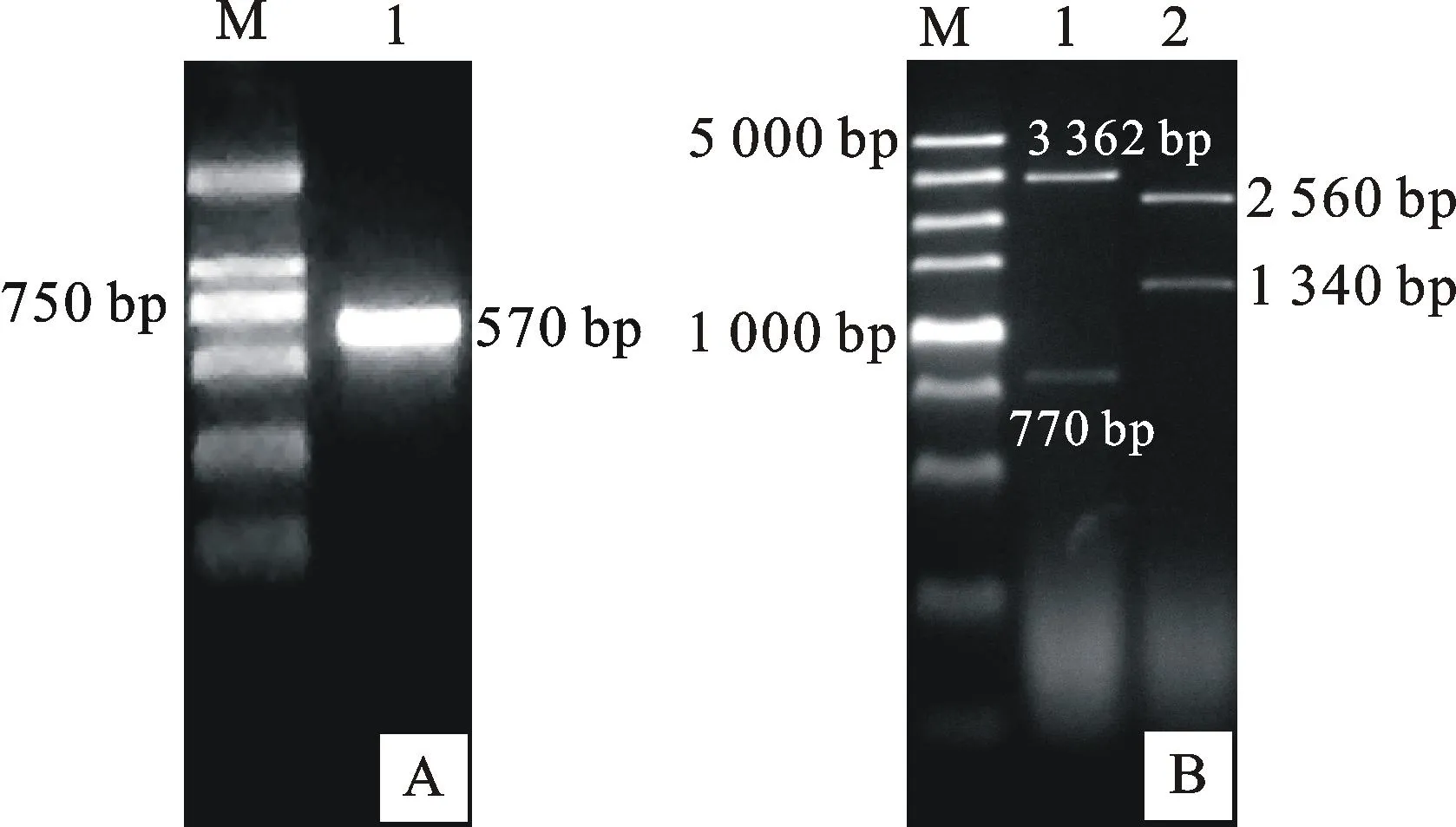
A图中M表示DL2000;B图中M、1和2分别表示DL5000、XhoI和BamHI双酶切pUCCRNAi载体及PstI酶切pUCCRNAi载体
M in Fig.A represents DL2000;M,1 and 2 in Fig.B represent DL5000,double enzyme digestion of pUCCRNAi withXhoI andBamHI,and single enzyme digestion of pUCCRNAi withPstI,respectively
图4二穗短柄草IPT基因的PCR扩增结果(A)
及RNAi表达载体的酶切鉴定结果(B)
Fig.4PCR product ofIPTgene (A) and identification
results of restriction enzyme digestion ofIPT-
RNAi(B) inBrachypodiumdistachyon
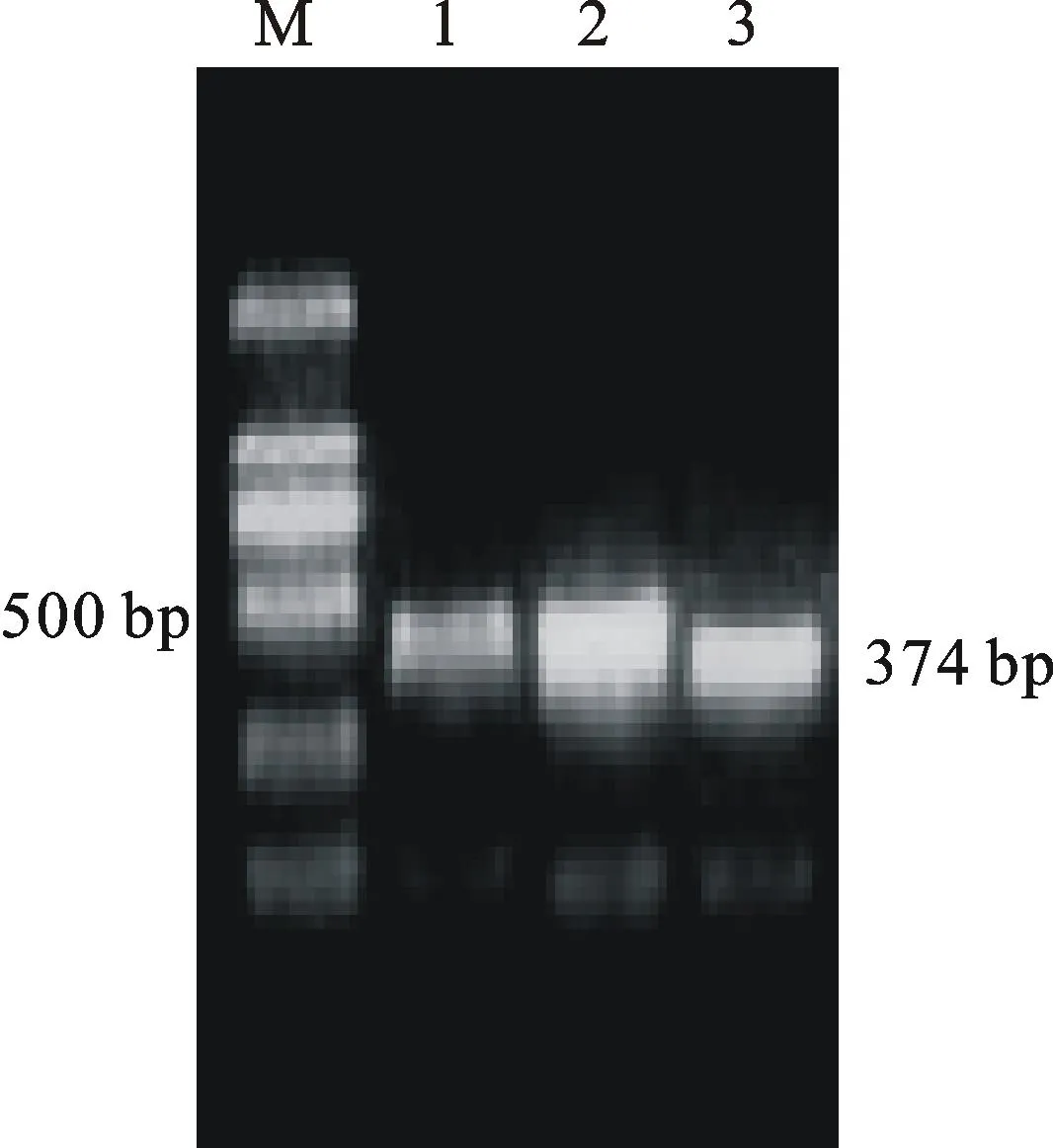
M:DL2000;1~3:转化植株
M:DL2000;1-3:Transgenic plants
图5RNAi转基因植株的PCR验证
Fig.5Identification of transgenic plants by PCR
2.4二穗短柄草转IPT-RNAi植株的表型分析
与空载体转基因植株相比,二穗短柄草转IPT-RNAi的阳性植株根系有异常表现。刚刚长出幼根的二穗短柄草的根毛数量明显增多且根毛密而长(图6A)。生长一周后,根毛差异变得不明显,但是基因植株的初生根显著增长(图6B)。说明在根系早期发育阶段,二穗短柄草ATP/ADP型IPT基因起到了一定的调节作用。
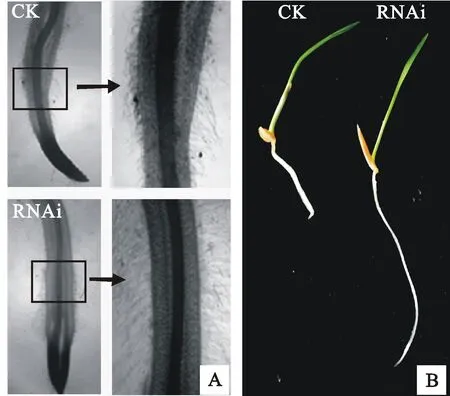
A:幼根根毛;B:生长一周的根
A:Young root hair; B:Root after a week growth
图6二穗短柄草转IPT-RNAi的阳性
植株与对照根系表型比对
Fig.6Root phenotype comparison between the
positiveBdIPT-RNAi plant and the control
3讨 论
本研究通过对二穗短柄草IPT基因的序列、进化、表达及功能分析表明,IPT基因在单子叶模式植物二穗短柄草中可能采取了与双子叶模式植物拟南芥不同的工作模式对根系发育生长进行调控。
拟南芥和二穗短柄草中大部分ATP/ADP型IPT基因没有内含子,可能是由于逆转录转座的方式形成。逆转录转座是由于某个前体基因转录形成的mRNA,在某些特定环境下,由于某种原因发生了逆转录,使形成的cDNA随机插入基因组中并得到整合。这种方式形成的基因没有内含子,且由于缺乏上游的调控序列往往在基因组中呈沉默状态。由荧光定量PCR结果也进一步表明,大部分二穗短柄草ATP/ADP型IPT都呈现极低的转录水平。部分基因所表现出的略高表达状态可能是在基因形成后,在进化过程中启动子调控区域逐渐通过序列变异而产生了部分转录活性。但是相对可能继承了IPT祖先基因功能的tRNA型IPT2/IPT9分支的基因而言,ATP/ADP-IPTs的表达量是极低的。虽然拟南芥中tRNA型IPT被认为多在分生组织中表达来控制细胞分裂素的形成,也发现AtIPT3/5/7可能是在控制拟南芥根及地上部分的发育中起主导作用[17],但由于拟南芥和二穗短柄草ATP/ADP-IPTs是在物种分化后,各自进行独立基因复制所形成的,所以这两个物种中的此类基因并无绝对的对应关系。有可能发生的机制是两个物种的ATP/ADP-IPTs基因分别独立进化,部分拟南芥ATP/ADP-IPTs(如AtIPT3/5/7)能够产生必要的表达活性,从而在发育阶段起了关键作用。而二穗短柄草未能形成类似的机制,从而导致绝大部分ATP/ADP-IPTs依然处于缺乏显著转录调控的状态,不能高效催化合成细胞分裂素。由于细胞分裂素在植物生长发育各阶段都有重要作用,在自然选择压力下,tRNA型IPTs则在二穗短柄草各发育阶段起了主导作用。对于IPT各基因的具体形成分化可能需要在未来使用更多的物种序列来进行精细判断。
从系统发生树来看,在单双子叶分化前,应该有两个IPT祖先基因。其中一个进化成IPT9分支,并在各物种中以单拷贝的形式进行保留,可能代表了祖先基因的部分功能。另一个基因则形成了IPT2及ATP/ADP-IPTs所在的大分支。IPT2分支在各物种中也以单拷贝的形式存在,结合其序列特征,也应该是继承了祖先的部分功能。IPT2及IPT9与细菌中部分tRNA修饰酶编码基因有一定的同源性,因此不难理解tRNA类型的IPT基因代表着一类古老的基础性的功能,在维持植物基本生长过程中发挥着作用。由于ATP/ADP-IPTs没有内含子,该分支形成的机制极有可能是发生在单双子叶分离阶段,IPT2类型的祖先基因的转录子因为逆转录转座机制形成了ATP/ADP-IPTs型的祖先基因,继而得到保留以及经历了物种分离后各自的独立复制和进化事件。也因此可以推论出,IPT2基因可能是ATP/ADP-IPTs的供体基因。
此外,由于有证据显示拟南芥可能在进化阶段经历了起码三次全基因组复制事件,最近的一次是发生在4 000-7 000万年前单双子叶分离后。也就是说理论上讲,AtIPT2和AtIPT9应该至少各有2个拷贝的,但是单双子叶中这两个分支分别只有一个拷贝得到了保留,说明IPT基因所参与的生物学过程是对剂量敏感的。多余的拷贝会由于自然选择的结果从基因组中删除。由于IPT基因的功能是催化合成细胞分裂素,一类在植物各发育阶段起重要作用的激素,尤其是在芽萌发等关键阶段,促使细胞分化。因此IPT基因在植物发育阶段是扮演一个精细调控的角色。
虽然我们认为从基因表达角度讲,二穗短柄草中tRNA-IPTs比ATP/ADP-IPTs可能发挥了更重要作用。但是二穗短柄草转IPT-RNAi的结果表明,转录受到干扰的ATP/ADP-IPTs基因依然能够影响植物的发育。其中可能的解释为ATP/ADP-IPTs在局部、瞬时调控发挥作用,对特定细胞特殊时期发育有影响。而tRNA-IPTs更多的是起一个“驻家基因”的效果,对大部分细胞分裂素的合成起主导作用,从而保证植物生长阶段能够在合适时间、组织器官中有该激素的分布。
转ATP/ADP-IPTRNAi的二穗短柄草阳性植株根系生长明显得到了增强,可能的原因是由于参与合成细胞分裂素的ATP/ADP-IPTs表达量减少,造成内源性细胞分裂素的降低,尤其是反式玉米素的减少。研究表明,通过增强内源性细胞分裂素的降解能够有效促进植物根系发育。本研究也同时表明,减少细胞分裂素的合成也能有效的增强植物根系。根系对植物生长发育有重要意义,通过基因调控手段使根系强壮,根毛增多来增强植物抗旱性是应对干旱胁迫的一个有效手段。麦类作物作为主要粮食之一,增强其抗旱性对提高粮食产量,维护粮食安全至关重要。二穗短柄草与早熟禾亚科作物亲缘关系较近,且IPT基因在早熟禾亚科植物中都相对比较保守,研究解析IPT对根系的影响,并通过遗传手段改良基因,则成为有效提高作物抗旱性的重要举措。
参考文献:
[1]谷洪波,刘新意,刘芷妤.我国农业重大干旱灾害的分布、特征及形成机理研究 [J].西南农业学报,2014,27(1):369-373.
Gu H B,Liu X Y,Liu Z Y.Characteristics of major drought disaster in China,distribution and its formation mechanism research [J].SouthwestChinaJournalofAgriculturalSciences,2014,27(1):369-373.
[2]李茂松,李 森,李育慧.中国近50年旱灾灾情分析 [J].中国农业气象,2003,24(1):7-10.
Li M S,Li S,Li Y H.Studies on drought in the past 50 years in China [J].ChineseJournalofAgrometeorology,2003,24(1):7-10.
[3]李文娟,覃志豪,林 绿.农业旱灾对国家粮食安全影响程度的定量分析 [J].自然灾害学报,2010,19(3):111-118.
Li W J,Qin Z H,Lin L.Quantitative analysis of agro-drought impact on food security in China [J].JournalofNaturalDisasters,2010,19(3):111-118.
[4]Wilhite D A.Drought as a natural hazard:Concepts and definitions [C]//Wilhite D A(ed).Drought,A Global Assessment,Toutledge Publishers,UK,2000(1):3-18.
[5]Choi J,Hwang I.Cytokinin:perception,signal transduction,and role in plant growth and development [J].JournalofPlantBiology,2007,50(2):98-108.
[6]Werner T,Motyka V,Strnad M,etal.Regulation of plant growth by cytokinin [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2001,98(18):10487-10492.
[7]Lohar D P,Schaff J E,Laskey J G,etal.Cytokinins play opposite roles in lateral root formation,and nematode and rhizobial symbioses [J].ThePlantJournal,2004,38(2):203-214.
[8]Auer C A.Cytokinin inhibition ofArabidopsisroot growth:An examination of genotype,cytokinin activity,and N6-Benzyladenine metabolism [J].JournalofPlantGrowthRegulation,1996,15(4):201-206.
[9]Choi Y I,Noh E W,Kim H J,etal.Differential regulation of cytokinin oxidase genes and cytokinin -induced auxin biosynthesis by cellular cytokinin level in transgenic poplars [J].PlantCellReports,2014,33(10):1737-1744.
[10]Werner T,Motyka V,Laucou V,etal.Cytokinin-deficient transgenicArabidopsisplants show multiple developmental alterations indicating opposite functions of cytokinins in the regulation of shoot and root meristem activity [J].PlantCell,2003,15(11):2532-2550.
[11]Werner T,Nehnevajova E,Kollmer I,etal.Root-specic reduction of cytokinin causes enhanced root growth,drought tolerance,and leaf mineral enrichment inArabidopsisand tobacco [J].PlantCell,2010,22(12):3905-3920.
[12]Barry G F,Rogers S R,Fraley R T,etal.Identification of a cloned cytokinin biosythetic gene [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1984,81(15):4776-4780.
[13]Lindner A C,Lang D,Seifert M,etal.Isopentenyltransferase-1 (IPT1) knockout in physcomitrella together with phylogenetic analyses of IPTs provide insights into evolution of plant cytokinin biosynthesis [J].JournalofExperimentalBotany,2014,65(9):2533-2543.
[14]Kakimoto T.Biosynthesis of cytokinins [J].JournalofPlantResearch,2003,116:233-239.
[15]Hewelt A,Prinse E,Schell J,etal.Promoter tagging with a promoterlessiptgene leads to cytokinin-induced phenotypic variability in transgenic tobacco plants:implications of gene dosage effects [J].ThePlantJournal,1994,6:879-891.
[16]Luo Y Y,Gianfagna T J,Janes H W,etal.Expression of theiptgene with the AGPase S1 promoter in tomato results in unbranched roots and delayed leaf senescence [J].PlantGrowthRegulation,2005,47(1):47-57.
[17]Miyawaki K,Tarkowski P,Matsumotokitano M,etal.Roles ofArabidopsisATP/ADP isopentenyltransferases and tRNA isopentenyltransferases in cytokinin biosynthesis [J].ProceedingsoftheNationalAcademyofSciences,2006,103(44):16598-16603.
[18]Hiroaki K,Kazunari T.Short hairpin type of dsRNA that are controlled by tRNA (Val) promoter significantly induce RNAi mediated gene silencing in the cytoplasm of human cells [J].NucleicAcidsResearch,2003,31(2):700-707.
[19]Miyawaki K,Matsumoto-Kitano M,Kakimoto T.Expression of cytokinin biosynthetic isopentenyltransferase genes inArabidopsis:tissue specificity and regulation by auxin,cytokinin,and nitrate [J].ThePlantJournal,2004,37(1):128-138.
Evolutionary Analysis and Functional Characterizations ofIPTGenes inBrachypodiumdistachyon
ZHOU Xue,LI Jia,LI Yanhua,LI Tingting,WANG Zhonghua,QUAN Li
(College of Agronomy of Northwest A&F University,Yangling,Shaanxi 712100,China)
Abstract:Cytokinin (CTK) is one of the most important plant hormones,causing cell divisions and promoting shoot emergence and development. In addition,CTK plays a negative regulatory role in root growth by engaging through the cell differentiation process within root meristem. In plants,CTK is primarily synthesized by a group of isopentenyl transferases (IPTs) that are encoded by multiple homologous IPT genes. To figure out the evolutionary origin of IPT genes,sequence comparisons and phylogenetic analysis were carried out using full length IPT protein sequences from Arabidopsis and Brachypodium distachyon. Moreover,qPCR experiment was conducted to investigate the transcription levels of each IPT gene in Brachypodium distachyon,providing an overall picture of their functional divergences. To further look into their biological functions,an RNAi approach was employed targeting the conserved coding regions of these IPT genes. The results showed that,tRNA-IPT is inferred to be the ancestral gene of IPT and the gene donor of ATP/ADP-IPT. Phenotype resulted from the suppressed expressions of IPT genes allowed insightful understandings of their physiological functions. It was found that IPT genes were preferentially expressed in various tissues. Although most of the ATP/ADP-IPTs were low in the transcription level,the tRNA-IPTs were highly expressed in both root and leaf,suggesting that the tRNA type IPTs might play a predominant role during Brachypodium distachyon root development,which was different from that in Arabidopsis. IPT-RNAi plants exhibited enhanced root system phenotypes.It was inferred ATP/ADP-IPTs played a regulatory role in the early development stage of root in Brachypodium distachyon.Because IPT genes are fairly conserved among Pooideae species,our research may provide a theoretical base for the genetic improvement of root in Triticeae crops,thereby advancing their drought tolerance.
Key words:Brachypodium distachyon; IPT gene; Cytokinin; RNAi; Root system
中图分类号:S512.1;S330
文献标识码:A
文章编号:1009-1041(2016)03-0273-08
通讯作者:权 力(E-mail:lquan@nwafu.edu.cn)
基金项目:陕西省自然科学基金项目(2014JQ3095);陕西省遗传育种新技术团队项目(2014KCT-25);中央高校基本科研业务费专项(Z109021426)
收稿日期:2015-11-05修回日期:2015-12-22
网络出版时间:2016-03-01
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160301.1338.006.html
第一作者E-mail:694180602@qq.com
