帕金森病轻度认知功能障碍的临床特点
2016-05-26马腾云韩顺昌冯娟
马腾云 韩顺昌 冯娟
110004 中国医科大学附属盛京医院神经内科[马腾云 韩顺昌 冯娟(通信作者)]
帕金森病轻度认知功能障碍的临床特点
马腾云韩顺昌冯娟
110004中国医科大学附属盛京医院神经内科[马腾云韩顺昌冯娟(通信作者)]
【摘要】目的探讨帕金森病患者轻度认知功能障碍(PD-MCI)的临床特点。方法纳入85例非痴呆的帕金森病(PD)患者,并进行临床资料的采集及相关量表评估。结果PD-MCI组55例(64.7%),PD-认知正常组30例(35.3%)。PD-MCI组的年龄及发病时年龄显著高于PD-认知正常组(P<0.05),PD-MCI组MoCA评分中的视空间与执行功能、注意、语言、抽象、延迟回忆得分显著低于PD-认知正常组(P<0.01)。PD-MCI组的MoCA评分与UPDRS Ⅲ评分及发病年龄呈负相关,与受教育水平呈正相关。结论与认知功能正常的PD患者比较,PD-MCI患者在视空间与执行功能、注意、语言、抽象、延迟回忆等方面均有损害,且认知损害程度与发病年龄、运动症状严重程度及受教育水平有关。
【关键词】帕金森病轻度认知功能障碍运动症状
【DOI】10.3969/j.issn.1007-0478.2016.02.016
帕金森病(Parkinson disease, PD)的非运动症状越来越受到神经病学专家的重视[1],认知损害是其最常见和最重要的非运动症状之一[2]。近二十年,关于PD认知损害的研究焦点集中在帕金森病轻度认知功能障碍 (mild cognitive impairment, MCI)。MCI是指对日常生活功能影响很小且没有发展为痴呆的认知功能障碍,且认知损害不能简单归因于老化[3]。由于PD-MCI患者发展为帕金森病痴呆(Parkinson disease dementia,PDD)的风险会增加,从而严重影响患者的功能独立性及生活质量,增加PD患者的病死率[4],明确PD-MCI的临床特征有助于对其进行早期识别、预测和干预,以阻止或延缓其进展为PDD。本研究通过对PD-MCI患者从人口统计学指标、认知功能及运动症状等方面进行分析与总结,为从非痴呆的PD患者中识别PD-MCI提供依据。
1对象与方法
1.1研究对象
选取2014年3月~2015年1月中国医科大学附属盛京医院神经内科门诊及住院的85例非痴呆帕金森病患者,诊断符合英国脑库PD的诊断标准[5]。入选标准:(1) 尽管在处理复杂功能任务上可能稍有困难,但认知功能障碍仍不足以显著影响功能独立性;(2) 未服用胆碱酯酶抑制剂等改善认知功能的药物。排除标准:(1) 依据国际运动障碍协会(Movement Disorder Society,MDS)工作组所拟定的诊断标准[6]诊断为PDD;(2) 有其它可解释认知功能损害的原因( 如谵妄、脑卒中、重度抑郁、代谢异常、药物副作用或脑外伤等);(3) PD相关的伴随症状可显著影响认知功能检测( 如运动损害、重度焦虑抑郁、日间过度嗜睡或精神疾病等)。根据MDS工作组制定的PD-MCI诊断标准[3],将入选患者分为PD-认知正常组(n=30)与PD-MCI组(n=55)。
1.2方法
1.2.1一般临床资料的收集包括年龄、性别、发病年龄、教育程度、病程、起病侧、首发症状、服药史、其他疾病史等。
1.2.2神经心理学评估对所有入选患者进行简易智能量表(mini- mental state examination, MMSE)、蒙特利尔认知评估量表(Montreal cognitive assessment, MoCA)、汉密尔顿抑郁量表(Hamilton Depression Rating Scale, HAM-D)评估。同时采用日常生活能力量表(activity of daily living scale, ADL)对入选患者进行日常生活能力的评估。
PD-认知正常:MoCA评分≥26分,ADL量表<23(年龄<75)或ADL评分<25(年龄≥75),HAM-D<7;PD-MCI:MoCA评分<26分,ADL量表≥23(年龄<75)或ADL评分≥25(年龄≥75),HAM-D<7,且符合MDS工作组制定的PD-MCI一级诊断标准者[3]。
1.2.3运动症状的评估(1)首发症状:震颤、肌强直、运动迟缓、姿势步态异常;(2)UPDRS Ⅲ评分(共14项,每项0~4分);(3)疾病严重程度 H&Y分级(0~5级),对于症状有波动的患者,选在1d中症状最轻时评估。
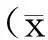
2结果
2.12组患者的一般情况分析本研究共纳入非痴呆的PD患者85例,其中PD-MCI组55例(64.7%),PD-认知正常组30例(35.3%),PD-MCI组的年龄及发病年龄均显著高于PD-认知正常组(P<0.05),而2组患者的病程、男性患者比例、教育程度及左旋多巴有效剂量无显著差异(P>0.05)(见表1)。

表1 PD-MCI组与PD-认知正常组的一般临床资料比较
注:与PD-认知正常组比较,*P<0.05,△P<0.01
2.22组患者的认知功能评估比较PD-MCI组的MMSE及MoCA评分均显著低于PD-认知功能正常组(P<0.01)。在MoCA单项评分中除“命名”外,PD-MCI组各单项评分值均显著低于PD-认知正常组(P<0.01)(见表2)。
2.32组患者的运动症状特点分析 2组患者的UPDRS Ⅲ评分与H&Y分级无显著差异(P>0.05)(表3),2组患者在首发症状的构成比例也无显著差异(χ2=0.86,P=0.84)(表4)。
2.4PD-MCI组MoCA评分与其他因素的相关性分析
以PD-MCI患者的MoCA评分为应变量,采用逐步多元线性回归对相关因素进行统计学分析显示,发病年龄、教育程度及UPDRSⅢ评分进入回归方程,MoCA评分与UPDRS Ⅲ评分(P<0.01)、发病年龄(P<0.01)呈负相关,与教育程度呈正相关(见表5)。

表2 PD-MCI组与PD-认知正常组的
注:与PD-认知正常组相比较,*P<0.05,△P<0.01

表3 2组的UPDRSⅢ评分及H&Y分级的比较±s分)

表4 2组各首发症状的例数及所占比例[n(%)]

表5 PD-MCI组MoCA评分与其他因素的相关性分析
3讨论
PD-MCI是在PD早期即可出现的常见并发症,且有进展为PDD的风险。既往研究显示PD-MCI的发病率为20%~57%[7],2012年国际运动障碍协会(MDS)根据近二十年的研究成果制定了PD-MCI的诊断标准,为进一步展开关于PD-MCI的研究提供了标准统一的依据[3]。一项根据该标准进行的临床研究显示,PD患者中PD-MCI的患病率为42.5%[8],另一项研究显示,在123例新诊断为PD的患者中35%患有PD-MCI,3年后这一比例上升至53%,5年后之前诊断为PD-MCI的患者中有20例发展为PDD[9]。PD的认知功能障碍主要为额叶皮质下的注意力-执行区域受累,也可有视空间能力和记忆的受损[10]。PD-MCI的发生及其认知功能障碍的严重程度与多种因素有关,一项多中心的汇总分析显示,PD-MCI的发生与年龄及发病年龄、男性、焦虑、更严重的运动症状和疾病的进展阶段有关[11]。此外,低血清尿酸水平、抑郁等多种其他因素也与认知功能障碍发生也存在相关性[12-13]。
目前国内外关于PD-MCI与PD运动症状的相关性研究尚未达成一致意见。有研究显示,以姿势步态异常为首发症状者其认知功能评分显著低于以震颤为首发症状者,但表示疾病严重程度的H&Y分级与认知功能障碍的程度无关[14]。也有研究显示,PD-MCI组中以强直为首发症状者显著高于认知功能正常的PD患者,且PD-MCI组的H&Y分级高于对照组[15]。而本研究结果显示,虽然在PD-MCI患者中MoCA评分与UPDRSⅢ评分及发病年龄呈负相关,但与认知正常的PD患者比较,除年龄及发病年龄显著增高外,UPDRSⅢ评分、H&Y分级、病程、男性患者比例均无显著差异,可能与纳入病例数相对不足有关,也有可能提示PD-MCI并非是随着疾病进展逐渐出现的并发症,是PD早期即可表现出来的一个临床亚型,目前也有越来越多的研究支持这一观点。
PD-MCI的发病机制尚未明确。有研究发现,纹状体多巴胺去神经支配及岛叶的D2受体缺失可导致PD-MCI尤其是执行功能下降[16]。也有研究显示,PD患者认知功能的损害可能与多巴胺、乙酰胆碱、去甲肾上腺素等多种神经递质的异常相关[17]。本研究的MoCA单项评分中PD-MCI组的视空间与执行功能、注意、语言、抽象、延迟回忆得分均显著低于PD-认知正常组,提示PD-MCI患者存在多认知领域受损,也间接支持多种神经递质参与的观点。另外,有研究指出多巴胺能药物的应用也可能会导致认知功能的某些领域受损[18]。如何对PD-MCI进行干预目前尚无统一的临床指南,但国内外均有研究表明胆碱酯酶抑制剂可以改善PD患者的认知功能障碍[19-20],鼓励早中期患者进行有氧运动的锻炼也可能对改善认知功能尤其是执行功能有一定效果[21]。
PD-MCI是PD患者常见的非运动症状,有快速认知下降及进展为痴呆的风险,因此应重视对非痴呆PD患者的认知功能监测,早期识别PD-MCI并对其进行干预,以阻止或减缓其进展为PDD,并提高PD患者的生活质量。
参考文献
[1]Van DJ,Marinus J,Martinez-Martin P,et al.Importance of nondopaminergic features in evaluating disease severity of Parkinson disease[J].Neurology,2014,82(5):412-418.
[2]Watson GS,James B,Leverenz.Profile of cognitive impairment in parkinson disease[J].Brain Pathol,2010,20(3):640-645.
[3]Litvan I,Goldman JG,Tr ster AI,et al.Diagnostic criteria for mild cognitive impairment in Parkinson's disease: Movement Disorder Society Task Force guidelines[J].Mov Disord,2012,27(3):349-356.
[4]Svenningsson P,Westman E,Ballard C,et al.Cognitive impairment in patients with Parkinson's disease: diagnosis, biomarkers, and treatment[J].Lancet Neurol,2012,11(8):697-707.
[5]Hughes AJ,Daniel SE,Kilford L,et al.ACCURACY OF CLINICAL-DIAGNOSIS OF IDIOPATHIC PARKINSONS-DISEASE - A CLINICOPATHOLOGICAL STUDY OF 100 CASES[J].J Neurol Neurosurg Psychiatry,1992,55(3):181-184.
[6]Emre M,Aarsland D,Brown R,et al.Clinical diagnostic criteria for dementia associated with Parkinson's disease[J].Movement Disorders,2007,22(12):1689-1707.
[7]Copeland BJ,Schiess MC.Can mild cognitive impairment in parkinson disease predict the development of dementia?[J].JAMA Neurol,2013,70(5):553-555.
[8]Yarnall AJ,Breen DP,Duncan GW,et al.Characterizing mild cognitive impairment in incident Parkinson disease The ICICLE-PD Study[J].Neurology,2014,82(4):308-316.
[9]Broeders M,Bie RD,Velseboer DC,et al.Evolution of mild cognitive impairment in Parkinson disease[J].Neurology,2013,81(4):346-352.
[10]Dalrymple-Alford JC,Livingston L,Macaskill MR,et al.Characterizing mild cognitive impairment in parkinson's disease[J].Movement Disorders,2011,26(4):629-636.
[11]Aarsland D,Bronnick K,Williams-Gray C,et al.Mild cognitive impairment in Parkinson disease A multicenter pooled analysis[J].Neurology,2010,75(12):1062-1069.
[12]Bennett S,Thomas AJ.Depression and dementia: Cause, consequence or coincidence[J].Maturitas,2014,79(2):184-190.
[13]Gonzalez-Aramburu I,Sanchez-Juan P,Sierra M,et al.Serum uric acid and risk of dementia in Parkinson's disease[J].Movement Disorders,2014,29(1):S345.
[14]Oh JY,Kim YS,Choi BH,et al.Relationship between clinical phenotypes and cognitive impairment in Parkinson's disease (PD)[J].Arch Gerontol Geriatr,2009,49(3):351-354.
[15]钱铭净,顾群,姚林华,等.帕金森病患者轻度认知损害的特点及影响因素[J].浙江中西医结合杂志,2013,23(11):879-882.
[16]Christopher L,Marras C,Duff-Canning S,et al.Combined insular and striatal dopamine dysfunction are associated with executive deficits in Parkinson's disease with mild cognitive impairment[J].Brain,2014,137(2):565-575.
[17]Xu YQ,Yan JQ,Zhou P,et al.Neurotransmitter receptors and cognitive dysfunction in Alzheimer's disease and Parkinson's disease[J].Prog Neurobiol,2012,97(1):1-13.
[18]Vo A,Hiebert NM,Solcz S,et al.Dopaminergic medication impairs feedback-based stimulus-response learning but not response selection in Parkinson's disease[J].Front Hum Neurosci,2014,8:784.
[19]Pagano G,Rengo G,Pasqualetti GA,et al.Cholinesterase inhibitors for Parkinson's disease: a systematic review and meta-analysis[J/OL].J Neurol Neurosurg Psychiatry,2015,86(7):767-773.
[20]马强,谷新医,王久武,等.早期应用盐酸多奈哌齐对帕金森病伴轻度认知障碍的随机对照研究[J].中国现代医生,2010,48(16):36, 43.
[21]Petzinger GM,Fisher BE,Mcewen S,et al.Exercise-enhanced neuroplasticity targeting motor and cognitive circuitry in Parkinson's disease[J].Lancet Neurol,2013,12(7):716-726.
(2015-10-25收稿)
【中图分类号】R749.1
【文献标识码】A
【文章编号】1007-0478(2016)02-0129-03
