BRAF 抑制剂PLX4032和放疗联合治疗高级神经胶质瘤
2016-05-26张春满郑云峰米娟
张春满 郑云峰 米娟
716000 延安大学附属医院神经外科[张春满(通信作者) 郑云峰 米娟]
BRAF 抑制剂PLX4032和放疗联合治疗高级神经胶质瘤
张春满郑云峰米娟
716000延安大学附属医院神经外科[张春满(通信作者)郑云峰米娟]
【摘要】目的探讨BRAF抑制剂PLX4032联合放疗对高级别神经胶质瘤的疗效。方法选择两株细胞分别为AM-38(BRAF V600E)和GBM8(BRAF wildtype),用Cell Titre Glo 方法检测细胞的IC50;用克隆形成实验检测PLX4032对不同放射剂量的增敏作用;用流式细胞仪检测PLX4032和放疗对细胞凋亡和周期的作用。结果PLX4032显著抑制BRAF V600E 细胞的增殖(IC50=2 μM)而对野生型细胞没有作用;克隆形成实验发现在BRAF V600E 细胞上随着剂量增加,联合治疗组比单独放疗组的抑制作用更显著(P<0.05),而野生型细胞株上联合组和单独放疗组没有显著性差异(P>0.05);流式细胞分析发现在BRAF V600E突变细胞上,联合治疗组细胞凋亡数显著增加,与对照组和单独治疗组相比有显著差异(P<0.05),而在野生型细胞株上没有显著性差异;流式分析发现在BRAF V600E突变细胞上,与对照组相比,单独放疗组和联合治疗组在G0/G1期细胞数都减少,G2/M 期细胞数增加,而且联合治疗组与单独放疗组相比有显著差异。结论BRAF抑制剂PLX4032 与放疗联合治疗BRAF V600E突变的高级别神经胶质瘤的疗效较好。
【关键词】BRAF抑制剂放疗神经胶质瘤
【DOI】10.3969/j.issn.1007-0478.2016.02.007
高级神经胶质瘤(high-grade glioma,HGG)目前主要通过手术切除,然后辅以放疗以及化疗进行治疗,这些方式在其治疗上取得一定进展,延长了患者的生存期,总的中位生存期不超过15个月[1]。尽管随着对肿瘤基因的不断深入研究,已经为肿瘤的个体化治疗开拓了新的道路,但由于肿瘤是基因异质性的,当单独用靶向药物进行治疗时会形成耐药,因此迫切寻找新方法来改善治疗效果,特别是对于难治性神经系统恶性肿瘤[2]。
RAF在脑肿瘤的形成和治疗过程中都有重要作用[3]。基因学研究表明BRAF V600E在人类肿瘤发生进展中作为癌基因发挥作用,这些脑肿瘤患者包括少量的成人脑肿瘤和6%~25%的儿科脑瘤[4]。体外研究表明RAF 的持续激活也能促进胶质瘤的形成。有一项研究报道发现BRAF V600E 突变的儿科胶质瘤比野生型儿科胶质瘤患者在治疗以及预后方面表现更差[5]。大量文献表明RAF的持续激活或者过表达在放疗的响应过程中也具有重要作用[6]。
BRAF V600E抑制剂可通过抑制MAPK磷酸化从而导致细胞周期阻滞以及增加细胞凋亡[7]。FDA批准威罗替尼(PLX4032)用于靶向BRAF V600E突变的黑色素肿瘤治疗[8],而且临床前数据表明PLX4032和放疗联合可用于治疗不同肿瘤[9]。因此,本研究通过PLX4032和放疗联合治疗BRAF V600E突变的脑神经胶质瘤,以期为该靶向药物与放疗联合治疗脑肿瘤能够进入临床应用提供依据。
1材料与方法
1.1细胞培养及突变检测
BRAF突变和野生型细胞株为AM-38和GBM8,购自中科院上海细胞库,用含10%FBS胎牛血清(FBS,hyclone)的DMEM培养基,放置于37℃、5%CO2的恒温培养箱中进行培养。细胞进行BRAF基因序列的检测,确认AM-38存在BRAF V600E突变,GBM8为野生型。
1.2细胞增殖实验
用Cell Titre Glo试剂盒(购自Promega公司)进行检测,细胞接种到96孔板中,每孔100 uL培养基,2000~3000个细胞数,加入不同浓度药物进行处理72 h后每孔加入25 uL Cell Titre Glo 检测试剂,酶标仪读板对活细胞数进行检测,并计算每株细胞的半数抑制浓度IC50。每个药物浓度设置3个复孔。
1.3细胞凋亡和周期检测
每个6 cm培养皿铺1×106个细胞。将细胞分4组:对照组、药物组(5 μM PLX4032)、放射组(培养6 h进行6 Gy照射后继续培养)及联合组(含5 μM PLX4032的培养液培养6 h进行6 Gy照射后继续培养);72 h后收集细胞,采用Annexin V-FITC和PI双染细胞(BD Pharmigen TM, San Diego, CA),流式细胞仪进行凋亡检测;每组重复3个样本; 24 h后收集细胞,预冷70%乙醇固定后用PBS洗涤3次,每次5 min,加100 μL含RNase A的37℃水浴30 min,加入400 μL PI染色混匀.4℃避光30 min,用流式细胞仪检测,每组重复3个样本,取均值。
1.4克隆形成实验
细胞用胰酶消化处理后重悬保证形成单个细胞,将细胞接种到6孔板中,每个孔中的细胞数为500个,接种24 h 之后加入不同浓度药物进行处理,药物处理24 h后分别照射不同剂量治疗(0、2、4、6 Gy),每个剂量设置3个复孔;分为4组:对照组、药物组、单纯放射组以及联合联合组。药物组和联合治疗组中的浓度根据细胞增殖实验中得到的IC25(最大抑制浓度的25%)设置。每天观察,10~14 d后,细胞数50个以上为1个克隆4% PFA固定后,结晶紫染色,对克隆数进行检测。
1.5统计方法
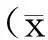
2结果
2.1PLX4032对两株细胞的抑制率
利用Cell Titre Glo试剂盒对两株细胞PLX4032的IC50进行检测发现,AM38 BRAFV600E突变细胞株上为(2±0.35)μM,而在GBM BRAF 野生型细胞株未检测到(>20 μM)(表1)。

表1 BRAF突变状态以及PLX4032在两株细胞上的IC50
2.2PLX4032对细胞放射增敏作用
用克隆形成实验检测BRAF 抑制剂对放疗的增敏作用,选择PLX4032 0.5 μM与2、4、6三个不同放射剂量进行联合,发现对于GBM6(BRAF野生型)细胞,随着放射剂量的增加,联合治疗组和单纯放疗组没有显著性差异(P>0.05),而对于AM38(BRAF V600E)细胞,随着放射剂量增加,联合治疗组与单纯放疗组有显著性差异(P<0.05)。

图1 BRAF抑制剂对疗效的增敏作用
2.3PLX4032对细胞凋亡作用
由图2可以看到,在BBM6 BRAF 野生型细胞上药物组、单纯放射组以及联合治疗组对细胞凋亡没有明显影响(P>0.05);在AM38BRAF V600E 突变细胞上联合治疗组与单纯放疗组、药物组相比有显著性差异(P<0.05),联合治疗组细胞凋亡比例达到49.3%。
2.4PLX4032对细胞周期作用
流式细胞仪检测对细胞AM38(V600E)周期的影响发现,与对照组相比,发现药物组、单纯放射组以及联合治疗组的细胞G0/G1期细胞数明显减少(P<0.05),联合治疗组该期细胞数最少;同时与联合治疗相比,药物组以及单纯放疗组G0/G1期细胞数也有显著性差异(P<0.05)。与对照组相比,药物组、单纯放疗组以及联合治疗组G2/M 期细胞数明显增加(P<0.05),联合治疗组增加最明显;与联合治疗组相比较,药物组以及单纯放疗组G2/M期细胞数目也有显著性差异(P<0.05)(表2)。
3讨论
随着科学发展证明分子通路可促进神经胶质瘤的形成,从而使得脑瘤的靶向治疗已成为临床实验的重点[4,10]。以前的研究已经表明RAF的持续激活在放射治疗中具有一定作用[5],而且几种新型靶向BRAFV600E抑制剂已经在临床上得到检验,其中dabrafenib已被证明可通过血脑屏障有效抑制BRAF V600E突变的脑转移瘤7,11]。放疗在高级别神经胶质瘤和复发胶质瘤的治疗中起着关键作用,对于患者的生存和预后都有重要影响[12];体外数据也表明放疗和BRAF V600E靶向抑制剂联合具有一定协同作用以及在体内动物模型的数据也已经表明放疗可以增加BRAF V600E黑色素瘤细胞株对BRAF V600E抑制剂的敏感性,同时越来越多的研究报道发现靶向药物的耐药性极大限制药物在临床上的进一步应用[13]。因此,研究RAF抑制剂和放疗联合治疗BRAF V600E突变的胶质瘤具有很重要的临床应用价值。

图2 PLX4032和放疗对细胞凋亡的影响注:与PLS+XRT(联合治疗组)比较,*P<0.05。

表2 流式细胞仪检测细胞周期分布
注:与对照组相比,*P<0.05;与药物组以及单纯放疗组比较,#P<0.05
克隆形成实验是放射生物学检测细胞毒性的标准方法,成克隆的细胞必为贴壁和有增殖活力的细胞,同时克隆形成率反映细胞群体依赖性和增殖能力两个重要性状[14]。本研究通过克隆形成实验结果表明,PLX4320(一个BRAF V600E抑制剂)与放疗联合在BRAFV600E突变的神经胶质瘤细胞上具有联合抑制作用,其中BRAF V600E抑制剂用了较低的浓度IC25,而这种联合作用在野生型的胶质瘤细胞株上没有作用,这一结果与在黑色素瘤细胞上的一些临床前的数据基本一致[15]。但是该抑制剂与放疗联合作用具体是叠加还是协同本研究并没有进一步分析,有待于下一步研究,同时对于这种联合作用还存在着一定争议,Dasgupta的研究结果表明BRAF抑制剂和放疗在体外具有叠加作用[16-17],而Nicolaides的研究证实在体外和体内都具有协同作用[5]。流式细胞仪分析发现联合治疗组在BRAF V600E胶质瘤细胞上显著增加了细胞凋亡,与单独放疗组和对照组相比都具有显著性差异,而在野生型细胞中对细胞凋亡没有明显作用。对于细胞周期进行分析发现,联合治疗组细胞在G2/M期细胞数明显增加,从而表明靶向治疗和放疗结合可将细胞周期阻滞在G2/M期,这一结果跟另外一项研究的结果有差异,Sala等人报道发现BRAF 抑制剂和放疗结合可将细胞周期阻滞在G0/G1期[18],可能本研究与Sala等研究用的BRAF特异性抑制剂(PLX4720)不同以及用到的浓度和放射剂量不同。
BRAF V600E抑制剂PLX4032已经被FDA批准用于治疗BRAFV600E突变的转移性黑色素瘤以及GSK2118436(dabrafenib)目前也在临床试验阶段,因此安全有效的BRAF V600E抑制剂可被临床上用于黑色素瘤、甲状腺瘤以及结直肠癌的治疗,并且PLX4032的临床试验证实BRAF V600E 突变肿瘤的治疗通过单一的靶向药物治疗疗效并不理想。本研究结果表明放疗和BRAF V600E抑制剂联合可导致BRAF V600E细胞的周期阻滞、凋亡增加以及降低克隆形成,从而为靶向BRAF V600E这一有前景的抑制剂在临床上能够得到广泛的应用提供了一定依据。
参考文献
[1]Lecavalier-Barsoum MQ,Abdulkarim B.Adjuvant treatment of anaplastic oligodendrogliomas and oligoastrocytomas[Z],2014:CD007104.
[2]Perez-Herrero E,Fernandez-Medarde A.Advanced targeted therapies in cancer:Drug nanocarriers,the future of chemotherapy[Z],2015:52-79.
[3]Horbinski,C.To BRAF or not to BRAF:is that even a question anymore[J]. Neuropathol Exp Neurol,2013,72(1):2-7.
[4]Berghoff AS,Preusser M.BRAF alterations in brain tumours: molecular pathology and therapeutic opportunities[J].Curr Opin Neurol,2014,27(6):689-696.
[5]Nicolaides TP,Li HF,Solomon DA,et al.Targeted therapy for BRAF(V600E) malignant astrocytoma[J].Clinical Cancer Research,2011,17(24):7595-7604.
[6]Myung JK,Cho H,Park CK,et al.Analysis of the BRAF(V600E) mutation in central nervous system tumors[J].Transl Oncol,2012,5(6):430-436.
[7]McArthur,G A.Safety and efficacy of vemurafenib in BRAF(V600E)and BRAF(V600K)mutation-positive melanoma(BRIM-3):extended follow-up of a phase 3,randomised,open-label study[J].Lancet Oncol,2014,15(3):323-332.
[8]Chapman PB,Hauschild A,Robert C,et al.Improved survival with vemurafenib in melanoma with BRAF V600E mutation[J].N Engl J Med,2011,364(26):2507-2516.
[9]Ducassou,A, Delannes, M, Delannes, M,etal. Radiosensitization induced by vemurafenib[J].Cancer radiother,2013,17(4):304-307.
[10]Koelsche,C.Mutant BRAF V600E protein in ganglioglioma is predominantly expressed by neuronal tumor cells[J].Acta Neuropathol,2013,125(6):891-900.
[11]Schiffman JD,Hodgson JG,Vandenberg SR,et al.Oncogenic BRAF mutation with CDKN2A inactivation is characteristic of a subset of pediatric malignant astrocytomas[J].Cancer Res,2010,70(2):512-519.
[12]Shaw EG,Wang MH,Coons SW,et al.Randomized trial of radiation therapy plus procarbazine, lomustine, and vincristine chemotherapy for supratentorial adult Low-Grade glioma: initial results of RTOG 9802[J].Journal of Clinical Oncology,2012,30(25):3065-3070.
[13]Ravnan MC,Matalka MS.Vemurafenib in patients with BRAF V600E mutation-positive advanced melanoma[J].Clin Ther,2012,34(7):1474-1486.
[14]苏筠,楚建军,任峰,等.丙戊酸钠对人脑胶质瘤细胞系SHG-44的放疗增敏作用[J].实用医学杂志,2013,29(2):296-299.
[15]Larkin J,Del Vecchio M,Ascierto PA,et al.Vemurafenib in patients with BRAF(V600) mutated metastatic melanoma: an open-label, multicentre, safety study[J].Lancet Oncology,2014,15(4):436-444.
[16]Dasgupta T,Haas-Kogan DA,Yang XD,et al.Genotype-dependent cooperation of ionizing radiation with BRAF inhibition in BRAF V600E-mutated carcinomas[J].Invest New Drugs,2013,31(5):1136-1141.
[17]Dasgupta,T.Survival advantage combining a BRAF inhibitor and radiation in BRAF V600E-mutant glioma[Z],2015.
[18]Sala E,Mologni L,Truffa S,et al.BRAF silencing by short hairpin RNA or chemical blockade by PLX4032 leads to different responses in melanoma and thyroid carcinoma cells[J].Mol Cancer Res,2008,6(5):751-759.
(2015-12-09收稿)
The effect of combining BRAF inhibitor PLX4032 and radiation in advanced glioma
ZhangChunman,ZhengYunfeng,MiJuan.
DepartmentofNeurosurgery,AffiliatedHospitalofYananUniversity,Yanan716000
【Abstract】ObjectiveTo investigate the role of BRAF inhibitor PLX4032 in combination with radiotherapy on advanced glioma. MethodsBRAF V600E-mutated cancer cell line(AM-38)and BRAFV600E wild-type cancer cell line(GBM8)were obtained. We performed cell viability assay to detect the IC50of the inhibitor PLX4032 by the Cell Titre Glo assay and clonogenic assays using combinations of radiation and PLX4032. Cell apoptosis and cell cycle were evaluated by flow cytometry. ResultsPLX4032 significantly inhibited the proliferation of BRAF V600E cells (IC50= 2 μM) and had no effect on wild-type cells. By clonogenic assay, combination group had more significant inhibitory effect than radiotherapy alone group for BRAF V600E cells with increasing dose (P<0.05), while there was no significant difference (P>0.05) on the wild-type cell lines between radiotherapy alone group and the combination group. For apoptosis, flow cytometry analysis showed that cell apoptosis proportion of combination group were significantly different compared to the control group and alone group in the BRAF V600E cells (P<0.05), whereas there's no significant differences in the wild-type cell lines. For the cell cylcle, flow analysis found that alone and combined groups have reduced the number of G0/G1 phase of the cell and caused the cell G2/M phase arrest compared to the control group in the BRAF V600E mutated cell. There were significant difference between the combination group and alone groups. ConclusionThese studies provide the pre-clinical rationale for clinical trials of concurrent radiotherapy and BRAF V600E inhibitors.
【Key words】BRAF inhibitorRadiation therapyGlioma
【中图分类号】R739.4
【文献标识码】A
【文章编号】1007-0478(2016)02-0098-04
