Notch信号通路在骨髓间充质干细胞分化为心肌细胞过程中的作用
2016-05-25张梦迪路仲达宋春敬
张梦迪, 路仲达,何 易,苗 戎, 宋春敬
(天津中医药大学,天津 300193)
Notch信号通路在骨髓间充质干细胞分化为心肌细胞过程中的作用
张梦迪, 路仲达,何 易,苗 戎, 宋春敬
(天津中医药大学,天津 300193)
骨髓间充质干细胞(MSCs)具有多向分化潜能,可以通过细胞移植治疗多种疾病,并且在一定的条件下可以通过诱导分化为心肌细胞(CMs),为治疗心血管疾病带来了希望。在细胞的增殖和分化中,Notch信号通路起到了非常重要的作用,本文对在MSCs分化为CMs过程中Notch信号通路的具体作用做一综述。
骨髓间充质干细胞;心肌细胞;Notch信号通路
心血管疾病危害巨大,病死率居高不下。所有的心脏疾患,特别是心肌梗死,常导致心肌细胞(CMs)的死亡,进而导致心力衰竭[1]。心肌细胞死亡后不可再生,梗死处有成纤维细胞增殖形成瘢痕组织,造成功能性心肌细胞的缺失。而骨髓间充质干细胞(MSCs)是一种具有多分化潜能的干细胞,具有自我更新及增殖能力,并可以多向分化为软骨细胞、脂肪细胞、成骨细胞、神经细胞等[2-4],将MSCs诱导成为心肌细胞,为现代临床治疗心脏疾患提供了新思路。Notch信号通路是一种高度保守的信号传导,具有精确调控细胞增殖、分化的能力。以下就MSCs分化为CMs过程中Notch信号通路所发挥的作用做一综述。
1 Notch信号通路
Notch信号通路是一种广泛存在于脊椎和无脊椎动物中,为生物进化中高度保守的信号通路,在细胞的增殖、分化、凋亡中起到了重要的作用[5]。Notch基因于1919年首次被发现,摩尔根及同事们发现在果蝇的翅膀上出现了一些突变的缺口(Notchs)而将其命名为Notch基因[6]。目前研究发现,Notch受体(即Notch蛋白)在不同的物种之间以及同种物种的不同个体中具有高度的结构同源性。在果蝇中,只有一个Notch基因编码的Notch受体;在人类中,有Notch1、Notch2、Notch3、Notch4四种Notch受体,其中Notch1受体的表达更为广泛[7-11]。Notch受体是一种膜蛋白受体,由胞外区(NFC)、跨膜区和胞内区(NCID)构成。Notch信号通路的配体亦为一种膜蛋白,表达在临近细胞的细胞膜上。Notch配体分为Delta和Serrate (哺乳动物为Jagged)[12],与其同源的分别为delta-like1、delta-like3、delta-like4(亦称Delta1、Delta3、Delta4 或Dll1、Dll3、Dll4)及Jagged1,故Notch配体统称为DSL蛋白。Notch通路就是邻近细胞间传递通讯的重要信号分子。Notch信号通路的活化有两条路径,分别是经典信号通路和CSL非依赖信号通路。
1.1 Notch经典信号通路 经典Notch信号通路又称为CBF-1/RBP-JK依赖途径。Notch信号传导在活化的过程中需要进行三次裂解。第一次裂解发生在细胞内,细胞内合成的Notch在成熟过程中,于高尔基体内在furin样转化酶(furin-like covertase)的作用下发生裂解,裂解后的两部分亚基由二硫键相连接,分别为胞外区和跨膜片段(NTM)。后两次裂解均发生Notch蛋白与配体的结合过程中,配体和受体的结合促进了溶蛋白酶性裂解。第二次裂解在ADAM家族金属蛋白酶(ADAM-family metalloproteases)的作用下发生,ADAM10/肿瘤坏死因子-α转换酶TACE(TNF-α-converting enzyme,亦称ADAM17)将NTM裂解为两个片段,胞外区被配体表达细胞所吞噬,胞内区完成第三次裂解。第三次裂解在由早老素(presenilin)、nicastrin、PEN2 和 APH1组成的γ-分泌酶(γ-secretase)的介导下发生,此次裂解产生Notch蛋白的胞内区及活化形式NICD。NICD转移至细胞核内。细胞核内存在DNA结合蛋白CSL[CBF-1、Su(H)、LAG-1]。其中CBF-1(C-promoter binding factor-1)在哺乳动物体内被称为RBP-JK(recombination signal binding protein-JK),是转录抑制因子,其自身能募集沉默因子SMRT以及蛋白去乙酰化酶等组成复合物,抑制下游基因的转录。NICD的RAM区与其相结合,CSL与抑制物解离,并募集辅激活因子Mam,形成三元络合转录激活物(NICD-CSL-Mam),进而启动下游Notch靶基因的转录[12-15]。
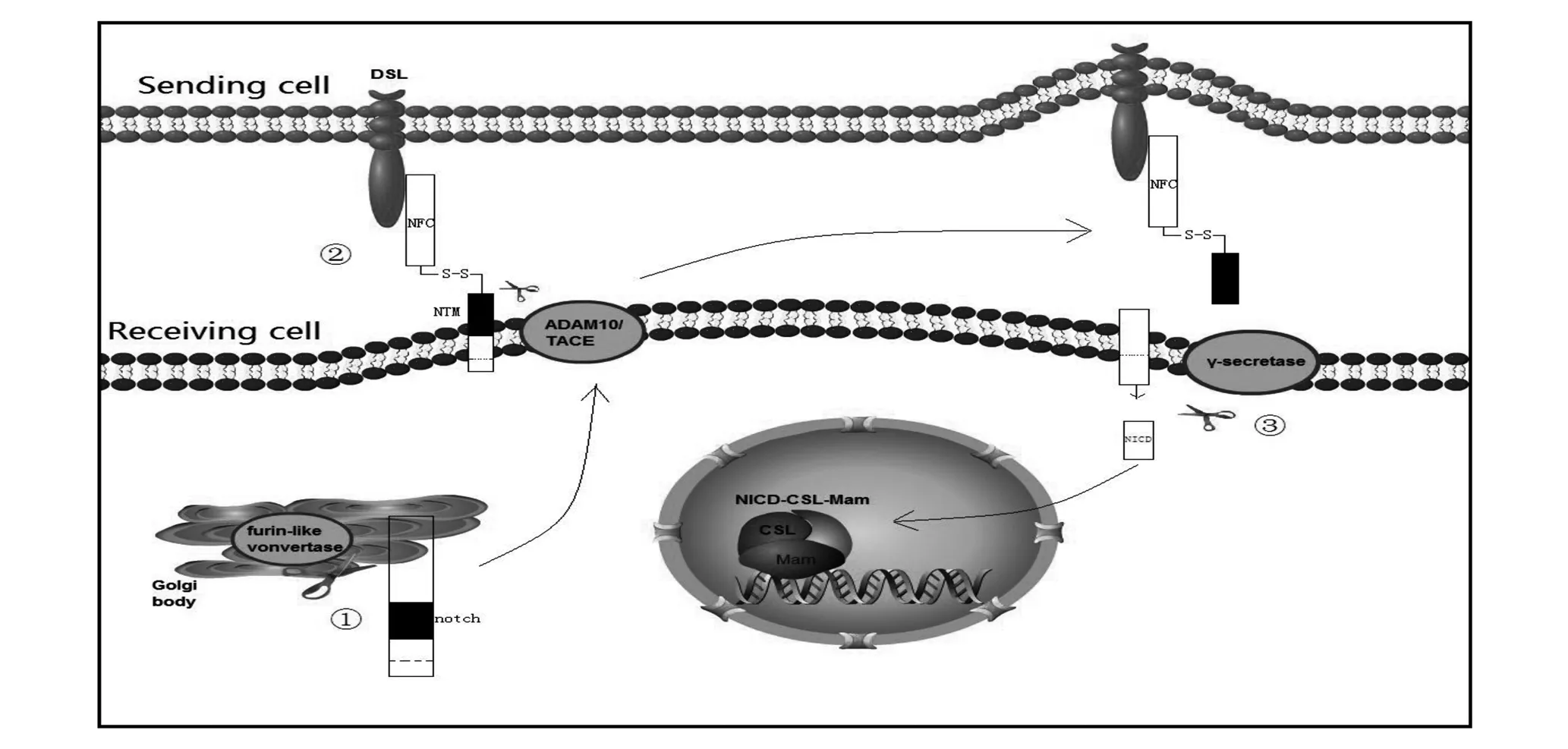
图1 经典Notch信号通路核心概略图
1.2 CSL非依赖信号通路 目前的研究中对于CSL非依赖信号通路的机制还不甚明确,其信号通路也可能不止一条。但目前有明确的研究可以显示,Deltex 蛋白介导了一部分CSL非依赖的Notch信号[15]。Deltex作为Notch配体的一种,与其同源的称为Deltex或Deltex-like。在哺乳动物体内,Deltex可以分为Deltex-1、Deltex-2、Deltex-3和Deltex-4。Deltex-1是Notch信号通路的一种下游分子,在一定程度上可增强或抑制Notch信号表达[16]。Deltex-1在蛋白结构上高度保守,含有DomainⅠ、DomainⅡ和DomainⅢ三个结构域。其中DomainⅠ是Deltex蛋白的最必需成分,可在胞内与Notch信号的胞内区上的ANK重复结构相结合,来调节Notch信号的表达[17]。Arias 等[18]的实验证明了在基因突变的果蝇中存在CSL非依赖途径,后又在哺乳动物的体外实验中进行了验证,证明该通路的存在。但目前CSL非依赖信号通路的具体机制不明,尚待继续研究。
2 Notch信号通路对心肌细胞的双向调节作用
Notch信号通路干预了心肌细胞的分化,Wang等[19]的研究显示 MicroRNA-375(MIR-375)在心肌细胞的分化中有重要作用,并且是通过破坏Notch信号通路这一途径。有研究发现,激活Notch信号通路可以加快心肌梗死后心功能的恢复[20]。Zhou等[21]的实验可以证实激活Notch信号通路在心肌梗死后缺血处恢复心功能,起到了心肌保护的作用。有研究表明[22],Notch1可增强Nkx2.5的表达进而促进心脏祖细胞(cardiac progenitor cells,CSCs)向心肌细胞的分化。Notchl可刺激CSCs的增殖,且Notch信号通路的激活也促进了CSCs向心肌细胞分化[23,24]。因此,在心肌细胞分化早期,Notch信号通路促进心肌细胞的分化。
同时有实验表明,Notch1在乳鼠心肌细胞内的表达升高,随着心肌逐渐发育,Notch1表达逐渐降低[25]。Rones等[26]采用NICD在爪蟾的stage22、28(爪蟾心脏中胚叶早期分化阶段)时期激活内源性Notch信号通路可以导致心肌标志物 cTnI、MHC 和心肌α-actin 的下调,而抑制Notch 信号通路则得到的结论相反。Chau等[27]在鸡心脏的心室中转染NICD持续性活化Notch信号通路会抑制心肌相关基因MHC、α-actin的蛋白表达,反之抑制Notch信号通路后也可以得到相反的结果。所以,Notch信号通路对心肌细胞起到了双向调节的作用,早期起到了促进作用,而中后期发挥抑制作用。
3 Notch信号通路在MSCs分化为CMs中的作用
3.1 Notch信号通路与MSCs增殖的关系 牛萍等[28]在体外分离培养骨髓间充质干细胞,用Western blot法检测体外分离培养的骨髓间充质干细胞在增殖、分化过程中Notch信号蛋白PS1的表达。实验结果表明,用免疫印迹检测可以发现骨髓间充质干细胞中存在着Notch1 -Jagged1通路,说明了Notch信号系统对体外培养的MSCs有调控作用。杜红阳等[29]为明确Notch1在MSCs增殖过程中的作用,构建Notch1(NICD)过表达质粒并转染MSCs。实验结果显示,NICD过表达后相比对照组,活细胞比率下降,而早期凋亡率和晚期凋亡率上升。且观察发现,转染后的细胞生存期较短,在排除转染试剂的影响下,考虑过表达Notch1表型激活了Notch信号通路,抑制了MSCs的增殖。Khatib等[30]的实验表明通过体内P53凋亡途径Notch信号活化可诱导细胞的凋亡。然而最新研究则表明,利用DAPT阻断Notch信号通路,MSCs的增殖较对照组降低,MSCs的增殖也受到了抑制[31]。杜红阳和郑介柏的实验分别激活和阻断Notch信号通路均会导致MSCs的增殖受到了抑制,但其实验中与对照组相比整体的生长曲线变化规律均很相似,这也说明了在MSCs体外增殖的过程中不仅是Notch信号通路进行调节,而是多条信号通路的相互配合,从而调控了MSCs的增殖。
3.2 Notch信号通路与MSCs分化为CMs的关系 邓海燕等[32]的实验中,利用慢病毒miR-1转染MSCs向心肌细胞分化,观察此过程中Notch信号通路相关蛋白的表达。在原代MSCs中,Notch信号通路相关蛋白Notch1、Jagged1、Hey1和Hey2高度表达,Dll1、Dll3、Dll4、Notch2、Notch3 和Notch4中等表达。而在诱导后的心肌样细胞中的Jagged1、Notch1、Notch3、Hey2(心脏发育早期在心室表达,后期表达逐渐降低[33-34])的mRNA 水平随着观察时间的延长而逐渐下调。配体中Jagged1的含量下调最为显著,受体分子中则以Notch1、Notch3 表达水平变化最为显著。根据此实验结果可以推测,Notch1 、Notch3 在 MSCsmiR-1向心肌样细胞分化过程中发挥重要的调控作用。这一实验结果,也与Nemir等[35]的关于胚胎干细胞的实验一样,即Notch1信号的下调可以诱导胚胎干细胞向心肌细胞分化的结论大致相似。表明在MSCs向CMs分化的过程中,Notch1、Notch3发挥重要的作用,通过其表达下调进而抑制Notch信号通路诱导MSCs向心肌细胞分化。刘昕超[36]的实验中,体外培养的猪骨髓间充质干细胞P0~P5中,Notch4的含量逐渐下降。相对应诱导不同代数MSCs可发现,P1分化比例较低,P2~P4分化比例则相对较高。研究结果表明,随着体外培养时间的延长,MSCs向心肌分化的能力越强,而Notch4的含量却逐渐下降。证明了猪MSCs在向心肌细胞分化的过程中Notch4下调。此实验也从一个侧面印证了Nemir等[35]的实验。Notch信号通路中Notch1、Notch3及Notch4等信号下调,抑制了Notch信号通路,促进骨髓间充质干细胞向心肌细胞的分化。
然而Shi等[37]的研究中用5-Aza或血管紧张素Ⅱ诱导MSCs心肌样分化,RT-PCR结果显示诱导组比对照组的DLL1、DLL4、Jagged1的和Notch1的基因更高的水平表达。因此在不同的背景下Notch信号的作用不尽相同。
4 展望
现今社会,心血管疾病的病死率高居不下,给家庭和社会带来了重大危害。一直以来,科研人员探寻新思路,通过体外骨髓间充质干细胞增殖、分化成心肌细胞,以解决心肌梗死后心肌细胞不能再生的难题。骨髓间充质干细胞取材方便,技术相对成熟,并且具有多向分化潜能,具有很强的可塑性,为心血管疾病的治疗带来了新的曙光。研究MSCs分化过程中Notch信号通路,为MSCs的分化研究打下了基础,为临床试验提供了基础支持。
1 Mias C, Genet G, Pathak A,etal. Adult resident cardiomyocytes wake up: new axis for cardiac tissue regeneration[J]. Med Sci, 2012, 28(12): 1103-1109
2 Kim N, Cho S G. Clinical applications of mesenchymal stem cells[J]. Korean J Int Med, 2013, 28(4): 387-402
3 Zheng Y H, Xiong W, Su K,etal. Multilineage differentiation of human bone marrow mesenchymal stem cells in vitro and in vivo[J]. Exper Therap Med, 2013,5(6): 1576-1580
4 Spoliti M, Iudicone P, Leone R,etal. In vitro release and expansion of mesenchymal stem cells by a hyaluronic acid scaffold used in combination with bone marrow[J]. Muscl, Lig Tendons J, 2012, 2(4): 289
5 Schwanbeck R, Martini S, Bernoth K,etal. The notch signaling pathway: Molecular basis of cell context dependency[J]. Europ J Cell Biol, 2011, 90(6-7): 572-581
6 Morgan T H. goodale's experiments on gonadectomy of fowls[J]. Science, 1917,45(1168):483-484
7 Ellisen L W, Bird J, West D C,etal. TAN-1, the human homolog of the Drosophila notch gene, is broken by chromosomal translocations in T lymphoblastic neoplasms[J]. Cell, 1991, 66(4): 649-661
8 Lindsell C E, Shawber C J, Boulter J,etal. Jagged: a mammalian ligand that activates Notch1[J]. Cell, 1995, 80(6): 909-917
9 Weinmaster G, Roberts V J, Lemke G. Notch2: a second mammalian Notch gene[J]. Development, 1992, 116(4): 931-941
10 Rao P K, Dorsch M, Chickering T,etal. Isolation and characterization of the notch ligand delta4[J]. Exper Cell Res, 2000, 260(2): 379-386
11 Kopan R. Notch signaling[J]. Cold Spring Harbor Perspect Biol, 2012, 4(10): a011213
12 Bray S J. Notch signalling: a simple pathway becomes complex[J]. Nat Rev Mol Cell biol, 2006, 7(9): 678-689
13 Artavanis-Tsakonas S, Rand M D, Lake R J. Notch signaling: cell fate control and signal integration in development[J]. Science, 1999, 284(5415): 770-776
14 Schweisguth F. Regulation of notch signaling activity[J]. Curr Biol, 2004, 14(3): R129-R138
15 Radtke F, Raj K. The role of Notch in tumorigenesis: oncogene or tumour suppressor[J]. Nat Rev Cancer, 2003, 3(10): 756-767
16 Zhang P, Yang Y, Nolo R,etal. Regulation of NOTCH signaling by reciprocal inhibition of HES1 and Deltex 1 and its role in osteosarcoma invasiveness[J]. Oncogene, 2010, 29(20): 2916-2926
17 Hsiao H W, Liu W H, Wang C J,etal. Deltex1 is a target of the transcription factor NFAT that promotes T cell anergy[J]. Immunity, 2009, 31(1): 72-83
18 Arias A M. New alleles of Notch draw a blueprint for multifunctionality[J]. Trends Genet, 2002, 18(4): 168-170
19 Wang L, Song G, Liu M,etal. MicroRNA-375 overexpression influences P19 cell proliferation, apoptosis and differentiation through the Notch signaling pathway[J]. Int J Mol Med, 2015,37(1):47-55
20 Li Y, Hiroi Y, Ngoy S,etal. Notch1 in bone marrow-derived cells mediates cardiac repair after myocardial infarction[J]. Circulation, 2011, 123(8): 866-876
21 Zhou X L, Wan L, Xu Q R,etal. Notch signaling activation contributes to cardioprotection provided by ischemic preconditioning and postconditioning[J]. J Transl Med, 2013, 11: 251
22 Boni A, Urbanek K, Nascimbene A,etal. Notch1 Regulates the Fate of Cardiac Progenitor Cells[J]. Proc Nation Acad Sci, 2008, 105(40): 15529-15534
23 Croquelois A, Domenighetti A A, Nemir M,etal. Control of the adaptive response of the heart to stress via the Notch1 receptor pathway[J]. J Exper Med, 2008, 205(13): 3173-3185
24 Campa V M, Gutiérrez-Lanza R, Cerignoli F,etal. Notch activates cell cycle reentry and progression in quiescent cardiomyocytes[J]. J Cell Biol, 2008, 183(1): 129-141
25 Collesi C, Zentilin L, Sinagra G,etal. Notch1 signaling stimulates proliferation of immature cardiomyocytes.[J]. J Cell Biol, 2008, 183(1): 117-128
26 Rones M S, McLaughlin K A, Raffin M,etal. Serrate and Notch specify cell fates in the heart field by suppressing cardiomyogenesis[J]. Development, 2000, 127(17): 3865-3876
27 Chau M D L, Tuft R, Fogarty K,etal. Notch signaling plays a key role in cardiac cell differentiation[J]. Mechan Develop, 2006, 123(8): 626-640
28 牛萍,赵月强,黄星原. 骨髓间充质干细胞体外增殖及分化过程中Notch信号的表达变化[J]. 基础医学与临床, 2011, 31(11): 1205-1209
29 杜红阳, 李东宁, 付海燕,等. Notch1(NICD)过表达真核载体构建及对大鼠BMSCs增殖分化的影响[J].天津医药, 2014, 42(9): 883-888
30 El Khatib M, Bozko P, Palagani V,etal. Activation of Notch signaling is required for cholangiocarcinoma progression and is enhanced by inactivation of p53 in vivo[J]. Plos One, 2013, 8(10): e77433
31 郑介柏, 刘旭良, 陈文雄,等. DAPT 阻断 Notch信号通路抑制去势大鼠骨髓间充质干细胞增殖及诱导其成骨分化的作用研究[J]. 河北医学, 2015, 21(1): 9-12
32 邓海燕, 曾俊义, 魏云峰,等. microRNA-1诱导大鼠骨髓间充质干细胞向心肌样细胞分化过程中Notch信号分子的表达变化[J]. 基础医学与临床, 2014, 34(9): 1204-1210
33 Gridley T. Notch signaling and inherited disease syndromes.[J]. Hum Mol Genet, 2003,12(7):R9-13
34 Weber D, Heisig J, Kneitz S,etal. Mechanisms of epigenetic and cell-type specific regulation of Hey target genes in ES cells and cardiomyocytes[J]. J Mol Cellular Cardiol, 2015, 79: 79-88
35 Nemir M, Croquelois A, Pedrazzini T,etal. Induction of cardiogenesis in embryonic stem cells via downregulation of Notch1 signaling[J]. Circul Res, 2006, 98(12): 1471-1478
36 刘昕超. 猪骨髓间充质干细胞体外向心肌样细胞分化过程中Notch4下调[D]. 北京:北京协和医学院, 2009:22-25,29-31
37 Shi J, Xing W, Yang J,etal. Comparison and Mechanism Research of the Differentiation of Bone Mesenchymal Stem Cells Into Cardiomyocytes Induced by 5-Azacytidine or Angiotensin II[J]. J Biomat Tiss Engin, 2015, 5(5): 364-371
The role of Notch signaling pathway in the differentiation of bone marrow-derived mesenchymal stem cells (BMSCs) to Cardiomyocytes
ZHANG Mengdi1, LU Zhongda2, HE Yi1, MIAO Rong3, SONG Chunjing3
(Tianjin University of Traditional Chinese Medicine 1. Institute of Traditional Chinese Medicine;2. College of Chinese Materia Medica; 3. College of Integrated Chinese and Western Medicine, Tianjin 300193, China)
Bone marrow mesenchymal stem cells (MSCs) has the potential of multi-directional differentiation, making curing various diseases through cell transplantation become possible. In addition, MSCs can also be induced and differentiate into cardiomyocytes (CMS) under certain conditions,which brings hope for the treatment of cardiovascular diseases. In the proliferation and differentiation of cells, Notch signaling pathway plays a key role. In this thesis, we will make a general summarize of the specific role Notch signaling pathway plays in the differentiation of MSCs into CMs.
Bone marrow mesenchymal stem cell; Cardiomyocyte; Notch signaling pathway
2015-11-23
2012年国家自然科学基金(No.81173413),2014年国家级大学生创新创业训练计划项目(No.201410063014)
R54
A
1006-5687(2016)01-0066-04
