唑来膦酸钠治疗高龄绝经后骨质疏松症的临床研究
2016-05-25杜晓红
杜晓红,杜 磊
(1.解放军第254医院急救康复中心军人门诊部,天津 300020; 2.天津警备区第二干休所,天津 300191)
唑来膦酸钠治疗高龄绝经后骨质疏松症的临床研究
杜晓红1,杜 磊2
(1.解放军第254医院急救康复中心军人门诊部,天津 300020; 2.天津警备区第二干休所,天津 300191)
目的:观察唑来膦酸钠对高龄患者绝经后骨质疏松症的治疗效果。方法:选择80例高龄绝经后骨质疏松症患者随机分为两组,观察组和对照组各40例,两组均服用钙尔奇D片600 mg/次,1次/d;骨化三醇胶丸0.25 μg/次,1次/d。在此基础上观察组给予唑来膦酸钠注射液5 mg静脉滴注,1次/年;对照组口服阿仑膦酸钠70 mg/次,1/周,两组疗程均为12个月。观察两组患者治疗前后和两组间的疼痛视觉评分(VAS)、腰椎和髋部总骨密度(BMD)、血钙(Ca)、血磷(P)、血清抗酒石酸酸性磷酸酶(TRACP)、血清I型前胶原N端肽(PINP)、β胶原降解产物(β-Crosslaps)的差异。结果:治疗后两组VAS评分均较治疗前明显改善,有显著统计学差异(P<0.01);治疗后6个月时,观察组低于对照组,但无统计学差异(P>0.05),治疗后12个月时,有统计学差异(P<0.05)。治疗后两组各部位BMD均有明显或显著改善(P<0.05或P<0.01);观察组腰椎BMD治疗后12个月时优于对照组(P<0.05),髋部BMD比较无统计学差异(P>0.05)。与治疗前相比,两组PINP水平明显升高(P<0.05),TRACP、β-Crosslaps水平均显著降低(P<0.01);组间比较,治疗后6个月时观察组TRACP、β-Crosslaps水平较对照组有统计学差异(P<0.05),治疗后12个月时观察组PINP、TRACP、β-Crosslaps水平较对照组均有统计学差异(P<0.05)。观察组总不良反应率为32.5%,对照组放弃治疗5例,总不良反应发生率为30.0%,两组均无严重不良反应发生,不良反应发生率比较无统计学差异(P>0.05)。结论:唑来膦酸钠治疗高龄患者绝经后骨质疏松症效果确切,且安全性良好。
高龄,绝经后骨质疏松症,唑来膦酸钠,药物治疗,阿仑膦酸钠,钙尔奇D
骨质疏松症(OP)是一种以骨量低下,骨微结构损坏,导致骨脆性增加、易发生骨折为特征的全身性疾病[1]。随着人口老龄化的加剧,骨质疏松已成为老年人的常见病、多发病,预计至2050年全球65岁以上罹患OP人数将达15.55亿[2]。绝经后骨质疏松症(PMOP)是高转换型OP,在我国更为多见,危害也更大,严重影响高龄女性的晚年生活质量及预期寿命。唑来膦酸钠作为新的双膦酸盐类药物,已被美国FDA批准应用于PMOP的治疗,并已在我国逐步开始应用,但其对高龄PMOP患者应用效果的报道较少,本院尝试应用唑来膦酸钠治疗高龄PMOP 40例取得较好效果,现将结果报道如下。
1 资料与方法
1.1 一般资料 选取2013年5月—2014年6月本院门诊收治的POMP患者80例作为研究对象,年龄81~94岁,平均年龄(85.6±4.1)岁;绝经时间(28.9±7.8)年。入选标准:①所有患者均经双能X线BMD检查,BMD低于同性别骨峰值2.5个标准差以上为诊断标准;②所有患者均有POMP明显的骨痛症状且伴日常生活功能受限;③X线检查:腰椎均有明显的皮质变薄、骨小梁稀疏,纵向骨小梁不明显,椎体出现不同程度的压缩或休门氏结节。排除标准:①各种继发性骨质疏松症;②各种影响骨代谢的慢性疾病、内分泌疾病、先天性疾病以及类风湿性关节炎等免疫性疾病;③影响钙、磷吸收的严重肠道及肾脏疾病,血钙浓度<2.00 mmol/L;④严重肝肾功能损害,肌酐清除率<30.0 ml/min;⑤影响骨密度测量的严重脊柱侧弯、各种骨科手术后遗症等;⑥近3个月内曾服用过糖皮质激素类等影响骨代谢的药物;⑦对本研究治疗药物过敏者;⑧服药依从性差或精神异常者。利用随机数字表将80例患者随机分为两组各40例,两组患者性别、年龄、绝经时间、体重指数及BMD均值无统计学差异(P>0.05),资料具有可比性。
1.2 治疗方法 两组患者均服用钙尔奇D片600 mg/次,1次/d;骨化三醇胶丸0.25 μg/次,1次/d。在此基础上观察组给予唑来膦酸钠注射液(密固达)5 mg静脉滴注,1次/年,滴注时间不少于15 min。用药前予氯化钠注射液1000 ml静滴水化,并嘱患者多饮水以保护肾功能,用药后用氯化钠注射液100 ml冲管。对照组口服阿仑膦酸钠(福善美)70 mg/次,1次/周,早餐前0.5 h用250 ml温开水送服,服药后30 min内避免躺卧。两组疗程均为12个月。
1.3 观察指标 在治疗前后6个月和12个月时将所有研究对象的骨密度及相关血生化进行检查并记录。应用VAS评分进行疼痛评价;骨密度检查采用美国Lunar公司生产的双能X线(DEXA)骨密度检测仪,测量腰椎(L2-4)及髋部总BMD;生化指标检查测量血Ca、血P、TRACP、β-Crosslaps、PINP浓度;观察两组不良反应的发生情况。

2 结果
2.1 两组VAS评分比较 治疗后6个月和12个月时,与治疗前相比两组内VAS评分均有明显改善,有显著统计学差异(P<0.01);两组间VAS评分比较,治疗后6个月时,观察组低于对照组,但无统计学差异(P>0.05),治疗后12个月时,有统计学差异(P<0.05)。见表1。
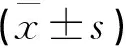
表1 两组治疗前后VAS评分比较
与治疗前比较,*P<0.01;与对照组比较,▲P<0.05
2.2 两组腰椎及髋部BMD比较 与治疗前比较,治疗后两组各部位BMD均有明显改善,治疗后6个月时有统计学差异(P<0.05),治疗后12个月时,有显著统计学差异(P<0.01)。两组间比较,观察组腰椎BMD改善优于对照组,治疗后12个月时,有统计学差异(P<0.05),髋部BMD比较无统计学差异(P>0.05)。见表2。
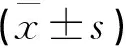
表2 两组腰椎及髋部BMD比较 g/cm2
与治疗前比较,*P<0.05,**P<0.01;与对照组比较,▲P<0.05
2.3 两组血生化指标比较 治疗后6个月和12个月时两组血Ca、血P浓度均较治疗前变化不大,无统计学差异(P>0.05),组间比较亦无统计学差异(P>0.05);与治疗前比较,治疗后两组PINP水平明显升高(P<0.05),TRACP、β-Crosslaps水平均显著降低(P<0.01);组间比较,治疗后6个月时观察组TRACP、β-Crosslaps水平较对照组有统计学差异(P<0.05),治疗后12个月时观察组PINP、TRACP、β-Crosslaps水平较对照组均有统计学差异(P<0.05)。见表3。

表3 两组血生化指标比较±s)
与治疗前比较,*P<0.05,**P<0.01;与对照组比较,▲P<0.05。
2.4 药物不良反应分析 观察组40例患者中,发热5例(12.5%),发热合并肌肉疼痛3例(7.5%),单纯肌痛3例(7.5%),感冒样症状2例(5%),总不良反应率为32.5%,但症状均较轻,使用解热镇痛药及补液等对症处理后症状消退,无其他严重肝肾功能损害、心脑血管意外等不良反应。对照组40例患者中,头晕2例(5%);胃肠不适7例(17.5%,其中3例反应严重,难以继续服药,终止治疗);转氨酶升高1例(2.5%),服药依从性差2例(5%,分别于治疗后3个月和5个月拒绝服药,终止治疗),未见其他严重不良反应发生,不良反应发生率为30.0%,对照组实际完成治疗患者35例。两组患者在随访期间均未发生骨质疏松引起的脆性骨折。两组间不良反应发生率比较无统计学差异(P>0.05)。
3 讨论
PMOP是指绝经后妇女由于卵巢功能减退,雌激素水平下降,导致骨吸收大于骨形成,出现以低骨量和骨组织显微结构退变为特征,引起骨脆性和骨折易感性增加的全身性疾病,是原发性OP的一种,是女性随年龄增长必然发生的退行性病变。其最主要的并发症是骨质疏松性骨折,从而导致患者卧床不起,易引发肺炎、心血管疾病等并发症,给老年妇女带来肉体和精神上的双重痛苦,给社会和家庭带来沉重的经济和生活负担[3]。绝经后妇女骨量的变化通常可分为3个时段:①快速丢失期:绝经10年内,女性在此时段骨量丢失占总丢失量的2/3,尤其以绝经后1-3年内丢失最快;②稳定期:绝经后10-20年间。③再丢失期:绝经20年后。本研究选取的研究对象绝经期在20年以上,在雌激素持续减少及年龄老化的双重作用下,导致骨量快速流失,丢失速率可达1.1%~1.4%/年,因此治疗高龄POMP的有效药物应能抑制骨吸收,减少骨丢失,增加骨密度,最终降低骨折发生率。
双膦酸盐类药物主要的作用机制是通过抑制破骨细胞法尼基焦磷酸(FPP)合成酶活性,诱导破骨细胞凋亡,抑制骨吸收,降低骨转换,使负钙平衡变为正钙平衡,从而提高骨密度,使骨矿含量增加。唑来膦酸钠是第三代异环型含氮双膦酸盐类药物,由于其具有独特的双氮原子结构,对破骨细胞可发挥细胞毒作用;并可诱导成骨细胞分泌抑制因子,阻断破骨细胞启动的破骨过程,抑制骨吸收;同时能够强力亲和磷酸钙,吸附于骨组织中羟基磷灰石结晶表面,抑制其结晶和非结晶前体物质形成,阻止骨骼中钙盐“逸出”[4],从而达到高效抑制骨吸收并提高骨矿化能力的作用。有研究证实,唑来膦酸钠的骨吸收抑制强度是阿仑膦酸钠的25~114倍[5]。
从本研究结果来看,应用唑来膦酸钠和阿仑膦酸钠后患者的VAS评分较治疗前明显下降,这与双膦酸盐抑制骨吸收、减少破骨细胞对骨的破坏作用有关。在治疗后12个月时观察组止痛效果更佳,说明唑来膦酸钠与骨矿盐结合能力更大,作用周期更长,活性成分能够非常缓慢地从骨骼组织释放人全身循环系统中[6],在治疗后12个月时仍能发挥强大的止痛作用。从BMD和骨转换指标结果来看,应用两种药物后患者腰椎、全髋BMD均较治疗前显著提高,腰椎BMD提高较为显著,治疗后12个月时观察组腰椎BMD提高更明显,这一结果与Black等[7]的研究结果一致。两组血钙、血磷浓度均较治疗前变化不大,说明在补钙的基础上应用唑来膦酸钠可有效降低其低血钙、低血磷的发生率;代表成骨细胞活性的标志物PINP水平明显升高,代表破骨细胞活性的标志物TRACP、β-Crosslaps水平均显著降低,并在治疗后6个月时观察组TRACP、β-Crosslaps水平较对照组更低,在治疗后12个月时观察组PINP较对照组更高,TRACP、β-Crosslaps水平较对照组更低,这一结果与国内学者相关研究[8]存在一定出入,但与Orwoll[9]的结果相一致,说明与阿仑膦酸钠相比,对于高龄POMP患者而言,唑来膦酸钠具有更好的抑制骨吸收的作用,可显著的抑制破骨细胞活性,减少骨吸收,降低骨转换,并可通过打破负钙平衡,在抑制骨吸收的同时起到一定的促进骨形成的作用,双向促进骨矿化,从而提高骨密度及骨强度,且其对骨转换的效应可达12个月。文献报道[10]大样本统计连续输注唑来膦酸钠3年后骨折风险降低70%,髋部骨折风险降低41%。本研究结果与国内同行结果不同,可能与本组研究对象年龄更大,骨转换率较低,以及合并骨关节疾病较多有关,此外也可能与患者并发其他慢性疾病需要同时服用许多其他药物,存在停用或漏服阿仑膦酸钠的现象有关。从不良发应发生情况来看,两组总不良反应发生率差别不大,唑来膦酸钠最主要的并发症是发热,Dieuonzo等[11]认为该反应可能是由于唑来膦酸钠抑制FPP合成酶后其上游香叶基焦磷酸(IPP)和二甲基丙烯焦磷酸酯(DMPP)堆积,由IPP及DMPP刺激的T细胞活化、增殖,释放TNF-a及IL-6所致。本研究观察组病例发热率为20%,经过解热镇痛及补液治疗均缓解且持续时间短,没有房颤、肾功能不全、颚骨坏死等严重不良反应的发生,有文献报道注射唑来膦酸钠后发热率可达到66.7%[4]。而阿仑膦酸钠由于严重的胃肠反应及服药方法烦琐等问题导致服药依从性差,本组有5例放弃治疗。有研究表明,口服双膦酸盐类药物治疗在1年后的患者依从性仅为18%~78%[12]。由此可见,对于高龄POMP患者应用每年1次静脉给药的唑来膦酸钠治疗效果更佳,并有更好的用药依从性。此外根据国内学者成本-效益分析的结果来看,每年1次静脉滴注唑来膦酸钠比口服双磷酸盐更适于预防骨质疏松性骨折的发生[13]。
综上所述,应用唑来膦酸钠注射液治疗高龄患者POMP临床效果确切,且安全性良好。
1 冯孟明, 史成龙, 谷鹏,等. 仙灵骨葆联合钙剂治疗高龄患者老年性骨质疏松症的临床研究[J]. 天津药学, 2014, 26(2): 44-46
2 Dennison E, Mohamed M A, Cooper C. Epidemiology of osteoporosis [J]. Rheum Dis Clin North Am, 2006, 32(4): 617-629
3 张亚军, 刘忠厚, 张鹏. 绝经后骨质疏松流行病学研究进展[J]. 中国骨质疏松杂志, 2010, 16(3): 229-234
4 杨毅, 李蓬秋, 鲜杨,等. 唑来膦酸治疗女性绝经后骨质疏松所致急性发热临床分析[J]. 中国骨质疏松杂志, 2013, 19(1): 58-60
5 许翎, 邓海鸥, 智喜梅,等. 唑来膦酸治疗老年性骨质疏松的临床观察[J]. 南方医科大学学报, 2012, 32(9): 1287-1289
6 Lewiecki E M. Intravenous zoledronic acid for the treatment ofosteoporosis[J]. Curt Osteoporos Rep, 2008, 6(1): 17-23
7 Black D M, Delmas P D, Eastell R,etal. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis[J]. N Engl J Med, 2007, 356(18): 1809-1822
8 娄振凯, 李春海, 叶伟,等. 注射用唑来膦酸治疗绝经后骨质疏松36例[J]. 中国新药与临床杂志, 2012, 31(5): 247-250
9 Orwoll E S, Miller P D, Adachi J D,etal. Efficacy and safety of a once-yearly i v Infusion of zoledronic acid 5 mg versus a once-weekly 70-mg oral alendronate in the treatment of male osteoporosis: a randomized, multicenter, double-blind, active controlled study[J]. J Bone Miner Res, 2010, 25(10): 2239-2250
10 Lyles K W,Colón-Emeric C S,Magaziner J S,etal. Zoledronic acid and clinical fractures and mortality after hip fracture[J]. N Engl J Med, 2007, 357(18): 1799-1809
11 Dieuonzo G, Vincenzi B, Santini D,etal. Fever after zoledronic acid administration is due to increase in TNF—alpha and IL-6[J]. J Interferon Cytokine Res, 2003, 23(11): 649-654
12 Penning-van Beest F J, Erkens J A, Olson M,etal. Loss of treatment benefit due to low compliance with bisphosphonate therapy[J]. Osteoporos Int, 2008, 19(4): 511-517
13 李国新, 袁忠治, 温健,等. 口服及静脉应用双磷酸盐治疗绝经后的骨质疏松临床研究[J]. 中国骨质疏松杂志, 2013, 19(9): 988-990
2015-10-16
R977.5
A
1006-5687(2016)01-0023-04
