粪产碱杆菌D-氨基酰化酶的分离纯化及发酵条件优化
2016-05-24倪孟祥
陶 金,倪孟祥
(中国药科大学生命科学与技术学院,江苏 南京 210009)
粪产碱杆菌D-氨基酰化酶的分离纯化及发酵条件优化
陶金,倪孟祥
(中国药科大学生命科学与技术学院,江苏 南京 210009)
摘要:采用热激法将含粪产碱杆菌D-氨基酰化酶基因载体的质粒导入大肠杆菌,筛选重组子,对该工程菌产生的D-氨基酰化酶用Ni2+柱进行分离纯化;通过单因素实验优化D-氨基酰化酶的发酵条件。结果表明,纯化后的D-氨基酰化酶比活力为456.71 U·mg-1,纯化回收率为50%,纯化倍数为12.4倍;最佳发酵条件为:37 ℃通气培养至菌体浓度OD600值为0.6时,加入0.5 mmol·L-1诱导剂IPTG诱导5 h,在此条件下,D-氨基酰化酶酶活力为90.9 U·mL-1。
关键词:D-氨基酰化酶;粪产碱杆菌;分离纯化;发酵条件;优化
随着科技的进步和分析方法的发展,人们相继在动物、植物和微生物中发现了多种D-氨基酸,这些D-氨基酸在各领域中有着极其重要的作用[1],如在医药领域被用来制备具有生物活性的多肽、半合成抗生素、酶抑制剂等药物;在农业领域被用来合成低毒高效、无公害且易被生物降解的杀虫剂;在食品添加剂领域被用作甜味剂合成的关键中间体[2-6]。D-氨基酸可通过D/L-氨基酸消旋体拆分、不对称化学合成法、发酵法、酶法合成[7]。其中酶法合成D-氨基酸以高效、快速、低成本、易于大规模生产等特点得到广泛应用[8]。研究发现,自然界中有多种酶可用于D-氨基酸的生产,如:N-酰基-D-氨基酸酰胺水解酶(D-氨基酰化酶)、N-氨甲酰-D-氨基酸水解酶、D-乙内酰脲酶、D-氨基酸酰胺酶、氨基酸氧化酶、蛋白酶、D-氨基酸氨基转移酶[1]。其中D-氨基酰化酶是一类专一性水解酶,它可以通过水解N-酰基-D-氨基酸得到高纯度的D-氨基酸,所以利用D-氨基酰化酶来生产D-氨基酸逐渐成为热点[9]。自从1952年科学家首次从土壤微生物中分离得到D-氨基酰化酶以来,目前已从粪产碱杆菌(Alcaligenes)、假单胞菌(Pseudomonas)、链霉菌(Streptomyces)、贪噬菌(Variovorax)、木霉菌(Trichoderma)和小细菌属(Micro-bacterium natoriense)等菌属中分离得到了D-氨基酰化酶[10]。作者在此将粪产碱杆菌D-氨基酰化酶基因导入大肠杆菌进行原核表达,再对该工程菌产生的D-氨基酰化酶进行分离纯化,并通过单因素实验对D-氨基酰化酶的发酵条件进行初步优化,拟为D-氨基酰化酶的大规模工业化生产奠定基础。
1实验
1.1菌种、试剂与仪器
菌种E.coliBL21(DE3),自行保存。含粪产碱杆菌D-氨基酰化酶基因的重组质粒pET22b由南京金斯瑞生物科技有限公司提供,宿主菌为Top10;氨苄西林(Amp)、异丙基-β-D-硫代半乳糖苷(IPTG)、质粒小量提取试剂盒,上海生工生物工程有限公司;其它试剂均为分析纯或色谱纯。
EPS-200型数显式稳压恒流电泳仪,上海天能科技有限公司;Allegra25R型高速冷冻离心机,美国Beckman公司;H1650-W型台式高速离心机,湘仪离心机仪器有限公司;电子分析天平,上海精密科学仪器有限公司;UV-1100型紫外可见分光光度计,上海美普达仪器有限公司;HA-300MIT型全自动高压蒸汽灭菌锅,日本HIRAYAMA公司;XO-650型超声波细胞破碎仪,南京先欧仪器制造有限公司;HL-2S型恒流泵,上海青浦沪西仪器厂。
1.2培养基
LB培养基(g·L-1):酵母浸粉5,蛋白胨10,氯化钠10,pH值7.0。
1.3方法
1.3.1D-氨基酰化酶表达载体的转化
将含有粪产碱杆菌D-氨基酰化酶基因的表达载体pET22b从宿主菌Top10中提取出来,并将表达载体热激转化到E.coliBL21(DE3)感受态细胞中,Amp抗性平板筛选,得到重组菌。
1.3.2D-氨基酰化酶的诱导表达
挑选平板上重组菌的单菌落,接种于1 mL含100 mg·L-1Amp的LB培养基中于37 ℃培养过夜(约10~12 h)。取上述1 mL菌液接入100 mL含100 mg·L-1Amp的LB培养基中于37 ℃、220 r·min-1振荡培养至OD600值约为0.6时,加入诱导剂IPTG至终浓度为1 mmol·L-1,于37 ℃、220 r·min-1振荡培养3 h后进行SDS-PAGE分析。
1.3.3D-氨基酰化酶可溶性分析
取诱导后菌液在4 ℃、4 000 r·min-1离心10 min,收集菌体沉淀称量湿重,按每克10 mL加入磷酸缓冲液,吹打混匀后于冰浴中超声破碎(破碎条件:输出功率300 W、破碎时间5 s、间隔时间5 s、次数200)。将悬浮液在4 ℃、10 000 r·min-1离心10 min,收集上清液与沉淀进行SDS-PAGE分析。
1.3.4D-氨基酰化酶的Ni2+柱纯化
超声破碎后的上清液用0.22 μm滤膜过滤后收集滤液,进行Ni2+柱层析。将管路系统中气泡完全排出,按照上柱注意事项将柱子连接至纯化系统中。用10 BV去离子水冲洗柱子,然后用10 BV的磷酸缓冲液平衡柱子,流速均为1 mL·min-1。取粗酶液上柱,流速减半。用10 BV的含低浓度咪唑的磷酸缓冲液洗柱子,洗去未挂柱的杂蛋白。用不同梯度的含高浓度咪唑的磷酸缓冲液梯度洗脱,收集洗脱液,备用。洗脱后,依次用10 BV的结合缓冲液、10 BV的去离子水洗柱子,再用5 BV的20%乙醇平衡柱子,于4 ℃保存。将不同梯度的洗脱液进行SDS-PAGE分析,将含有目的蛋白的洗脱液超滤脱盐得到纯酶。
1.3.5蛋白含量的测定
以牛血清白蛋白(BSA)标准液绘制标准曲线,用紫外分光光度法测定蛋白含量[11]。
1.3.6D-氨基酰化酶酶活力测定
分别取D-蛋氨酸母液0.0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL于试管中,用去离子水补足至1 mL,各加入1 mL醋酸钠-醋酸缓冲液和1 mL茚三酮溶液,充分混匀后于沸水浴中放置15 min,自来水冷却后静置5 min,再加入3 mL 60%乙醇稀释,摇匀后测定A570值并绘制标准曲线。
取粗酶液200 μL于1.5 mL EP管中,依次加入700 μL Tris-HCl溶液、100 μLN-乙酰-D-蛋氨酸溶液,使酶液稀释5倍,终体积为1 mL;取纯化后酶液25 μL于1.5 mL EP管中,加入875 μL Tris-HCl溶液、100 μLN-乙酰-D-蛋氨酸溶液,将酶液稀释40倍,终体积为1 mL;对照为1 mL Tris-HCl溶液。将上述溶液于37 ℃水浴中反应30 min,室温下于12 000 r·min-1离心5 min。取1 mL反应液于试管中,加入1 mL醋酸钠-醋酸缓冲液和1 mL茚三酮溶液,充分混匀后于沸水浴中放置15 min,自来水冷却,静置5 min。再加入3 mL 60%乙醇稀释,摇匀后测定A570值。
酶活定义:在上述条件下,1 min 内生成1 μmol D-蛋氨酸所需酶量定义为一个酶活单位(U)。
1.3.7发酵条件优化
通过单因素实验考察IPTG浓度、诱导时机、诱导时间对酶活力的影响,以优化D-氨基酰化酶的发酵条件[12]。
2结果与讨论
2.1D-氨基酰化酶的诱导表达
D-氨基酰化酶的分子量为55 kDa,His标签的分子量为3 kDa,所以表达的蛋白分子量约为58 kDa。重组菌经诱导后,用10%的SDS-PAGE进行检测,结果如图1所示。
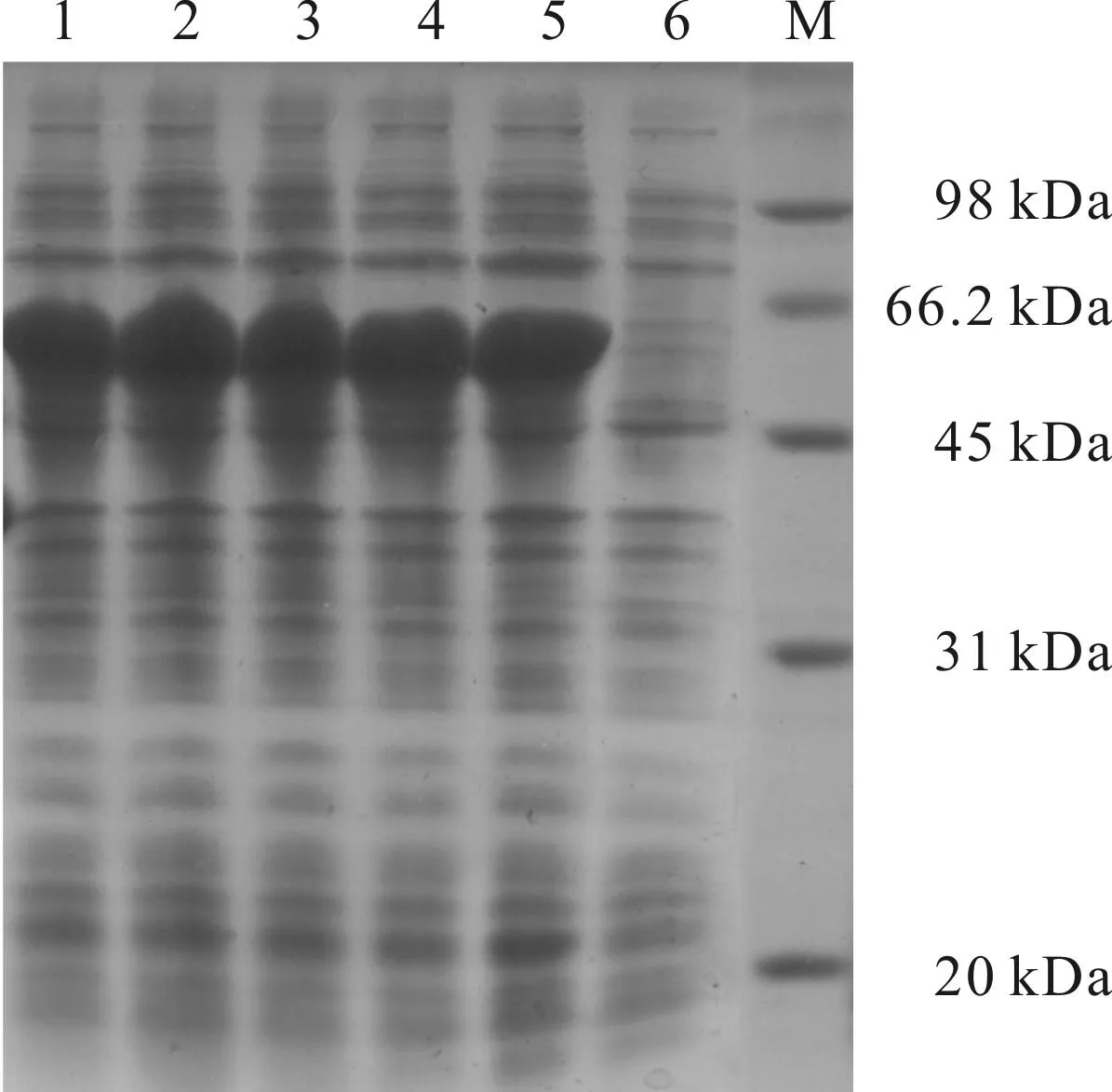
M.蛋白质标记 1~5.IPTG诱导3 h的pET22b 6.pET22b
从图1可以看出,重组菌经过IPTG 3 h的诱导后,在约58 kDa处出现明显蛋白表达条带,而未经IPTG诱导的则没有蛋白表达条带。
2.2D-氨基酰化酶的可溶性分析
将IPTG诱导后的重组菌破胞,离心后分别收集上清液和沉淀进行SDS-PAGE分析,结果如图2所示。
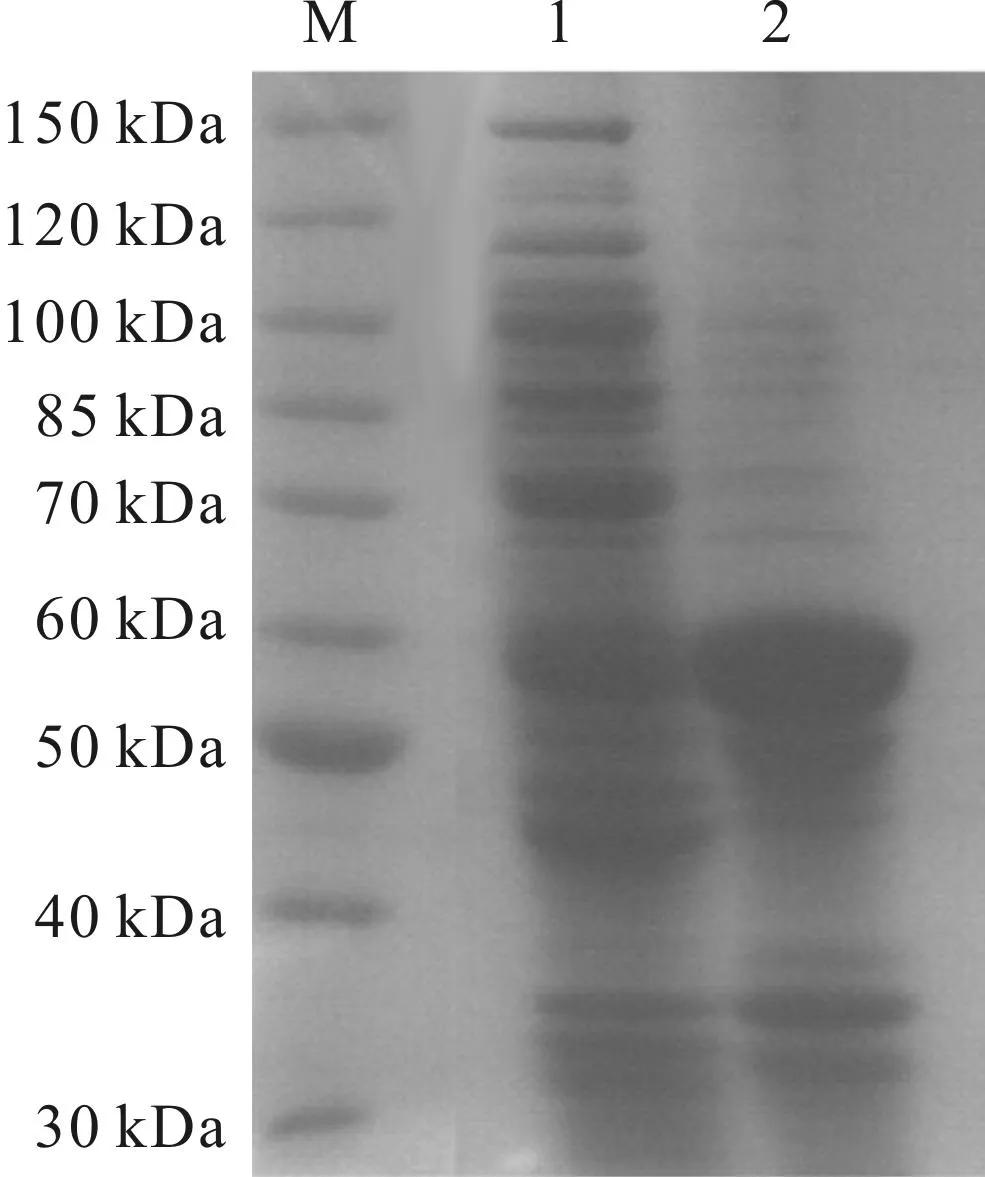
M.蛋白质标记 1.上清液 2.沉淀
从图2可以看出,上清液中的蛋白含量比沉淀中的蛋白含量少,因此D-氨基酰化酶的可溶性不高。
2.3D-氨基酰化酶的Ni2+柱纯化
IPTG诱导表达的D-氨基酰化酶基因的pET22b载体上有His标签,可用Ni2+柱纯化。将1 L粗酶液经Ni2+柱纯化,再用不同浓度的咪唑溶液洗脱,结果发现,用100 mmol·L-1咪唑溶液洗脱可以得到较高纯度的目的蛋白,如图3所示。D-氨基酰化酶的纯化结果见表1。

M.蛋白质标记 1~2.PBS缓冲液洗脱液 3~4.50 mmol·L-1
表1
D-氨基酰化酶的纯化结果
Tab.1

Purification results of D-aminoacylase
从表1可知,1 L发酵液经Ni2+柱纯化后,可获得纯化目的蛋白15.81 mg,以N-乙酰-D-蛋氨酸为底物,在37 ℃测得的总活力为7 220.9 U,比活力为456.71 U·mg-1,是纯化前的12.4倍。
2.4重组菌发酵条件优化
2.4.1IPTG浓度对酶活力的影响(图4)
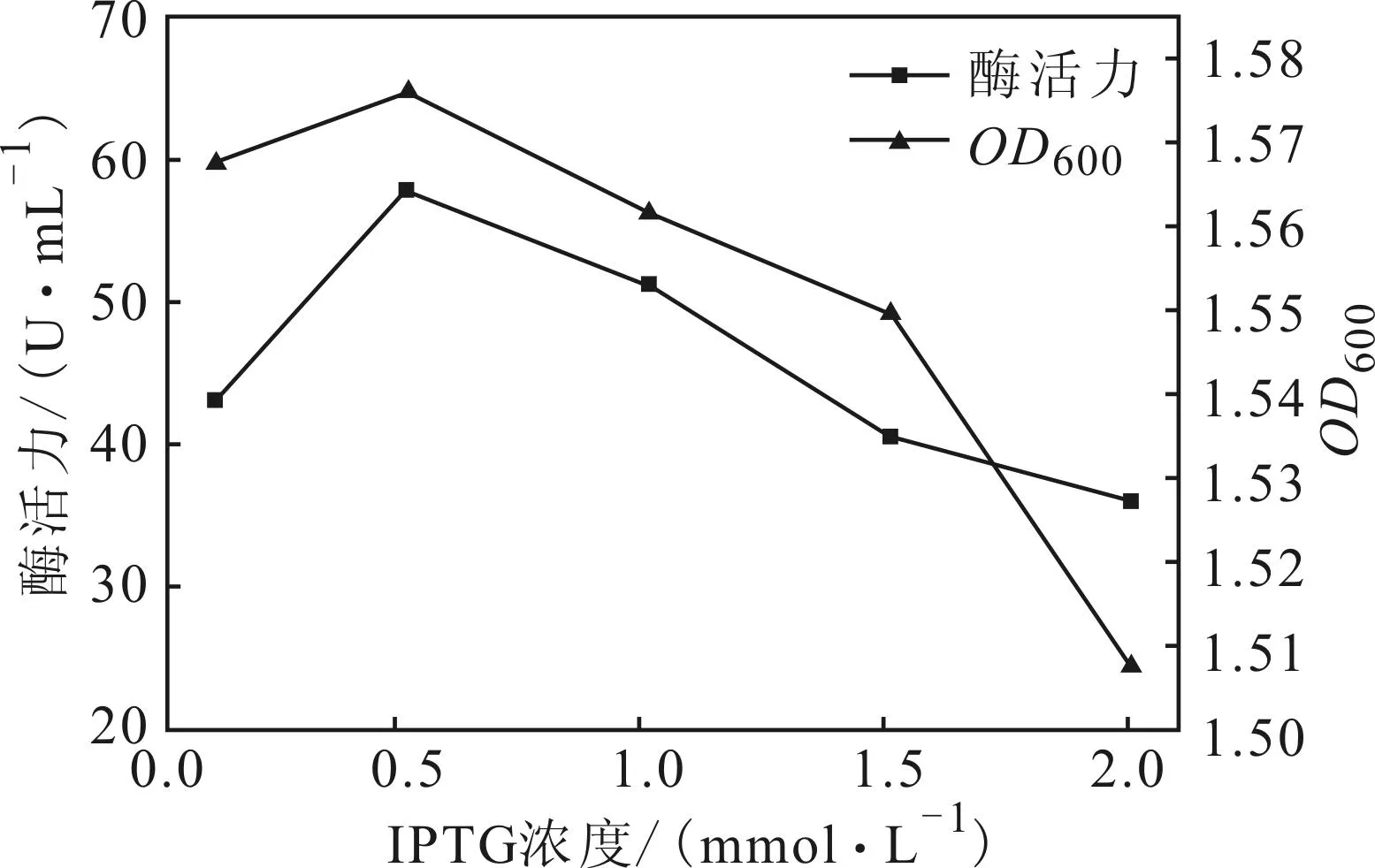
图4 IPTG浓度对酶活力的影响
由图4可以看出,0.1 mmol·L-1的IPTG诱导时菌体浓度和酶活力都较小;随着IPTG浓度的增大,菌体浓度和酶活力均逐渐增大;当IPTG浓度为0.5 mmol·L-1时,菌体浓度和酶活力都达到最大;但由于IPTG本身对E.coli细胞具有毒性,随着IPTG浓度的进一步增大,菌体浓度和酶活力均减小。因此,最佳IPTG浓度为0.5 mmol·L-1。
2.4.2诱导时机对酶活力的影响(图5)
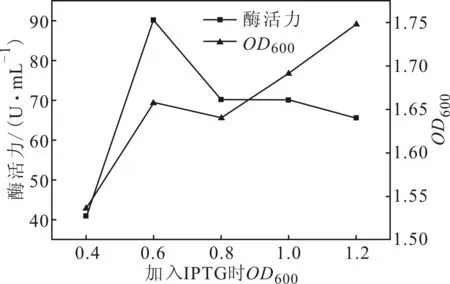
图5 诱导时机对酶活力的影响
由图5可以看出,当菌体浓度OD600值达到0.6时加入IPTG,此时表达的D-氨基酰化酶的酶活力最大,为90.1 U·mL-1;IPTG加入过早会使菌体生长不完全,蛋白表达不充分;IPTG加入过晚会使菌体过度生长,培养基养分不足以供应蛋白的表达。因此,最佳诱导时机为菌体浓度OD600值达到0.6时加入IPTG。
2.4.3诱导时间对酶活力的影响(图6)
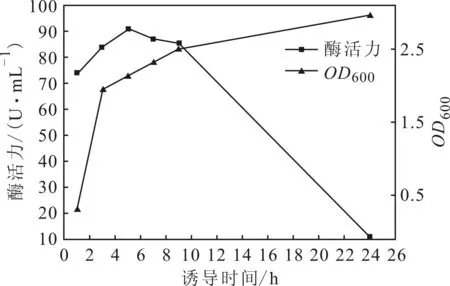
图6 诱导时间对酶活力的影响
由图6可以看出,当IPTG诱导1~5 h时,菌体浓度和酶活力都逐渐增大;诱导5~24 h时,菌体浓度仍逐渐增大,酶活力却逐渐减小。这是由于,诱导时间延长,后期菌体大量死亡,导致酶活力减小;在IPTG诱导5 h时表达的D-氨基酰化酶的酶活力最大,为90.9 U·mL-1。因此,最佳诱导时间为5 h。
3结论
将粪产碱杆菌的D-氨基酰化酶基因插入到pET22b表达载体上,以E.coliBL21(DE3)为宿主菌,IPTG诱导表达D-氨基酰化酶。D-氨基酰化酶的可溶性不高,经Ni2+柱纯化后的比活力为456.71 U·mg-1,是粗酶的12.4倍。重组菌的最佳发酵条件为:37 ℃通气培养至菌体浓度OD600值为0.6时,加入0.5 mmol·L-1诱导剂IPTG诱导5 h,在此条件下,D-氨基酰化酶的酶活力为90.9 U·mL-1。该研究为今后D-氨基酰化酶的大规模工业化生产奠定了基础。
参考文献:
[1]WAKAYAMA M,YOSHIMUNE K,HIROSE Y,et al.Production of D-amino acids byN-acyl-D-amino acid amidohydrolase and its structure and function[J].Journal of Molecular Catalysis B:Enzymatic,2003,23(2-6):71-85.
[2]SHINADA T,ISHIDA T,HAYASHI K,et al.Synthesis of leucine-enkephalin analogs containing α-amino squaric acid[J].Tetrahedron Letters,2007,48(43):7614-7617.
[3]YOKO N,MASATOSHI H,YUTAKA I,et al.The presence of high concentrations of free D-amino acids in human saliva[J].Life Sciences,2006,78(15):1677-1681.
[4]CIACCIO C,TUNDO G R,GRASSO G,et al.Somatostatin:A novel substrate and a modulator of insulin-degrading enzyme activity[J].Journal of Molecular Biology,2009,385(5):1556-1567.
[5]MIYOSHI Y,KOGA R,OYAMA T,et al.HPLC Analysis of naturally occurring free D-amino acids in mammals[J].Journal of Pharmaceutical & Biomedical Analysis,2012,69(8):42-49.
[6]CAVA F,LAM H,de PEDRO M A,et al.Emerging knowledge of regulatory roles of D-amino acids in bacteria[J].Cellular & Molecular Life Sciences,2011,68(5):817-831.
[7]韦萍.D-氨基酸的制备研究[D].南京:南京工业大学,2002.
[8]于平.生物转化和手性拆分技术制备D-氨基酸研究进展[J].生物学通报,2005,40(9):3-5.
[9]郑文宾,郑仁朝,郑裕国.D-氨基酰化酶的研究进展[J].基因组学与应用生物学,2014,33(3):704-708.
[10]LIU J,ASANO Y,ILOMA K,et al.Purification,characterization,and primary structure of a novelN-acyl-D-amino acid am-idohydrolase fromMicrobacteriumnatorienseTNJL143-2[J].Journal of Bioscience & Bioengineering,2012,114(4):391-397.
[11]SWARTZ J R.Advances inEscherichiacoliproduction of therapeutic proteins[J].Current Opinion in Biotechnology,2001,12(2):195-201.
[12]侯欣彤.来源于AlcaligenesA-6的D-氨基酰化酶基因工程菌的构建与酶学性质的研究[D].长春:吉林大学,2014.
Isolation,Purification and Fermentation Conditions Optimization ofAlcaligenesFaecalisD-Aminoacylase
TAO Jin,NI Meng-xiang
(SchoolofLifeScienceandTechnology,ChinaPharmaceuticalUniversity,Nanjing210009,China)
Abstract:Heat shock method was applied to transform recombinant plasmid containing Alcaligenes faecalis D-aminoacylase gene into Escherichia coli,and then the recombinants were screened.D-Aminoacylase from the engineering bacteria was isolated and purified by Ni-NTA affinity chromatography.The fermentation conditions of D-aminoacylase were optimized by a single factor experiment.The results showed that D-aminoacylase was purified up to 12.4 times with a recovery rate of 50%,and its specific activity was 456.71 U·mg-1.The optimum fermentation conditions were as follows:after aerobic cultured at 37 ℃ to OD600value of 0.6,induced 5 h with addition of 0.5 mmol·L-1IPTG.Under above conditions,D-aminoacylase activity was 90.9 U·mL-1.
Keywords:D-aminoacylase;Alcaligenes faecalis;isolation and purification;fermentation condition;optimization
中图分类号:TQ 920Q 55
文献标识码:A
文章编号:1672-5425(2016)04-0055-04
doi:10.3969/j.issn.1672-5425.2016.04.014
作者简介:陶金(1989-),男,辽宁抚顺人,硕士研究生,研究方向:微生物与生化药学,E-mail:taojincpu@126.com;通讯作者:倪孟祥,副教授,E-mail:nimx_2000@aliyun.com。
收稿日期:2015-12-30
