信号肽对Bacillus subtilis表达环糊精葡萄糖基转移酶的影响
2016-05-23李江华堵国成江南大学工业生物技术教育部重点实验室江苏无锡214122江南大学生物工程学院江苏无锡214122
毛 婷, 李江华*, 刘 龙, 堵国成, 陈 坚(1.江南大学,工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学生物工程学院,江苏无锡214122)
信号肽对Bacillus subtilis表达环糊精葡萄糖基转移酶的影响
毛婷1,2,李江华*1,2,刘龙1,2,堵国成1,2,陈坚1,2
(1.江南大学,工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学生物工程学院,江苏无锡214122)
摘要:将来源于作者所在实验室构建保存E.coli pET-20b(+)/CGT△E-CBMAmy的CGT△ECBMAmy基因插入6种含有不同信号肽(estA、bpr、vpr、yncM、yvgO和ywbN)的穿梭质粒pMA0911-SPs中,构建了6种重组表达载体并将其转入表达宿主B. subtilis WB600中,获得了6株重组菌。在相同的发酵条件下,estA信号肽介导的分泌效果最好,L-抗坏血酸2-葡萄苷产量达到0.81 g/L,明显高于其他5株重组菌。选取WBpMB/CGT△E-CBMAmy作为出发菌株,进行了摇瓶发酵条件优化,实现了CGT△E-CBMAmy酶的高效表达,最终使AA-2G产量提高了2.16倍,VC转化率达到21.9%。
关键词:环糊精葡萄糖基转移酶;信号肽;枯草芽孢杆菌;异源表达
环糊精葡萄糖基转移酶(简称CGT)属于转移酶家族(EC 2.2.1.19),是一种能够通过转糖基反应转化淀粉及相关基质合成环糊精的胞外酶[1]。它主要催化3种转糖基反应(歧化反应、环化反应和偶合反应)和水解反应[2],CGT酶通过歧化反应,先将淀粉或环糊精转化为单糖、双糖或低聚糖,然后将这些糖分子作为供体转移到各种受体分子上,从而改善受体分子的性质[3],成为近几年研究的热点。
L-抗坏血酸(VC)是一种人体必需但无法自身合成的水溶性维生素,稳定性差,在光照、金属离子作用及水溶液中很容易氧化[4]。CGT通过歧化作用可使VC与低聚糖反应合成葡萄糖基-L-抗坏血酸,其产物稳定性明显提高[3],而L-抗坏血酸2-葡萄苷(AA-2G)就是一种VC的糖基衍生物,在医疗保健和健康方面具有巨大的应用潜力。与其他的VC糖基衍生物相比,AA-2G具有以下几个优点:1)AA-2G具有很高的耐热性和抗氧化性,因此稳定性和安全性最佳[5];2)AA-2G易于被人体吸收,吸收后降解也非常容易,降解后释放的VC能发挥其生理作用;3)生物酶法转化是目前报道合成AA-2G的惟一方法[3],该方法操作简便,污染少,易于控制。
淀粉水解酶具有用于结合淀粉颗粒的非催化区域,称为碳水化合物物结合域(CBM),该区域通常能够特异性结合多糖[6]。本研究E.coli pET-20b (+)/CGT△E-CBMAmy[7]是将来自于碱性Alkalimonas amylolytica淀粉酶的CBM与来自于P. macerans CGTase融合,构建了嵌合酶基因CGT△E-CBMAmy,以提高可溶性淀粉作为底物时的底物特异性,以此来为糖基供体生产AA-2G。该方法使嵌合酶失去了CGT酶的环化活力,但歧化活力有所提高(本研究以AA-2G产量的高低表征歧化活力的高低)。
能分泌CGT酶的微生物种类很多,但目前工业生产中所用的生产菌株一般为芽孢杆菌[8]。枯草芽孢杆菌是公认的符合食品安全标准的宿主,具有优秀的蛋白质分泌能力,含有丰富的信号肽序列且无明显的密码子偏好性,其作为异源蛋白的表达宿主具有明显优势[9]。为提高异源蛋白的表达,除了选用合适的启动子及表达载体外,选用匹配度高的信号肽也是一种非常有效的手段[10]。不同的信号肽对不同的异源蛋白的分泌表达有着一定的影响,成成等[11]将CGT插入含有pelB信号肽质粒中并在大肠中表达,李斌等[1]将pelB信号肽换成OmpA信号肽,CGT酶的表达量明显提高。Ismael等[12]利用天冬酰胺酶信号肽提高CGT表达,酶活提高了1.7倍。Ong等[13]利用Bacillus sp.的G1信号肽提高CGT表达,酶活提高了62.3%。
我们选取枯草作为表达宿主,将来源于E.coli pET-20b(+)/CGT△E-CBMAmy的CGT△E-CBMAmy基因插入含有6种不同信号肽的pMA0911-SPs系列载体中并在B. subtilis WB600表达,得到了一株AA-2G合成能力高的重组菌,并将其为出发菌株,考察了初始pH、温度、碳源、氮源、金属离子对CGT△E-CBMAmy表达的影响。最终使AA-2G产量达到1.75 g/L,VC转化率达到21.9%。
1 材料与方法
1.1菌株与质粒
E.coli pET-20b(+)/CGT△E-CBMAmy,克隆宿主菌E. coli JM109,表达宿主菌B. subtilis WB600,表达质粒pMA0911-SPs(含有不同信号肽的pMA0911衍生质粒):均为作者所在实验室保藏;克隆质粒pMD18-T-simple:TaKaRa(大连)生物工程有限公司;WBpMB/CGT△E -CBMAmy、WBpMCCGT△E -CBMAmy、WBpMG/CGT△E -CBMAmy、WBpMJ/CGT△E -CBMAmy、WBpML/CGT△E -CBMAmy及WBpMM/ CGT△E-CBMAmy:均为作者所在实验室构建。
1.2试剂、酶、Marker及相关试剂盒
限制性内切酶EcoRI、BamHI,PCR用酶PrimerStar Taq、Ex Taq、SolutionI,感受态制备试剂盒、质粒提取试剂盒、片段回收和胶回收试剂盒:TaKaRa(大连)生物工程有限公司;氨苄青霉素、卡那霉素等试剂:上海生工生物工程有限公司;酵母粉和胰蛋白胨:Oxoid公司;麦芽糊精:山东西王食品有限公司;VC:中国医药集团上海化学试剂公司;AA-2G标准品:和光纯药工业株式会社(日本);标准相对分子质量蛋白质、缓冲液:碧云天生物技术研究所;其它各种试剂:国产分析纯;引物合成和测序:由生工生物工程(上海)股份有限公司完成。
1.3培养基
1.3.1种子培养基LB培养基。
1.3.2发酵培养基LB+1 g/dL葡萄糖,TB培养基,TSB培养基。培养基配制参照文献[20]。
1.4 CGTΔE-CBMAmy酶基因的克隆
以E.coli pET-20b(+)/CGT△E-CBMAmy为模板,利用引物P1/P2对目标基因进行扩增。PCR反应条件为:95℃3 min;98℃30 s;56℃30 s;72℃2 min,30个循环;72℃延伸5 min。PCR引物如下:P1:CGGAATTCTCACCCGATACGAGCGTGGACA,P2:CGGGATCCTTAAAAACCGCCATTGAAGGAC。P1/P2分别含EcoRI和BamHI的限制性酶切位点。将扩增得到的不含信号肽的CGT△E-CBMAmy基因片段与pMD18-T-simple连接并转入宿主E. coli JM109。通过菌落PCR验证筛选阳性菌株,挑选阳性菌株在含有100 μg/mL氨苄青霉素的LB培养基中37℃培养过夜,提取质粒进行酶切验证及测序鉴定。
1.5表达载体的构建与转化
将测序正确的质粒pMD18-T-simple/CGT△ECBMAmy经EcoRI和BamHI双酶切后回收目的片段,与以同样的方法获得含有不同信号肽的E.coli-B.subtilis穿梭载体pMA0911-SPs采用Solution I连接酶连接。将重组载体采用化学转化法[14]转入B. subtilis WB600中,在含有50 μg/mL卡那霉素平板上筛选获得阳性克隆,菌落PCR并酶切验证。
1.6分析方法
1.6.1 DNA琼脂糖凝胶电泳按文献[14]方法进行。
1.6.2 AA-2G合成反应条件酶液1 mL,25 g/L麦芽糊精0.5 mL,25 g/L VC 0.5 mL,28℃,pH 6.5,200 r/min避光避氧24 h[15]。
1.6.3 AA-2G检测高效液相色谱法[16]。色谱柱:Amethyst C18-H(5 μm,4.6 mm×250 mm);检测器:Variable Wavelength Detector(UV);柱温:25℃;检测波长:238 nm;进样量:10 μL;流动相:KH2PO4(0.025 mol/L)∶甲醇=99.5∶0.5,用磷酸调pH至2.0。
1.7培养方法
1.7.1种子培养条件挑取WBpMB/CGT△ECBMAmy接入含有50 μg/mL Kan的LB培养基中,在37℃、200 r/min的摇床上培养12 h。
1.7.2发酵条件按4%接种体积分数接种至TB发酵培养基中,36 h后离心收集上清液。
2 结果与讨论
2.1重组菌的构建与表达
参照1.4及1.5步骤,构建得到了分别携带重组载体pMB/CGT△E -CBMAmy、pMC/CGT△E -CBMAmy、pMG/CGT△E -CBMAmy、pMJ/CGT△E -CBMAmy、pML/CGT△E-CBMAmy、pMM/CGT△E-CBMAmy的重组菌WBpMB/CGT△E -CBMAmy、WBpMC/ CGT△E -CBMAmy、WBpMG/CGT△E -CBMAmy、WBpMJ/ CGT△E-CBMAmy、WBpML/CGT△E-CBMAmy、WBpMM/ CGT△E-CBMAmy。分别取提质粒,用EcoRI和BamHI双酶切重组质粒得到20 kb的目的基因CGT△ECBMAmy片段与71 kb的目的基因pMA0911-SPs片段,与预期结果一致,表明重组菌构建成功,见图1 (a)。将6株重组菌按1.7步骤的发酵条件发酵,并用12 g/dL SDS-PAGE对重组菌WBpMB/CGT△ECBMAmy发酵上清液检测,发现与CGT△E-CBMAmy酶相对分子质量相对应的74 000处有条带,阴性对照中没有相应条带。证明CGT△E -CBMAmy在B. subtilis WB600中成功表达。按1.6步骤测AA-2G产量,结果见图1(b)。可见重组菌WBpMB/CGT△ECBMAmy中CGT△E-CBMAmy酶的表达效果最佳,因此我们选取重组菌WBpMB/CGT△E-CBMAmy进行发酵条件优化。
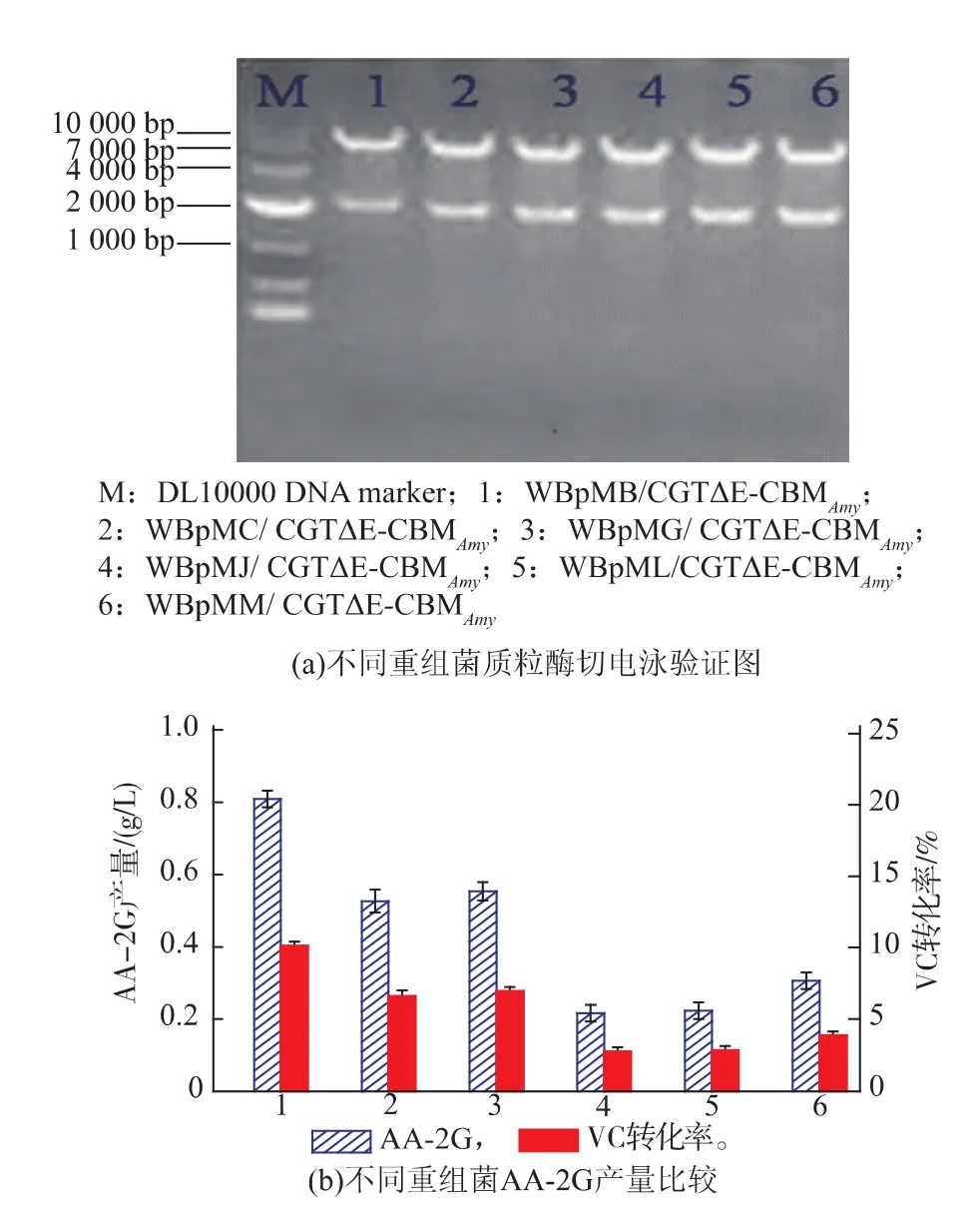
图1 不同重组菌质粒酶切验证及AA-2G产量比较Fig. 1 Restriction enzyme analysis of recombinants plasmid and comparion of AA-2G production
2.2重组菌WBpMB/CGTΔE-CBMAmy发酵条件优化
2.2.1不同初始培养基对CGT△E-CBMAmy表达的影响为了获得适合重组枯菌的初始培养基,选取了4种枯草芽孢杆菌常用培养基(TSB、LB、LB+1 g/dL葡萄糖、TB)进行重组菌发酵。结果见图2(a)所示,TB培养基作为发酵培养基时,AA-2G产量达到0.9 g/L,表明在所选的4种培养基中,TB最有利于CGT△E-CBMAmy酶的表达。
2.2.2不同温度对CGT△E-CBMAmy表达的影响温度对菌体的生长和产酶都有着重要的影响,作者考察了4种不同的温度条件对CGT△E-CBMAmy表达的影响。从图2(b)中可以看出,随着发酵温度的升高,CGT△E-CBMAmy表达量增高,AA-2G产量增高。37℃时,AA-2G的产量最高,但温度达到42℃后,AA-2G产量下降,原因可能为温度过高,菌体生产合成速率过快,质粒的稳定性降低,限制了酶的表达。
2.2.3初始pH对CGT△E-CBMAmy表达的影响pH对于菌体的发酵产酶有重要的作用,pH过高或过低都会抑制菌体的生长和产酶。作者选择初始pH值依次为5、6、7、8、9的TB培养基培养重组菌,考察了初始pH对CGT△E-CBMAmy表达的影响。从图2(c)中可以看出,初始pH 7时,AA-2G产量最高。
2.2.4种龄对CGT△E-CBMAmy表达的影响种龄对菌体发酵合成产物的影响很大,当菌体处于对数生长期时活力最强,会很快适应新的环境,并进入生物合成期。作者选择了处于不同种龄的菌体进行发酵,从图2(d)中可以看出,种龄为7 h的种子液最有利于CGT△E-CBMAmy的表达,AA-2G产量也明显高于其余4组。
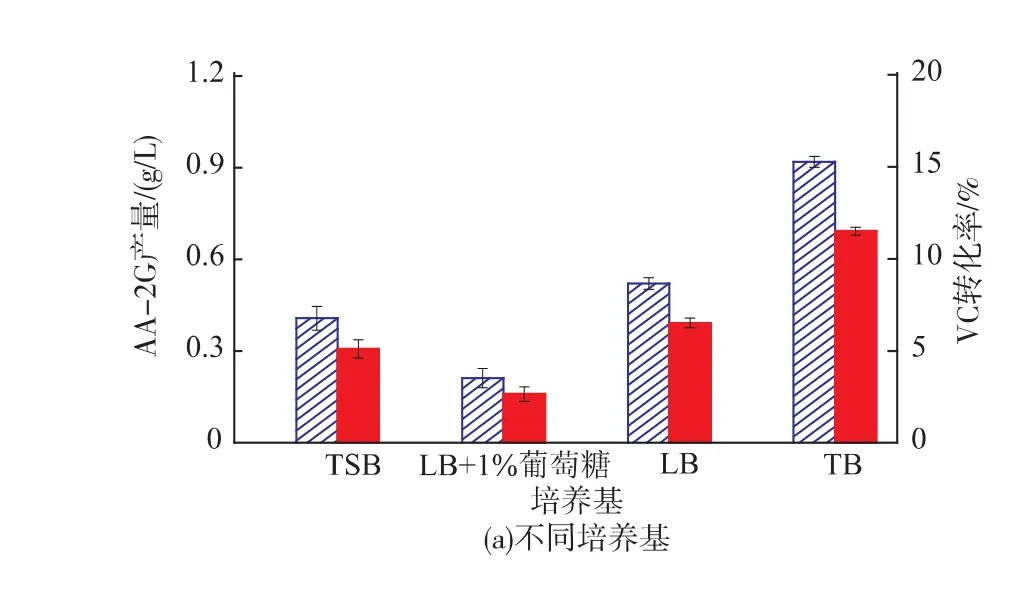
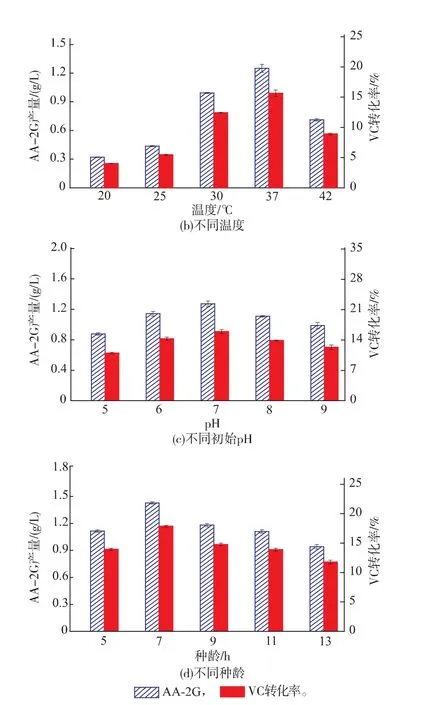
图2 重组菌发酵条件对AA-2G产量的影响Fig. 2 Comparison of AA-2G production during process optimization
2.2.5不同碳源对CGT△E-CBMAmy表达的影响以TB为初始培养基,按照碳质量分数相等原则,选择了葡萄糖、蔗糖、麦芽糖、玉米淀粉、可溶性淀粉、甘油6种碳源,研究了不同碳源对CGT△E-CBMAmy表达的影响,结果见图3(a)。当以葡萄糖和甘油为碳源时,CGT△E-CBMAmy表达量高,AA-2G产量分别达到1.41 g和1.43 g左右。但葡萄糖成本较低,因此选择葡萄糖作为碳源并对其添加浓度进行了优化,结果见图3(b)。当葡萄糖质量浓度为5 g/L时,AA-2G产量达到1.52 g,可见此质量浓度更有利于CGT△E-CBMAmy表达。随着葡萄糖质量浓度的升高反而抑制了CGT△E-CBMAmy的表达,AA-2G产量降低。
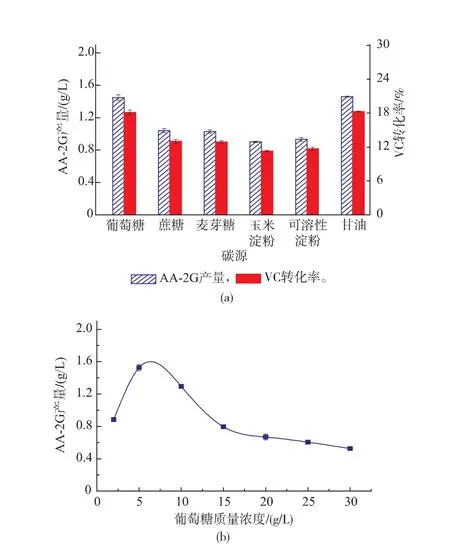
图3 不同碳源及葡萄糖质量浓度对AA-2G产量的影响Fig. 3 Effect of difficult carbon source and glucose concentration on AA-2G production
2.2.6不同氮源对CGT△E-CBMAmy表达的影响氮源种类对菌体生长和产酶都会产生很大影响。根据氮质量分数相等的原则,选取9种不同氮源(鱼粉、牛肉浸膏、大豆蛋白胨、尿素、玉米浆、酪蛋白、硫酸铵、氯化铵、胰蛋白胨)代替原有培养基中的氮源蛋白胨,酵母粉质量浓度不变(24 g/L),考察了不同氮源对CGT△E-CBMAmy表达的影响。结果见图4 (a)所示,可以看出以牛肉浸膏为氮源时,AA-2G产量最高,达到1.75 g/L。培养基中碳/氮比对菌体的代谢也会产生很大的影响,因此进一步对牛肉浸膏的浓度进行了优化,确定最优质量浓度后又对酵母粉质量浓度进行优化。从图4(b)中可以看出当牛肉浸膏质量浓度为10 g/L,酵母粉质量浓度为25 g/L条件下,AA-2G产量可达到1.62 g/L。
2.2.7金属离子及浓度对CGT△E-CBMAmy表达的影响金属离子也是CGT酶生产的关键因素,Gawande等[17]和Jing-Bong等[18]发现在CGT酶生产中必须添加镁离子;Rosso等人[19]发现铁离子是提高B. circulans DF 9Rβ-CGT酶产量的最有效金属离子,镁离子则对细胞生长起到促进作用。在培养基中分别添加Fe3+、Ca2+、Zn2+、Cu2+、Mg2+、Fe2+、Mn2+,考察了它们对CGT△E-CBMAmy表达的影响。从图5(a)中可以看出,添加Zn2+和Mg2+时,AA-2G产量可以达到1.75 g/L,可见添加Zn2+和Mg2+有利于产酶。随后考察了不同Zn2+质量浓度和不同Mg2+质量浓度对产酶的影响,从图5(b)中看出Zn2+质量浓度为0.1 g/L,Mg2+质量浓度为0.6 g/L时有利于产酶。

图4 不同氮源及氮源质量浓度对AA-2G产量的影响Fig. 4 Effect of difficult nitrogen source and nitrogen concentrations on AA-2G production
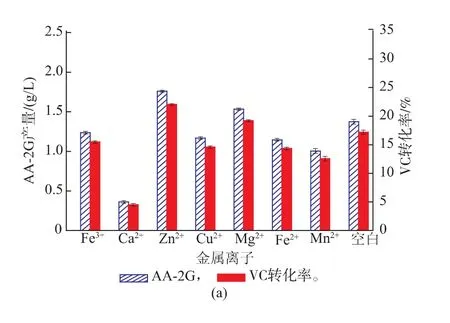
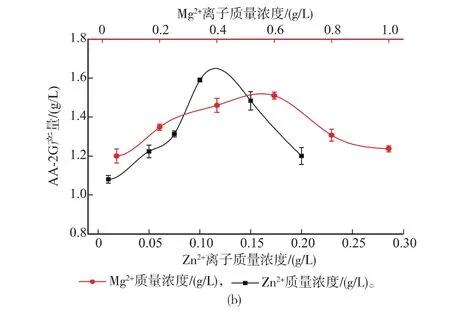
图5 不同金属离子(a)及金属离子质量浓度(b)对AA-2G产量的影响Fig. 5 Effect of difficult metal ions source and metal ions concentration on AA-2G production
3 结语
将CGT△E-CBMAmy酶基因克隆到含有6种不同信号肽的穿梭质粒pMA0911-SPs上,构建得到了能胞外生产CGT△E-CBMAmy的6种重组菌。其中estA信号肽最有利于CGT△E-CBMAmy胞外表达,携带estA信号肽的重组菌WBpMB/CGT△E-CBMAmy的AA-2G产量达到0.81 g/L,通过对培养基及发酵条件的研究,获得了重组菌WBpMB/CGT△ECBMAmy的最佳发酵条件:葡萄糖5 g/L,酵母粉10 g/ L,牛肉浸膏25 g/L,氯化锌0.1 g/L,硫酸镁0.6 g/L,K2HPO472 mmol/L,KH2PO4 17 mmol/L,初始pH为7.0,培养温度为37℃。在该条件下AA-2G产量达到1.75 g/L,与优化前相比提高了1.16倍,使VC转化率达到21.9%。
参考文献:
[ 1 ] Li Z F,Li B,Gu Z B,et al. Extracellular expression and biochemical characterization of α-cyclodextrin glycosyltransferase from Paenibacillus macerans[J]. Carbohyd Res,2010,345(7):886-892.
[ 2 ] Van der Veen B A,Van Alebeek G J,Uitdehaag J C,et al. The three transglycosylation reactions catalyzed by cyclodextrin glycosyltransferase from Bacillus circulans(strain 251)proceed via different kinetic mechanisms[J]. Eur J Biochem,2000,267 (3):658-665.
[ 3 ] Zheng M Y,Endo T,Zimmermann W. Synthesis of large-ring cyclodextrins by cyclodextrin glucanotransferases from bacterial isolates[J]. J Incl Phenom Macro,2002,44:387-390.
[ 4 ]王冰,邱建华,张雪洪,等.维生素C葡萄糖苷的研究现状及发展前景[J].生物加工过程,2008,6(4):1-5. WANG Bing,QIU Jianhua,ZHANG Xuehong,et al. Status and development of the VC derivates [J]. Chinese Journal of Bioprocess Engineering,2008,6(4):1-5.(in Chinese)
[ 5 ] Yamasaki H,Nishi K,Miyake T. Process for producing high 2-O-α-D-glucopyranosyl-L-ascorbic acid:US,6576446 [P]. 2003-05-10.
[ 6 ] Christiansen C,Abou Hachem M,Janecek Š,et al. The carbohydrate-binding module family 20-diversity,structure,and function [J]. FEBS Jorunal,2009,276(18):5006-5029.
[ 7 ] Han R Z,Li J H,Shin H D,et al. Carbohydrate-binding module-cyclodextrin glycosyltransferase fusion enables efficient synthesis of 2-O-d-glucopyranosyl-l-ascorbic acid with soluble starch as the glycosyl donor [J]. Appl Environ Microb,2013,79(10):3234-3240.
[ 8 ]李兆丰.软化类芽孢杆菌α-环糊精葡萄糖基转移酶在大肠杆菌中的表达及其产物特异性分析[D].无锡:江南大学,2009.
[ 9 ] Lindia W,Helga W,Wim J Q. Bacillus subtilis as cell factory for pharmaceutical proteins:a biotechnological approach to optimize the host organism[J]. Biochim Biophys Acta,2004,1694(1-3):299-310.
[10] Zhou J W,Liu H,Du G C,et al. Production of α-cyclodextrin glycosyltransferase in Bacillus megaterium MS941 by systematic codon usage optimization[J]. J Agr Food Chem,2012,60(41):10285-10292.
[11]成成,李兆丰,李彬,等.利用重组大肠杆菌生产α-环糊精葡萄糖基转移酶[J].生物加工过程,2009,7(3):57-62. CHENG Cheng,LI Zhaofeng,LI bin,et al. Production of α-cyclodextrin glycosyltransferase in recombinant Escherichia coli[J]. Chinese Journal of Bioprocess Engineering,2009,7(3):57-62.(in Chinese)
[12] Ismail N F,Hamdan S,Mahadi N M,et al. A mutant L-asparaginase II signal peptide improves the secretion of recombinant cyclodextrin glucanotransferase and the viability of Escherichia coli[J]. Biotechnol Lett,2011,33(5):999-1005.
[13] Ong R,Goh K,Mahadi N,et al. Cloning,extracellular expression and characterization of a predominant β-CGTase from Bacillus sp. G1 in E. coli[J]. J Ind Microbiol Biot,2008,35(12):1705-1714.
[14] Spizizen J. Transformation of biochemically deficientstrain of B. subtilis by deoxyribonucleate [J]. Proc Natl Acad Sci USA,1958,44(10):1072-1078.
[15]韩瑞枝.环糊精葡萄糖基转移酶的分子改造及其生物转化合成糖基化维生素C的应用研究[D].无锡:江南大学,2013.
[16]张子臣.酶法转化合成2-氧-α-D-吡喃葡萄糖基抗坏血酸[D].无锡:江南大学,2010.
[17] Gawande BN,Singh RK,Chauhan AK,et al. Optimization of cyclomaltodextrin glucanotransferase production from Bacillus firmus[J]. Enzyme Microb Tech,1998,22(4):288-291.
[18] Jin-Bong H,Kim SH,Lee TK,et al. Production of maltodextrin from Bacillus stearothermophilus [J]. Korean J Appl Biotechnol,1990,18:578-584.
[19] Rosso A M,Ferrarotti S A,Krymkiewicz N,et al. Optimisation of batch culture conditions for cyclodextrin glucanotransferase production from Bacillus circulans DF 9R[J]. Microb Cell Fact,2002,1(1):3.
Effects of Signal Peptides on Extracellular Expression of Cyclodextrin Glycosyltransferase in Bacillus subtilis
MAO Ting1,2,LI Jianghua*1,2,LIU Long1,2,DU Guocheng1,2,CHEN Jian1,2
(1. Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2. School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Abstract:CGT△E-CBMAmygene from E. coli pET-20b(+)/CGT△E-CBMAmywas cloned and inserted into the expression plasmid pMA0911-SPs containing six different signal peptides(estA,bpr,vpr,yncM,yvgO and ywbN),which were further transformed into B. subtilis WB600 for overexpression to obtain six recombinant strains. The results showed that estA was the optimal signal peptide among all the signal peptides under the same culture conditions,the yields of AA-2G was up to 0.81 g/L,obvious higher than that of the other five strains. Therefore,WBpMB/CGT△E-CBMAmywas chosen as the starting strain and the optimum conditions for extracellular expression of CGT△E-CBMAmywere investigated in shaking flask. Finally,the high expression of CGT△E-CBMAmyenzyme was achieved,and the yields of AA-2G was about 2.16 times higher than that before optimization and the conversion rate of VC reached 21.9%.
Keywords:cyclodextringlucosetransferase,signalpeptide,Bacillus subtilis,heterologousexpression
*通信作者:李江华(1966—),男,江西九江人,工学博士,教授,博士研究生导师,主要从事酶工程与生物催化方面的研究。E-mail:lijianghua@jiangnan.edu.cn
基金项目:江苏省科技支撑计划项目(BE2011624)。
收稿日期:2014-08-22
中图分类号:Q 555
文献标志码:A
文章编号:1673—1689(2016)02—0173—07
