酶解条斑紫菜制备抗氧化肽及综合利用
2016-05-23刘冬冬田亚平江南大学工业生物技术教育部重点实验室江苏无锡214122
刘冬冬, 田亚平(江南大学工业生物技术教育部重点实验室,江苏无锡214122)
酶解条斑紫菜制备抗氧化肽及综合利用
刘冬冬,田亚平*
(江南大学工业生物技术教育部重点实验室,江苏无锡214122)
摘要:将酶解反应与几种膜分离技术集成构建一种制备紫菜抗氧化肽,并同时分级分离其它活性物质以实现综合利用。先后采用截留相对分子质量10 000的超滤膜和500的纳滤膜对紫菜酶解液进行分离纯化,优化操作参数,抗氧化肽回收率达73.1%,多糖回收率达55%,膳食纤维回收率达85%,多肽得率达18%;考察该工艺所得紫菜抗氧化多肽的应用特性,结果表明:纳滤浓缩后多肽液0.5 mg/mL对DPPH自由基清除率可达68.5%,该多肽最适作用pH为8.5,经80℃处理6 h后的紫菜抗氧化肽仍保留83%左右的相对DPPH自由基清除率。
关键词:紫菜;抗氧化肽;膜分离技术;综合利用
多肽是一类由氨基酸构成且有蛋白质特性但又不同于蛋白质的中间物质。具有调节机体生理功能和为机体提供营养的双重功效,影响着机体的一切代谢合成。具有抗氧化性质的多肽类物质称为抗氧化活性肽。植物抗氧化活性肽能够消除自由基,抑制或消除以及减缓氧化反应,在食品保鲜、化妆品、医药等领域有着广泛的应用前景[1]。
紫菜干品含粗蛋白质25%~40%,且必需氨基酸含量高,而目前紫菜的利用大多仍停留在简单出口和粗加工层面,没有很好地开发利用。鉴于紫菜中蛋白质含量较高,可以用作生产多肽的原料[2]。寻找技术合理、经济可行的方法分离纯化酶解后的多肽是实现活性肽工业化生产的关键,作为现代高新分离技术—膜分离技术可用于蛋白水解产物的分离、多肽及氨基酸混合物的分离与脱盐等。
酶解—膜分离是集酶促水解、废液循环利用、产物连续分离纯化等多步工序于一体,实现连续操作的有效模式,目前,已在实验室规模上建立了酶—微滤膜(超滤膜、反渗透膜等)反应器,并将其应用于提取酶解产物的功能性成分[3]。我国在这方面也开展了一些研究工作,如采用超滤技术分离大豆肽[4]、超滤与离子交换技术分离紫菜ACEⅠ抑制肽[5],曾庆祝等进行了酶解和反应器的偶联组合进行了扇贝酶解技术研究[6],结果表明该模型大大提高了蛋白质转化率。作者采用酶解—膜分离技术从紫菜酶解产物中分离纯化抗氧化多肽,并对工艺流程中产生的副产物如紫菜多糖以及膳食纤维进行分离提取,以实现紫菜最大程度的综合利用。
1 材料与方法
1.1材料与试剂
条斑紫菜:南通千鹤食品有限公司;1,1-二苯基-2-三硝基苯肼(DPPH):Sigma公司;中性蛋白酶:苏柯汉生物工程科技有限公司;枯草芽孢杆菌Zj016氨肽酶:作者所在实验室保存;其余为国产分析纯。
1.2主要仪器
722型紫外可见分光光度计:上海尤尼柯仪器有限公司;高速冷冻离心机Himac CR22G:HITACHI集团;HH-4型恒温水浴锅:江苏省金坛市荣华仪器制造有限公司;旋转蒸发仪:郑州市亚荣仪器有限公司;高速冷冻离心机、真空冷冻干燥机:日本日立公司;2 L超滤设备:上海弗立特实业有限公司;氨基酸分析液相色谱仪:美国Agilent公司;HP1100型高效液相色谱仪:美国Aglient公司。
1.3测定方法
1.3.1肽含量测定按照双缩脲法-考马斯亮蓝法测定。
1.3.2蛋白质转化率的测定蛋白转化率X(%)以酶解液中蛋白质质量占紫菜粗蛋白质量百分比为计算方法。蛋白质转化率越大,酶解越充分。
1.3.3多肽得率的测定多肽得率Y(%)以最终冷冻干燥得到的多肽粉的质量与紫菜干粉的质量百分比为计算方法。
1.3.4 DPPH自由基清除率测定
DPPH自由基清除率(%)= A0-(As-Ac)/A0
式中,A0为2.0 mL蒸馏水+2.0 mL DPPH溶液的吸光度值;As为2.0 mL样品溶液+2.0 mL DPPH溶液的吸光度值;Ac为2.0 mL样品溶液+2.0 mL无水乙醇的吸光度值。
在517 nm处测定吸光值,重复3次,求得清除率的平均值。
1.3.5多糖质量分数测定多糖质量分数(%)= 0.9×(总糖质量分数-还原糖质量分数),其中,0.9为换算因子[7]。总糖用苯酚硫酸法测定,还原糖用3,5-二硝基水杨酸法测定。
1.3.6超氧阴自由基(O2-·)清除能力测定采用邻苯三酚自氧法。取1.5 mL含有1 mmol/L EDTA的50 mmol/L的Tris-HCl缓冲液(pH 8.3)和0.5 mL样品溶液加入比色管中混匀,加入1 mL用10 mmol/L盐酸溶解的3 mmol/L邻苯三酚,迅速混匀,在420 nm处每隔30秒测一次吸光度,3 min后结束,以时间对吸光度做回归方程,其斜率即为超氧自由基生成的速度,记为△A/(min·s)。以水代替样品溶液做对照△A/(min·c)。以1.5 mL水加入1.5 mL的Tris-HCl缓冲液做空白调零。
酶解液样品清除超氧阴自由基的能力用清除率(%)表示,公式为(△A/(min·s)-△A/(min·c))/(△A/(min·s))。
1.3.7羟自由基(·OH)清除能力测定采用邻氮二菲法。取0.5 mL样品加入1 mL 0.15 mol/L磷酸盐缓冲液(pH 7.4),接着加入0.5 mL用缓冲液溶解的1.8 mmol/L邻二氮菲溶液和0.5 mL 1.8 mmol/L FeSO4水溶液,迅速混匀,最后加入0.5 mL 0.02%的H2O2,在37℃下水浴60 min,于536 nm下测其吸光值(As)。用水代替样品作为对照(Ac)。用水代替样品和H2O2作为空白(Ab)。以1.5 mL磷酸盐缓冲液加入1.5 mL的水调零。
酶解液样品清除羟自由基能力用清除率(%)= (As-Ac)/(Ab-Ac)
1.4试验方法
1.4.1紫菜抗氧化肽膜分离工艺紫菜干品→粉碎机(60目筛网)粉碎→烘干→酶解→离心→超滤→纳滤→冷冻干燥,具体过程见图1。
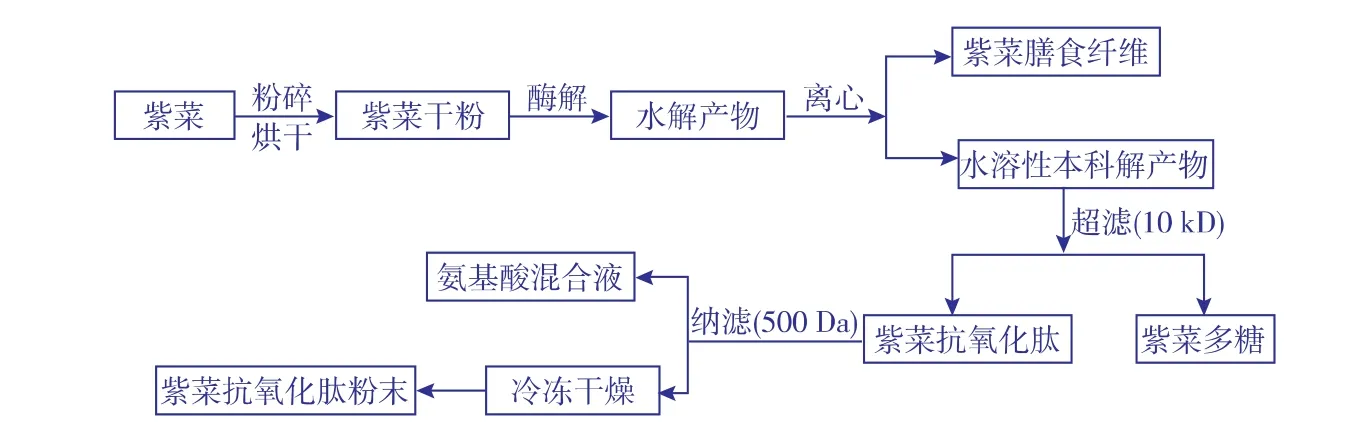
图1 酶解紫菜制备抗氧化肽综合利用工艺图Fig. 1 Comprehensive utilization of antioxidative peptide from enzymatic hydrolyzed laver
1.4.2紫菜多糖的分析测定酶解后经超滤截留的溶液中含有大部分的紫菜多糖,含量按照1.3.5的测定方法测定,其体外抗氧化性能按照1.3.6和1.3.7的测定方法测定。
1.4.3膳食纤维的分析测定根据AOAC 991.43-1994的分析方法,样品经高温淀粉酶、蛋白酶、葡萄糖苷酶进行酶解消化以去除蛋白质、淀粉,酶解后样液经乙醇沉淀、过滤,残渣用乙醇和丙酮冲洗后干燥称质量,得出总膳食纤维(TDF)质量分数,需要通过测定蛋白质和灰分质量分数进行校正。其中,蛋白质和灰分质量分数均用国标法进行测量。不溶性膳食纤维(IDF)和可溶性膳食纤维(SDF)的测定是将样品酶解后直接过滤,残渣经干燥后称质量,得到IDF;滤液用4倍体积95%的乙醇沉淀,然后依次过滤、干燥、称质量,即得到SDF。同样,IDF和SDF的质量分数需要通过测定蛋白质和灰分质量分数进行校正。
1.4.4抗氧化型护肤霜的初探按照下列配方配制普通型护肤霜:A相:十八醇(4%)角鲨烷(5%)GTCC(3%)Brij72(1.5%)Brij721(2%);B相:甘油(4%)1%的卡波940(20%)透明质酸(1%)。在油相A和水相B加热溶解后,将A相加入到B相中,同时用玻璃棒同一方向搅拌防止凝固,直到搅拌成均质状态,最后加两地香精和三乙醇胺调节pH为中性,即制成水包油型护肤霜。将紫菜抗氧化肽按照不同浓度加入到到B相体系中,如上相同操作即制得抗氧化性护肤霜。
溶解护肤霜的缓冲液体系为乙醇∶三氯甲烷=1∶1,称取0.5 g护肤霜充分溶于5 mL缓冲液中,然后5 000 r/min离心5 min,取上清液按照标准条件测定其DPPH清除率,与不加紫菜抗氧化肽的样品进行比较。
2 结果与讨论
2.1紫菜抗氧化肽膜分离
该工艺得到的紫菜抗氧化肽主要为小分子肽,相对分子质量1 000以下小肽占94%,最终肽质量浓度为5.78 mg/mL,回收率达62%,得率达18%,0.5 mg/mL多肽液的DPPH自由基清除率为68.5%。
超滤截留液中的紫菜多糖经HPLC测定其相对分子质量范围为13 300~69 000。对其进行体外抗氧化性能,结果表明,相同质量浓度下的紫菜多糖对超氧自由基的清除率略大于羟自由基,随着质量浓度的增加,紫菜多糖对各自由基的清除率也随之增加。1.0 mg/mL的紫菜多糖羟自由基和超氧自由基清除率分别达到20.62%和42%。
本工艺经过酶解后的紫菜残渣中仍含有大量的膳食纤维,其中总膳食纤维质量分数为36.6%,可溶性膳食纤维为23.5%,总回收率达到85%。
2.2加热预处理对紫菜蛋白转化率的影响
以酶解后紫菜蛋白转化率为指标,分析加热预处理对紫菜蛋白转化率的影响。对紫菜蛋白进行加热预处理可以使蛋白质紧密的结构松散开来,有利于暴露出蛋白酶结合位点,更利于酶解。将紫菜溶液在85℃下加热15 min,冷却至室温后开始酶解过程,同时与未经预处理的紫菜溶液进行比较,结果见表1。
结果表明,经过加热预处理的紫菜蛋白的转化率明显高于未处理的紫菜蛋白转化率,前者是后者的1.17倍。加热预处理提高了紫菜蛋白转化率,因此在酶解前进行加热预处理是可行的。
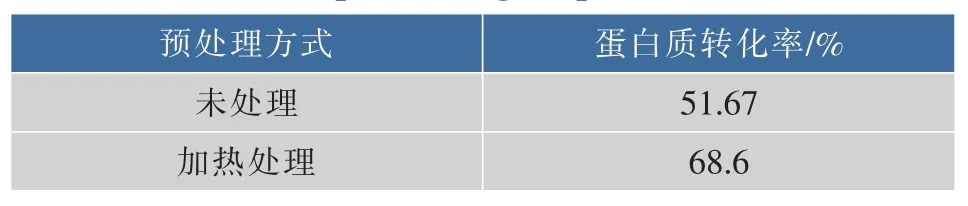
表1 加热预处理对蛋白转化率的影响Table 1 Effect of pretreating on protein conversion rate
2.3不同因素对超滤的影响
以超滤速度、多肽回收率、DPPH自由基清除率为指标,确定适宜的样液稀释倍数、超滤浓缩倍数、pH、压力等因素。
2.3.1稀释倍数对超滤的影响紫菜酶解液中含一定量的紫菜多糖,导致样液粘度很大,若不进行稀释直接超滤,超滤速度会由于浓差极化现象越来越慢,而且含有多糖的紫菜酶解液可能会吸附在超滤膜上,增加膜清洗的难度,影响膜的二次使用。因此将紫菜酶解液进行稀释处理,稀释1.2、1.6、2、2.4倍进行实验,结果见图2。
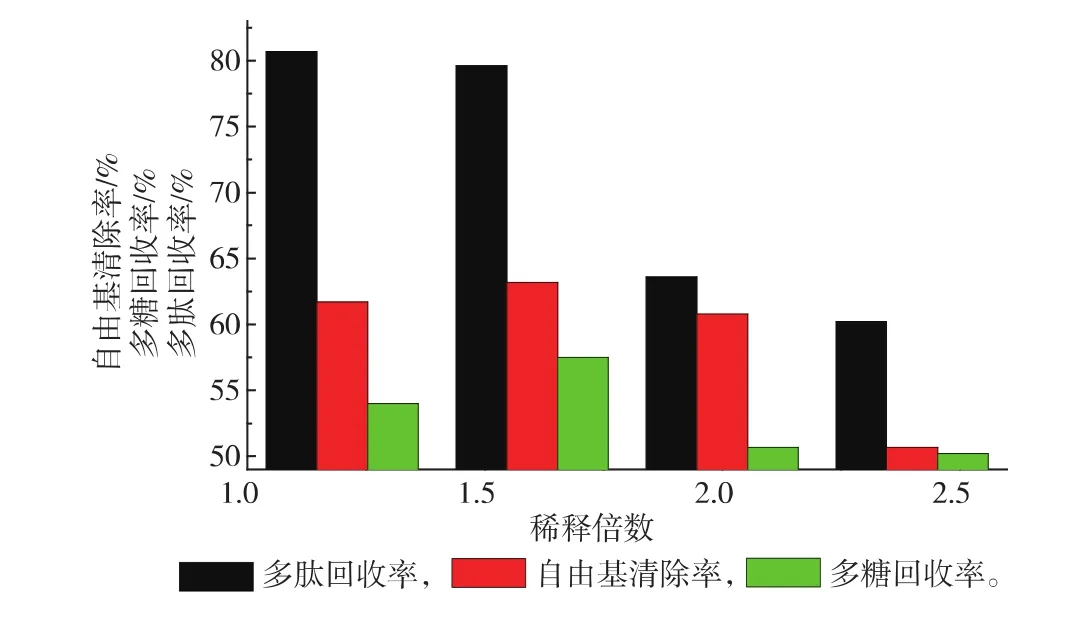
图2 稀释倍数对多肽回收率等因素的影响Fig. 2 Effect of UF dilution multiple on peptide recovery rate
样液稀释倍数越大,超滤速度越快,但同时多肽的损失也越大,考虑到多肽回收率以及DPPH自由基清除率,选择将样液稀释1.6倍再进行超滤操作。
2.3.2浓缩倍数对超滤的影响超滤是分离样液中不同相对分子质量组分的过程。因此按照相对分子质量划分有超滤透过液和超滤截留液,自定义超滤浓缩倍数=V原液/V超滤截留液。倍数小会导致分离不彻底,倍数大会造成资源浪费。因此选择合适的浓缩倍数很重要,选择3、4、5、6四组超滤浓缩倍数进行实验,以超滤速度、多肽回收率、DPPH自由基清除率为指标选择最佳的浓缩倍数。
由图3可以看出,浓缩5倍的实验组不仅多肽回收率最高,而且超滤透过液对DPPH自由基清除率也较高,并且多糖回收率也最高,因此超滤浓缩倍数选择5倍。
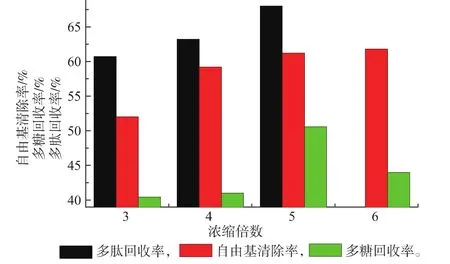
图3 浓缩倍数对多肽回收率等因素的影响Fig. 3 Effect of concentration multiple on peptide recovery rate
2.3.3 pH对超滤的影响pH值不仅影响料液的DPPH自由基清除能力,而且也会在超滤过程中由于电荷不同于超滤膜影响着超滤速度,从超滤速度、多肽回收率、超滤透过液的DPPH清除率3个方面考察pH的影响。
由图4看出,在相同条件下,pH 8.5的紫菜抗氧化肽的自由基清除率明显高于其他pH,这是因为该紫菜抗氧化肽的最适作用pH为偏碱性。
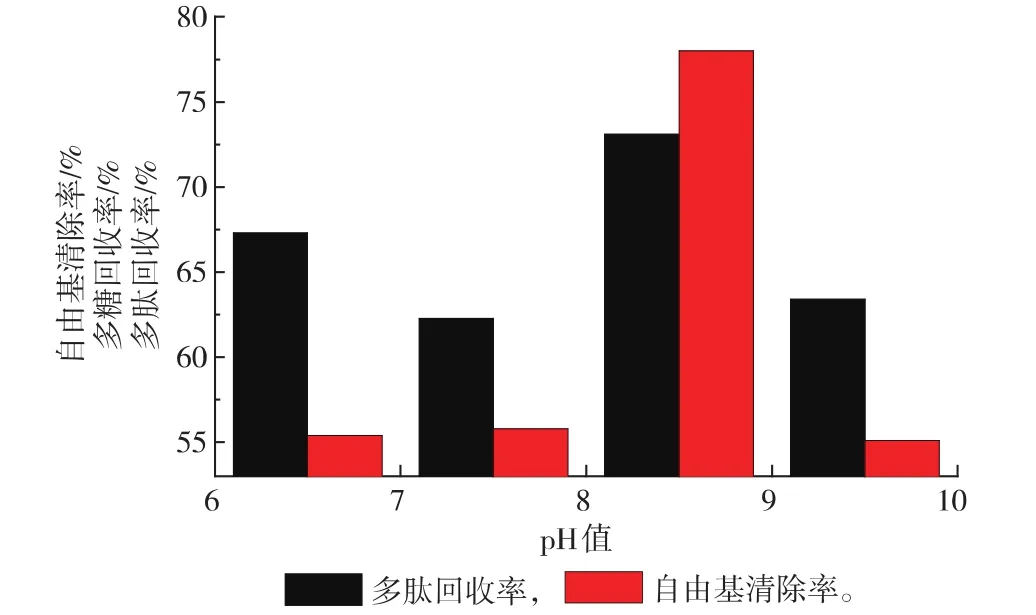
图4 pH值对多肽回收率等因素的影响Fig. 4 Effect of pH on peptide recovery rate
2.4不同因素对纳滤的影响
以纳滤速度、多肽回收率以及纳滤截留液的DPPH自由基清除率为指标,确定最佳的纳滤膜分子量、纳滤倍数以及pH。
2.4.1膜相对分子质量对纳滤的影响采用液相色谱柱TSKgel 2000 SWxl对超滤透过液的相对分子质量进行了分析,结果见图5。
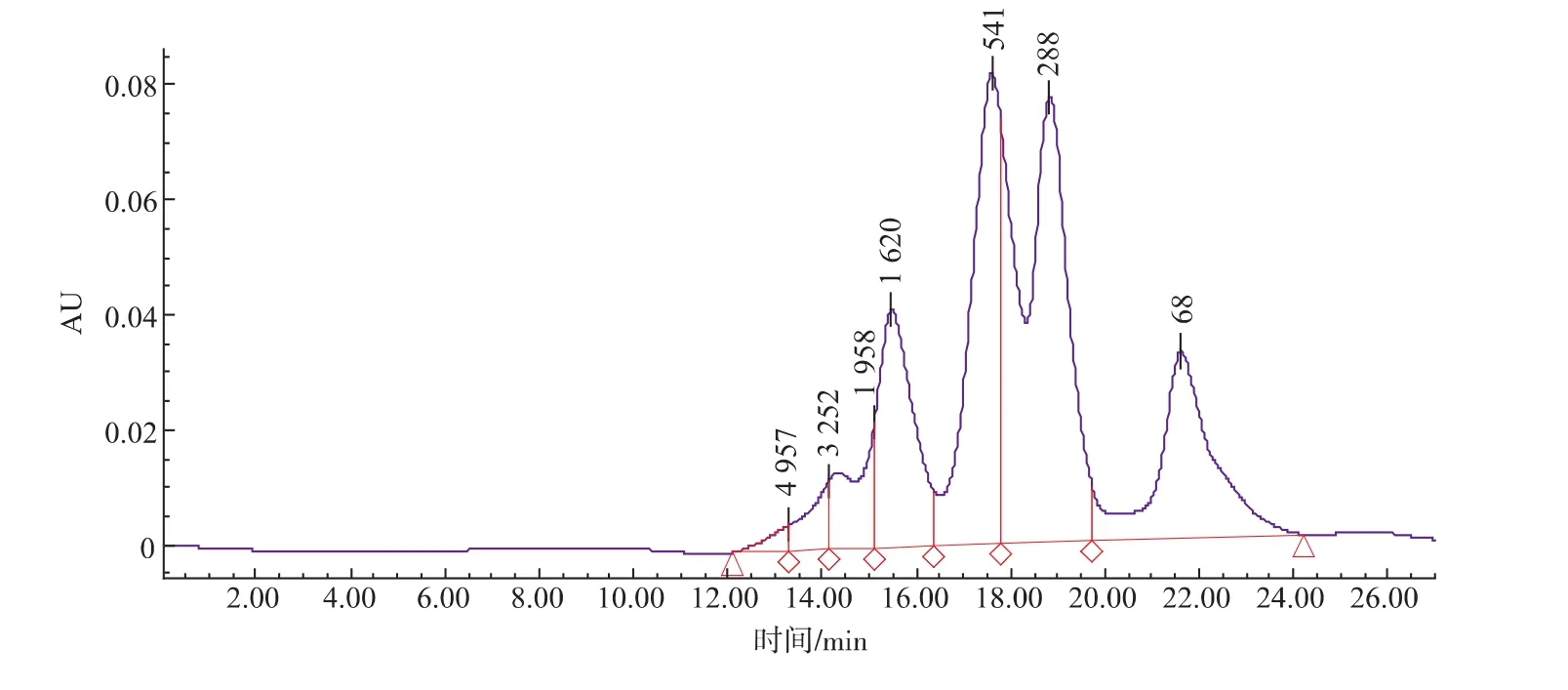
图5 紫菜酶解液超滤透过液相对分子质量分布Fig. 5 Molecular weight distribution of UF permeate
可以看出,紫菜抗氧化肽多为小分子肽,相对分子质量多在1 000以下,选用市场上常用的500 和300的纳滤膜,比较纳滤截留液的各指标。
结果显示300的纳滤膜滤出速度很慢,这可能是因为膜内部结构很紧密,膜孔很小导致大分子物质通过时造成堵塞,因此采用500纳滤膜。
2.4.2纳滤倍数对纳滤的影响与超滤相同,纳滤过程有纳滤透过液和纳滤截留液,自定义纳滤浓缩倍数=V原液/V纳滤截留液。纳滤倍数选择3、4、5、6四组进行实验,以纳滤速度、多肽回收率、DPPH自由基清除率为指标选择最佳的浓缩倍数。
由图6可以看出,浓缩4倍的实验组不仅速度较快,而且多肽回收率也最高,同时纳滤截留液的自由基清除率也最强,选择纳滤浓缩4倍再进行冷冻干燥以得到固体粉末。
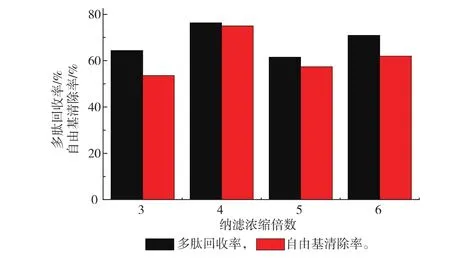
图6 纳滤浓缩倍数对多肽回收率等因素的影响Fig. 6 Effect of NF dilution multiple on peptide recovery rate
2.5紫菜抗氧化肽最适作用pH
将紫菜抗氧化肽配制成1 mg/mL的样液,置于不同pH的磷酸盐缓冲液中,室温下放置1 h,在标准条件下测定其DPPH自由基清除率。
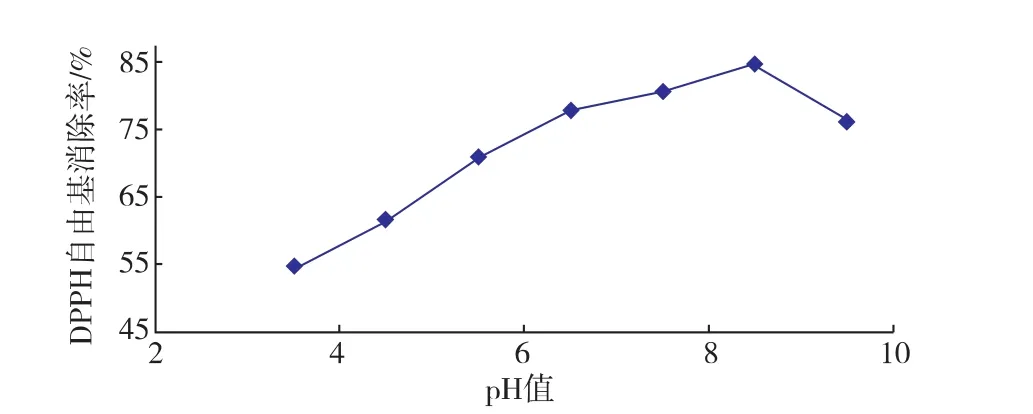
图7 pH值对紫菜抗氧化肽自由基清除率的影响Fig. 7 Effect of pH on DPPH scavenging activity of laver antioxidant peptide
紫菜抗氧化肽在碱性条件下比酸性条件下的DPPH清除率更高,其中在pH 8.0~pH 8.5自由基清除率最高,达到85%左右。
2.6紫菜抗氧化肽耐热性
将0.5 mg/mL的紫菜抗氧化肽置于40、50、60、70、80℃的水浴锅中保温6 h,每隔1小时取样,冷却至室温后测其抗氧化活性,见图8。
可以看出,经80℃处理6 h后的紫菜抗氧化肽仍保留83%左右的相对DPPH自由基清除率,说明该抗氧化肽有良好的耐热性。
2.7紫菜抗氧化肽在护肤霜中的应用初探
将紫菜抗氧化肽按不同体积分数0.5%、1%、1.5%、2%添加到护肤霜的配料中,并与原多肽液以及空白组进行比较,见图9。
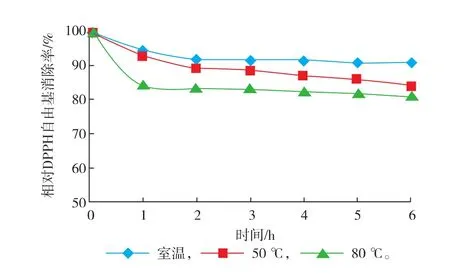
图8 温度对紫菜抗氧化肽自由基清除率的影响Fig. 8 Effect of temperature on DPPH scavenging activity of laver antioxidant peptide
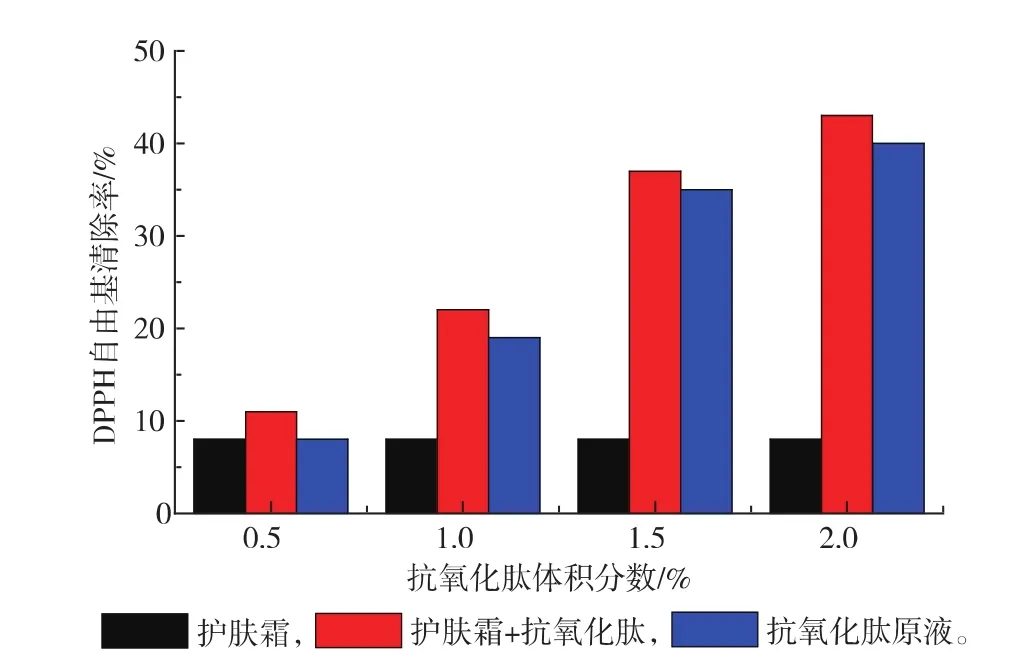
图9 添加紫菜抗氧化肽的护肤霜对DPPH自由基的清除率Fig. 9 Effect of adding laver antioxidant peptide on skin cream
可以看出,制备的抗氧化润肤霜的DPPH清除率随着添加量的增加而增加,且与原液相比,DPPH自由基清除率基本保持不变,表明该工艺生产的紫菜抗氧化肽可以用作添加剂加入到护肤霜中提高产品的抗氧化能力,为开发新型护肤霜提供了有用依据。
3 结语
选用适当的截留相对分子质量的超滤膜和纳滤膜,在一定条件下,可以将酶解产物中的抗氧化多肽分离出来。本研究采用酶解—膜分离技术从紫菜酶解产物中分离纯化抗氧化多肽,并对工艺流程中产生的副产物如紫菜多糖以及膳食纤维进行分离提取,以实现紫菜最大程度的综合利用。该工艺流程经原料预处理和条件优化后,抗氧化肽回收率达到73.1%,多糖回收率达到55%,膳食纤维回收率达85%,同时提高了该抗氧化肽的自由基清除能力,建立了一种可行的紫菜综合利用途径。紫菜抗氧化多肽属于天然产物、易于获得,相对分子质量小,该综合利用工艺为紫菜抗氧化肽大规模生产并在化妆品领域领域上的应用提供了理论和技术支持。
参考文献:
[ 1 ]王竹清,李八方.生物活性肽及其研究进展[J].中国海洋药物,2010,29(2):60-68. WANG Zhuqing,LI Bafang. Bioactive peptides and their research progress[J]. Chinese Journal of Marine Druge,2010,29 (2):60-68.(in Chinese)
[ 2 ]刘淑集,王茵,吴成业,等.坛紫菜降血压活性肽的分离纯化及分子质量测定[J].食品科学,2011,32(2):213-217. LIU Shuji,WANG Yin,WU Chengye. Isolation,purification and molecular weight determination of antihypertensive peptides derived from Porphyra haitanesis[J]. Food Sciences,2011,32(2):213-217.(in Chinese)
[ 3 ] Chabeaud A,Vandanjon L,Bourseau P,et al. Performances of ultrafiltration membranes for fractionating a fish protein hydrolysate:application to the refining of bioactive peptidic fractions [J]. Separation and Purification Technology,2009,66 (3):463-471.
[ 4 ]邓成萍,薛文通,孙晓琳,等.超滤在大豆多肽分离纯化中应用[J].食品科学,2006,27(2):192-195. DENG Chengping,XUE Wentong,SUN Xiaolin. Application of ultrafiltration on separation and purification of soybean peptides [J]. Food Sciences,2006,27(2):192-195.(in Chinese)
[ 5 ]何荣海,马海乐,余筱洁.条斑紫菜ACEI抑制肽的超滤分离与离子交换纯化[J].农业机械学报,2012,43(2):146-150. HE Ronghai,MA Haile,YU Xiaojie. Ultrafiltration and ionic exchange purification of ACE inhibitory peptides from hydrolysate of Porphyra yezoensis protein[J]. Transactions of the Chinese Society for Agricultural Machinery,2012,43(2):146-150.(in Chinese)
[ 6 ]曾庆祝,许庆陵.酶解-膜分离组合制备ACE抑制肽[J].食品科学,2008,29(2):229-233. ZENG Qingzhu,XU Qingling. Preparation of ACE inhibitor peptides with combination system of hydrolysis-membrane separation[J]. Food Sciences,2008,29(2):229-233.(in Chinese)
[ 7 ]吴琼英,戴伟.微波辅助提取条斑紫菜多糖及其抗氧化性研究[J].食品科技,2007(3):96-99. WU Qiongying,DAI Wei. Study on microwave-assisted extraction and antioxidation of polysaccharides from Porphyra yezoensis [J]. Food Sciense and Technology,2007(3):96-99.(in Chinese)
[ 8 ]李文,马海乐,王金斌.酶解反应与膜分离耦合连续制备紫菜降血压肽[J].食品科技,2008(10):71-75. LI Wen,MA Haile,WANG Jinbin. Continuous preparation of antihypertensive peptides from porphyra yezoensis by coupling enzymatic hydrolysis with membrane separation[J]. Food Sciense and Technology,2008(10):71-75.(in Chinese)
[ 9 ] Demers-Mathieu V,Gauthier S F,Britten M,et al. Antibacterial activity of peptides extracted from tryptic hydrolyzate of whey protein by nanofiltration[J]. International Dairy Journal,2013,28(2):94-101.
[10]丁青芝,马海乐,骆琳,等.米糠蛋白ACEI活性肽的超滤分离及其稳定性研究[J].食品研究与开发,2008,29(9):48-51. DING Qingzhi,MA Haile,LUO Lin et al. Purification of ACEI peptide from rice bran protein by ultrafiltration and study of its stability[J]. Food Research and Development,2008,29(9):48-51.(in Chinese)
[11] Ranamukhaarachchi S,Meissner L,Moresoli C. Production of antioxidant soy protein hydrolysates by sequential ultrafiltration and nanofiltration[J]. Journal of Membrane Science,2013,429:81-87.
[12]李锦生,傅晓琴,李冰,等.功能性生物活性物质超滤分离纯化技术的研究现状与进展[J].中国食品学报,2010,10(2):174-179. LI Jinsheng,FU Xiaoqin,LI Bing et al. Status quo and development of the ultrafiltration technology research in separation and purification for the functional bioactive compounds[J]. Journal of Chinese Institute of Food Science and Technology,2010,10 (2):174-179.(in Chinese)
Study on the Preparation of Antioxidative Peptides from Enzymatic Hydrolysis of Laver and Their Comprehensive Utilization
LIU Dondong,TIAN Yaping*
(Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China)
Abstract:This study integrate enzymatic reaction with several membrane technologies to construct a method for comprehensive utilization of antioxidant peptide and other active substances from laver. The hydrolysate of laver was separated and purified through ultrafiltration(10 kDa cut-off molecular weight)and nanofiltration(500 Da cut-off molecular weight). After optimizing the operation parameters of membrane separation,recovery rates of antioxidant peptide,polysaccharide,dietary fiber,and peptide reached 73.1%,55%,85%,and 18%,respectively. The peptides from laver showed the DPPH scavenging activity. The DPPH scavenging activity of 0.5 mg/mL nanofiltration peptide solution was up to 68.5%. Furthermore,the optimum pH value of laver antioxidant peptide was 8.5. Meanwhile,these peptides showed a good stability,it retained about 83% relative scavenging activity of DPPH radical after heated at 80℃for 6 h.
Keywords:laver,antioxidant peptide,membrane technology,comperhensive utilization
*通信作者:田亚平(1964—),女,安徽淮南人,工学博士,教授,硕士研究生导师,主要从事生物活性物质方面的研究。E-mail:yapingtian@hotmail.com
基金项目:江苏省农业支撑计划项目(BE2013358)。
收稿日期:2014-09-03
中图分类号:Q 819
文献标志码:A
文章编号:1673—1689(2016)02—0166—07
