双缺陷型毕赤酵母X33突变株的诱变育种
2016-05-23顾鹏飞朱瑞宇江南大学工业生物技术教育部重点实验室江苏无锡214122江南大学药学院江苏无锡214122
顾鹏飞, 李 萌, 朱瑞宇, 金 坚(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学药学院,江苏无锡214122)
双缺陷型毕赤酵母X33突变株的诱变育种
顾鹏飞1,2,李萌1,2,朱瑞宇1,2,金坚1,2
(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学药学院,江苏无锡214122)
摘要:为促进Pichia pastoris X33 α-1,6-甘露糖转移酶(OCH1p)与α-1,3-甘露糖转移酶(ALG3p)双突变菌株(och1 alg3 mX33)作为蛋白质表达宿主菌的应用,为双突变菌株进一步糖基化的研究奠定基础。作者通过紫外诱变和常压室温等离子体(ARTP)诱变的方法来提高双突变菌株的生长速度以及适应能力。经过4轮筛选发现了生长速度提高15%、温度敏感性有所降低、细胞存活率有所提高的双突变菌株。
关键词:糖基化;诱变;生长表型;甘露糖转移酶
毕赤酵母作为生产重组蛋白药物的宿主菌,已广泛用于重组蛋白质的表达[1-2]。但其对蛋白质的过度糖基化修饰,可产生不同于哺乳动物细胞的高甘露糖型糖基[3]。酵母与哺乳动物细胞对糖蛋白的糖基化过程,在内质网中的起始过程相同,都会形成相同的核心糖链结构Man8GlcNAc2,但在转移至高尔基体进行后续的糖基化时,酵母与哺乳动物细胞的糖基化过程存在明显差异[4-5]。研究发现,在毕赤酵母高尔基体中,蛋白糖基在α-1,6-甘露糖转移酶(OCH1p)和α-1,3-甘露糖转移酶(ALG3p)的作用下,继续添加甘露糖,导致过度糖基化[6-7]。
作者所在课题组已成功获得—OCH1(α-1,6-甘露糖转移酶)基因和ALG3(α-1,3-甘露糖转移酶)基因双敲除菌株,并利用突变菌株作为宿主工程菌对GM-CSF进行表达。结果显示,Pichia pastoris X33双突变菌株对外源蛋白质的表达具有毕赤酵母表达系统的大多优点[8]。但是,双突变菌株的生长速度与野生菌相比显著降低,对于GM-CSF的表达水平与野生菌相比也明显下降,极大地限制了突变菌作为宿主工程菌的应用。因此,作者通过诱变育种的方法提高双突变菌的生长速度和适应能力[9-11],以进一步提高Pichia pastoris X33双突变菌株作为宿主工程菌应用的可行性,为双突变菌株进一步糖基化的研究奠定基础。
1 材料与方法
1.1材料
1.1.1菌株Pichia pastoris X33野生型菌株:作者所在研究室保存;Pichia pastoris X33双突变菌株:作者所在研究室构建。
1.1.2试剂蛋白胨、酵母提取物、无氨基酸酵母氮源(YNB):加拿大BIO BASIC INC公司;磷酸氢二钾、磷酸二氢钾:国药集团化学试剂有限公司。台盼蓝(Trypan blue)、山梨醇(Sorbitol)、阿利新兰(Alcian blue)和刚果红(Congo red):上海生工生物工程技术服务有限公司。
1.1.3培养基及溶液的配制
1)YPD培养基:1 g/dL酵母提取物,2 g/dL蛋白胨,2 g/dL葡萄糖,固体培养基添加1.5 g/dL琼脂粉。
2)YPD+sorbitol培养基:1 g/dL酵母提取物,2 g/dL蛋白胨,2 g/dL葡萄糖,0.4 mol/L sorbitol,固体培养基添加1.5 g/dL琼脂粉,1 mol/L sorbitol。
3)PBS缓冲液(pH 7.3):135 mmol/L NaCl,2.7 mmol/L KCl,4.3 mmol/L Na2HPO4,1.4 mmol/L K2HPO4。
4)Tris缓冲液(pH 7. 5):50 mmol/L Tris,用HCl调pH值至7. 5。
5)吕氏碱性美蓝染色液:美蓝0.3 g溶于30 mL 95%乙醇后与100 mL 0. 01%氢氧化钾溶液混合。
1.2实验方法
1.2.1诱变实验方法
1)制作紫外诱变致死率标准曲线:从YPD平板上挑取P. pastoris X33双突变菌株的单菌落,在YPD液体培养基中28℃、215 r/min培养48 h,将酵母菌悬液稀释到1 000个/mL,分别在紫外灯下暴露10、20、30、40、50、60、70、80、90 s,期间用转子搅拌。诱变后涂板,并避光培养3~7 d。长出菌落后进行菌落计数,制作致死率标准曲线。
2)双突变菌的紫外诱变育种:紫外诱变40 s时死亡率达到90%,故将诱变时间设在40 s。将酵母菌悬液稀释到1 000个/mL,打开紫外灯照射40 s,完后涂板,并避光培养3~7 d,每天查看菌落生长情况,寻找生长速度加快的菌株并保藏菌种。
3)制作ARTP等离子诱变致死率标准曲线:从YPD平板上挑取P. pastoris X33紫外诱变菌株的单菌落,在YPD液体培养基中28℃、215 r/min培养48 h,将酵母菌悬液调节OD至6~8,分别在等离子体下照射20、40、60、80、100 s。诱变完后涂板,培养5~7 d。长出菌落后进行菌落计数,制作致死率标准曲线。
4)紫外诱变菌的ARTP诱变育种:诱变60 s时死亡率达到80%,故将诱变时间设在60 s。等离子态照射60 s,之后10倍系列稀释涂板,培养3~7 d,每天查看菌落生长情况,寻找生长速度加快的菌株并保种。
1.2.2对诱变菌生长情况的研究方法
1)种子活化及生长曲线测定:从YPD平板上挑取P. pastoris X33双突变菌株和P. pastoris X33诱变菌株的单菌落,在YPD液体培养基中28℃、215 r/min活化培养48 h。将活化的种子转接至新鲜的YPD液体培养基中,分别取培养12、14、16、18、20、22、24、26、28、30、32、36、40、44、48、52、56 h菌液于A600测定吸光度,并绘制种子生长曲线。
2)温度敏感性试验:分别取500 μL稳定期的P. pastoris X33双突变菌株和P. pastoris X33诱变菌株菌液,调整菌体A600值至3.0左右,分别用YPD液体培养基10倍系列稀释,取2 μL稀释的菌悬液,分别点在YPD及YPD-sorbitol平板上,分别于28、37℃下培养,5~7 d后观察菌落生长情况。
3)刚果红敏感性试验:分别取500 μL稳定期的P. pastoris X33双突变菌株和P. pastoris X33诱变菌株菌液,调整A600值至5.0左右,分别用新鲜的YPD液体培养基10倍系列稀释,取5 μL稀释的菌悬液,分别点在YPD和YPD + Congo red(50 μg/mL)平板上,置28℃培养箱中,培养5~7 d后,观察菌落生长情况。
4)菌体形态观察:分别取5 μL 28℃培养的P. pastoris X33双突变菌株和P. pastoris X33诱变菌株菌液,点于载玻片上,将涂片在火焰上固定,待冷,滴加染液,染1~3 min,水洗,待干,镜检。用华东师范大学电子显微镜中心投射电子显微镜(HT7700HITACHI,是日立高新技术公司为生物、制药、纳米技术和软材料等领域而开发的最先进的透射电子显微镜)进行拍照,对比P. pastoris X33双突变菌株和P. pastoris X33诱变菌株的细胞形态。
5)细胞存活率检测:分别挑取P. pastoris X33双突变菌株和P. pastoris X33诱变菌株,接种于YPD液体培养基中,28℃培养至对数生长期时,以l∶10的比例转接至新鲜的YPD液体培养基中,同时接种于YPD-sorbitol液体培养基中,于37℃培养。分别于0、10、20、30、40、50、60 h时取样,稀释,台盼蓝染色,镜检,计数死细胞和总细胞数,计算存活率。每个样品共计数500个细胞,绘制细胞存活率—时间曲线。
6)GM-CSF在菌株中的表达与分析:将双突变菌、诱变菌、野生菌和单敲除菌接种到2 mL的YPD(蛋白胨2 g/dL,酵母提取物1 g/dL,葡萄糖2 g/dL)培养基中,28℃培养24 h后,以2%的接种体积分数接种到100 mL的BMGY(蛋白胨2 g/dL,酵母提取物1 g/dL,YNB 1.34 g/dL,甘油2%,100 mmol/L磷酸盐缓冲液,pH 6.0)培养基中,28℃培养24 h,离心去上清液并重悬于15 mL的BMMY(酵母提取物1 g/dL,YNB 1.34 g/dL,蛋白胨2 g/dL,100 mmol/L的磷酸盐缓冲液,pH6.0)培养基中,同时加入2%的甲醇开始诱导表达,诱导72 h结束后离心取上清液,超滤浓缩后用于蛋白质的SDS-PAGE分析。
2 结果与讨论
2.1诱变实验富集结果
2.1.1紫外诱变实验富集结果每一轮紫外诱变过后都进行数次富集筛选,具体做法是将一轮诱变后生长速度较快的毕赤酵母菌混合,再涂板,以寻找其中生长速度最快的,筛选条件主要是观察菌落直径和菌落生长速度。这样经过3轮紫外诱变,十几次富集筛选,筛选到了一些生速度加快的菌株。由图1可以看出,经过三轮紫外诱变的菌的菌落比双突变菌大。

图1 第三轮紫外诱变富集结果(培养5 d)Fig. 1 Third round of ultraviolet mutagenesis enrichment results (cultured for 5 days)
2.1.2 ARTP诱变实验富集结果同样,一轮ARTP诱变后也进行数次富集筛选,寻找生长速度最快的菌株,这样再经过一轮ARTP诱变实验,筛选到了比紫外诱变菌株生长速度更快的菌株。由图2可知,经过3轮紫外诱变,再经过一轮ARTP诱变后,得到了生长速度更快的菌株。
2.2诱变实验富集结果
2.2.1菌株的生长情况将X-33双突变菌株和X-33诱变菌株分别接种于新鲜的YPD+sorbitol培养基中,于28℃、215 r/min振荡培养,测定A600值,以时间(h)为横坐标,A600值为纵坐标,作生长曲线,见图3。

图2 ARTP诱变富集结果(培养7 d)Fig. 2 Results of enrichment of ARTP mutagenesis(cultured for 7 days)

图3 标准条件下P. pastoris X33双突变菌株和P. pastoris X33诱变菌株的生长曲线Fig. 3 Growth curve of the double mutant X33 and mutagenesis X33 under standardized conditions
由图3可以看出,在同等培养条件下,在一定的时间范围内,P. pastoris X33诱变菌株的生长情况,与P. pastoris X33双突变菌株相比,生长速度加快了约15%,对数期缩短,斜率更大,菌液浓度提高了约20%。说明诱变对酵母细胞的生长产生了影响,使毕赤酵母细胞的生长速度增加、细胞密度增加,具体原因有待进一步分析。
2.2.2温度对生长情况的影响温度对毕赤酵母的生长影响比较大,在不同的温度下,毕赤酵母的生长速度会有明显差异,在最适温度时,毕赤酵母的生长繁殖非常旺盛。但是敲除了必需基因后,毕赤酵母的生长能力明显下降,即使在有1 mol/L sorbitol的情况下,生长速度也显著降低,见图4。

图4 X33双突变菌株和X33诱变菌株对温度的敏感性Fig. 4 Sensitivities of the double mutant X33 and mutagenesis X33 to temperature
结果显示,X33双突变菌株和X33诱变菌株对温度都比较敏感,在28℃培养时,菌株生长状况较好;当培养温度升至37℃后,菌株的生长受到抑制,未见生长。在37℃时补加1.0 mol/L sorbitol后,X33诱变菌株的致死性生长受到抑制,说明X33诱变菌对渗透压的适应能力有了一定提高。
2.2.3菌株对渗透压的敏感性在正常的情况,不同的渗透压对毕赤酵母的影响不是很大,因为毕赤酵母细胞膜有一定的缓冲能力,但是对于双敲除菌株,它的细胞膜不完整,导致对渗透压的适应能力明显下降,见图5。
检测结果显示,用刚果红染菌落,野生菌细胞壁完整,双突变菌株细胞壁不完整,诱变菌适应能力有所改善,但刚果红仍为阳性,说明细胞壁也不完整。

图5 野生菌、X33双突变菌株和X33诱变菌株对刚果红的敏感性Fig. 5 Sensitivities of wild strain, the double mutant X33 and mutagenesis X33 to Congo red
2.2.4菌体形态观察细胞的形态直接反映了菌株的具体生存情况,在正常情况下,菌株的细胞应该是球形或者椭球形,表面比较平滑均匀。但是对于缺乏重要细胞膜相关基因的双敲除菌株来说,它的细胞形态有了明显的改变,见图6—7。

图6 X33双突变菌株和X33诱变菌株细胞形态的电镜观察Fig. 6 Electron microscopy of cell morphology caused by the double mutant X33 and mutagenesis X33
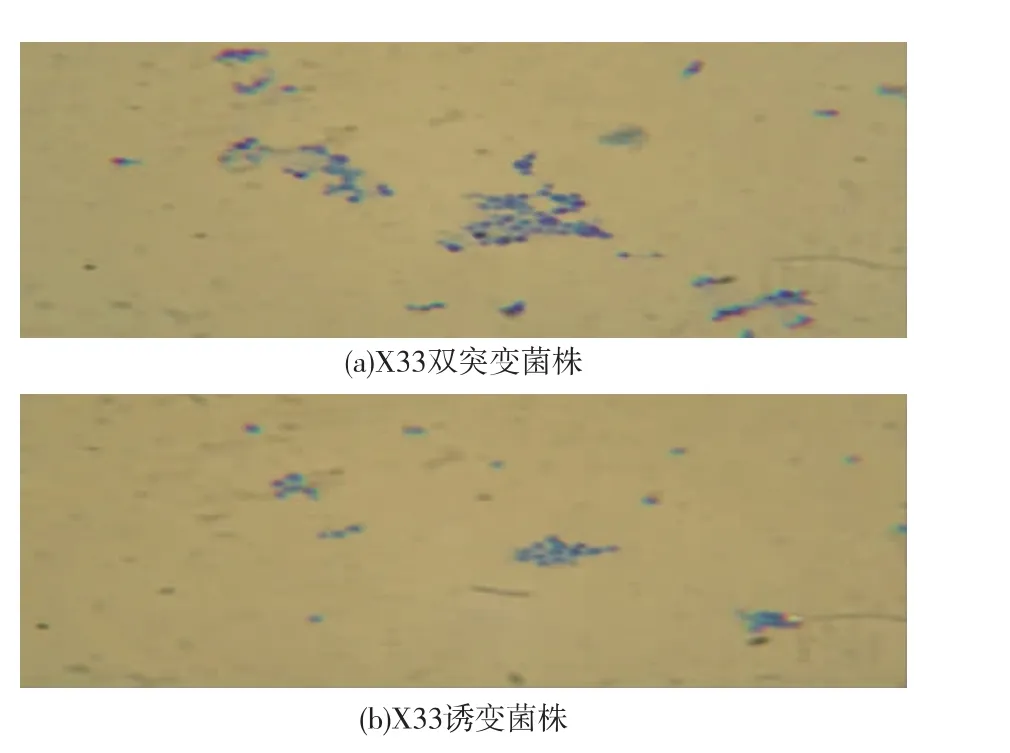
图7 X33双突变菌株和X33诱变菌株细胞形态变化的光镜观察(美蓝染色,×100)Fig. 7 Optical microscopy of cell morphology caused by the double mutant X33 and mutagenesis X33 (methylene blue dyeing,×100)
从电镜照片上可以看出,在进入稳定期后,X33诱变菌株与X33双突变菌株相比,母细胞未与子细胞完全分离就又重新出芽的现象有所好转,见图6。美蓝染色结果同样验证了上面的结论,见图7。
2.2.5菌株的存活率将X-33双突变菌株和X-33诱变菌株分别接种于新鲜的YPD+sorbitol培养基中,于28℃、215 r/min振荡培养,每10小时测定一次细胞存活率,以培养时间(h)为横坐标,存活率为纵坐标,作存活率曲线,见图8。
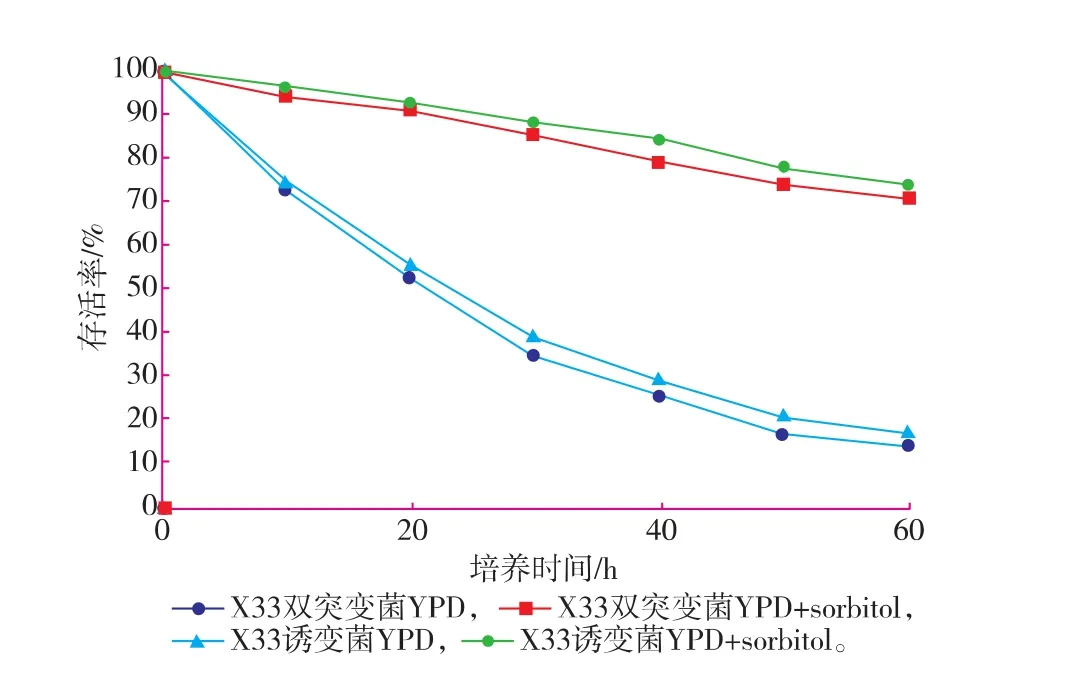
图8 X33双突变菌株和X33诱变菌株的存活率-时间曲线Fig. 8 Survival rate-time curve of the double mutant X33 and mutagenesis X33
细胞存活率-时间曲线显示,X33双突变菌株细胞存活率低于X33诱变菌株;在用YPD+sorbitol培养基培养时,X33双突变菌株和X33诱变菌株的细胞存活率均明显高于用YPD培养基培养时的细胞存活率,且X33诱变菌株细胞存活率比X33双突变菌株高。
2.2.6 GM-CSF在菌株中的表达与分析由图9可知,GM-CSF可以在野生菌和单敲除菌中良好表达,不需要浓缩;GM-CSF在双突变菌和诱变菌中表达的上清液分别浓缩500倍后进行SDS-PAGE分析,可以得到表达量良好的图谱,并且诱变菌的表达量要比双突变菌高,见图9。同时也说明,敲除了两个必需基因后,菌株的表达水平降低了许多。经过冷冻干燥后由于盐浓度太高,条带比较宽,但是希望通过冷冻干燥来浓缩的目的并没有达到。
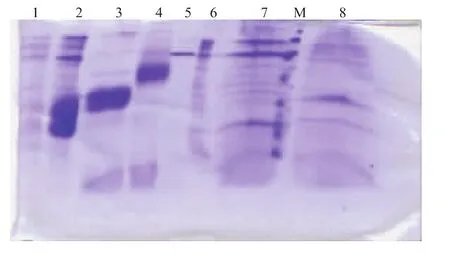
图9 GM-CSF在菌株中的表达Fig. 9 Expression of GM-CSF in strains
3 结语
毕赤酵母表达系统N-糖基化代谢途径改造的进行使得通过发酵工程大规模生产复杂型糖蛋白药物成为了可能,拓宽了酵母表达系统的应用范围。然而,在酵母的标准培养条件下,P. pastoris X33突变菌株与野生型菌株相比,生长速度很慢,可能是由于敲除了酵母的och1基因和alg3基因对酵母的生理调节和细胞壁的形成造成了重大缺陷,从而使得生长状态受到影响[12]。甘露糖蛋白是酵母细胞壁的主要组分,其中的甘露糖是影响细胞活性的重要组成成分,甘露糖蛋白可在细胞外形成一层保护层,维持细胞壁结构的完整,保护细胞免受外源物质的破坏,因此,敲除了och1基因和alg3基因,酵母的α-1,6-甘露糖转移酶和α-1,3甘露糖转移酶功能缺失,这会导致甘露糖蛋白的糖基化出现缺陷,进而破坏细胞壁的结构[3]。另外,糖基化对细胞壁结构的破坏还可以通过影响合成细胞壁其他成分的功能蛋白的折叠、转运以及活性[13]。
通过紫外诱变的方法,可以改变酵母的一系列基因,这样就有可能打开正常情况下不开启的代谢途径。基因突变可以增强一些酶的活性以及改变一些酶的性质,进而有可能使现有代谢途径的效率提高或者发生有益的改变。经过4轮诱变后,发现P. pastoris X33诱变菌株的生长速度比P. pastoris X33双突变菌株提高了20%左右。在37℃培养时,X33诱变菌株可以在带有1 mol/L sorbitol的YPD培养基上生长,而X33双突变菌株不能。细胞壁完整性的破坏增加了细胞对一些细胞壁抑制性药物(如刚果红)及环境因素(如温度)的敏感性。细胞形态观察显示,处于稳定期的X33双突变菌株母细胞仍未与子细胞完全分离,就又有新的子细胞出现,这一现象在X33诱变菌株中有所改善。另外菌株的表达量也有所提升。
毕赤酵母具有表达水平高、基因操作简单、生产成本低、不产生内毒素和可以大规模生产等优点,又具有真核细胞许多翻译后修饰功能如糖基化修饰,已经广泛应用于各种外源重组蛋白的表达。但是毕赤酵母对蛋白糖基化修饰后形成高甘露糖型糖链,不同于哺乳动物细胞产生的复杂型糖链,因此毕赤酵母表达的蛋白尤其是药用糖蛋白在用作治疗时,会产生很多问题,如半衰期短、产生较高的免疫原性、易被清除等,严重限制了毕赤酵母在生产药用蛋白中的应用。因此人们希望通过改变毕赤酵母的糖基化代谢途径,使产生类似于哺乳动物细胞的复杂型糖链,以提高它的使用价值。
综上所述,作者研究了P. pastoris X33双突变菌株与P. pastoris X33诱变菌株的生理特性,为该菌株进一步糖基化的研究奠定了一些基础。相信随着研究的深入、方法的改进、社会需求的提高,毕赤酵母作为宿主菌生产动物乃至于人类的糖蛋白产品的愿望一定会更快实现。
参考文献:
[ 1 ] Juergen H Nett,Terrance A Stadheim,Huijuan Li,et al. A combinatorial genetic library approach to target heterologousglycosylation enzymes to the endoplasmic reticulum or the golgi apparatus of Pichia pastoris[J]. Yeast,2011,28:237-252.
[ 2 ] Potgieter TI,Cukan M,Drummond JE et al. Production of monoclonal antibodies by glycoengineered Pichia pastoris [J]. Journal of Biotechnology,2009,139(4):318-325.
[ 3 ] Liu B,Gong X,Chang SH et al. Disruption of the OCH1 and MNN1 genes decrease N-glycosylation on glycoprotein expressed in Kluyveromyces lactis[J]. Journal of Biotechnology,2009,143:95-102.
[ 4 ] Jacobs PP,Geysens S,Vervecken W et al. Engineering complex-type N-glycosylation in Pichia pastoris using GlycoSwich technology[J]. Nature Protocol,2009,4:58-70.
[ 5 ]罗竞红,游自立.巴斯德毕赤酵母表达系统在外源基因表达中的研究进展[J].生物技术通报,2007,3:75-79. LUO Jinghong,YOU Zili. Study on expression of heterologous gene in Pichia pastoris[J]. Biotechnology Bulletin,2007,3:75-79.(in Chinese)
[ 6 ] Wildt S,Gerngross T U. The humanization of N-glycosylation pathways in yeast[J]. Nat Microbiol,2005,3(2):119-128.
[ 7 ] Hamilton R,Gerngross U. Glycosylation engineering in yeast:the advent of fully humanized yeast[J]. Current Opinion in Biotechnology,2007,18(5):387-392.
[ 8 ] Bobrowicz P,Davidson RC,Li H et al. Engineering of an artificial glycosylation pathway blocked in core oligosaccharide assembly in the yeast Pichia pastoris:production of complex humanized glycopreteins with terminal galactose [J]. Glycobiology,2004,14(9):757-766.
[ 9 ]王书全,李明,马鸣潇.一种新型杂合抗菌肽在毕赤酵母中的表达及其抗菌活性[J].中国生物制品学杂志,2011,24(2):173-175,178. WANG Shuquan,LI Ming,MA Mingxiao. Expression of a novel hybrid antibacterial peptide in Pichia pastoris and its antibacterial activity[J]. Chin J Biological,2011,24(2):173-175,178.(in Chinese)
[10] Hashimoto S,Ogura M,Aritomi K et al. Isolation of auxotrophic mutants of diploid industrial yeast strains after UV mutagenesis [J]. Appl Environ Microbiol,2005,71(1):312-319.
[11] Stephen R Hughes,William R Gibbons. Random UV-C mutagenesis of Scheversomyces(formerly Pichia)stipitis NRRL Y-7124 to improve anaerobic growth on lignocellulosic sugars[J]. J Ind Microbiol Biotechnol,2012,39:163-173.
[12]许永利,张大成,朱瑞宇,等.毕赤酵母X-33糖基化突变菌株的生理特性[J].中国生物制品学杂志,2011,24(4):439-442. XU Yongli,ZHANG Dacheng,ZHU Ruiyu,et al. Physiological property of Pichia pastoris X-33 glycosylation mutant[J]. Chin J Biological,2011,24(4):439-442.(in Chinese)
[13] Martin Schmidt,Meghan E Strenk et al. Importance of cell wall mannoproteins for septum formation in Saccharomyccs cerevisiae [J]. Yeast,2005,22(9):715-723.
Mutation Breeding of Double Deficient Mutant Pichia pastoris X33 Strain
GU Pengfei1,2,LI Meng1,2,ZHU Ruiyu1,2,JIN Jian1,2
(1. Key Laboratory of Industrial Biotechnology,Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China;2. School of Medicine and Pharmaceutics,Jiangnan University,Wuxi 214122,China)
Abstract:To promote the application of α-1, 6-mannose transferase (OCH1p) and α-1, 3-mannose transferase (ALG3p) double mutant strain of Pichia pastoris X33 (och1 alg3 mX33) as host for protein expression and to lay the foundation for the further glycosylation of the double mutant strain, this study wants to increase the growth rate as well as the ability to adapt of the double mutant strain through ultraviolet mutagenesis and Atmospheric and Room Temperature Plasma (ARTP) mutagenesis methods. At last, after four rounds of screening, a double mutant strain was found to be 15% increase in growth speed, the decrease in temperature sensitivity, and the improvement in cell survival rate.
Keywords:glycosylation,mutagenesis,growth phenotype,mannose transferase
*通信作者:金坚(1930—),男,江苏苏州人,医学博士,教授,博士研究生导师,主要从事长效重组蛋白药物与肿瘤多药耐药机制方面的研究。E-mail:jinjian31@126.com
基金项目:国家自然科学基金项目(81101667);江苏省基础研究计划(自然科学基金)项目(BK2009071)。
收稿日期:2014-07-24
中图分类号:Q 815
文献标志码:A
文章编号:1673—1689(2016)02—0129—07
