复方肠泰制剂对溃疡性结肠炎小鼠肠黏膜屏障的保护作用
2016-05-23何丽娟张军东安毛毛姜远英
何丽娟,张军东,安毛毛,姜远英
·>临床医学·
复方肠泰制剂对溃疡性结肠炎小鼠肠黏膜屏障的保护作用
何丽娟,张军东,安毛毛,姜远英
[摘要]目的观察复方肠泰制剂在小鼠溃疡性结肠炎中对肠黏膜屏障的保护作用,并探讨其作用机制。方法建立葡聚糖硫酸钠诱导小鼠实验性溃疡性结肠炎模型,实验分为空白组、模型组、不同剂量治疗组(4.3 g/kg与17.1 g/kg)、美沙拉嗪对照组和硫唑嘌呤对照组。造模7 d内,观察记录各组小鼠体质量和疾病活动指数变化;采用透射电镜观察各组小鼠结肠的超微结构;HE染色观察各组小鼠炎症; ELISA法测定各组小鼠结肠组织TNF-α、IL-6、IFN-γ、IL-10;蛋白质印迹方法检测各组小鼠结肠组织中ZO-1、Occludin和Claudin-1蛋白的表达。结果模型组小鼠体质量、DAI和结肠长度与空白对照组比较,差异均有统计学意义(P<0.05);结肠组织中TNF-α、IL-6和IFN-γ水平显著降低,差异有统计学意义(P<0.05);组织病理显示炎性细胞明显浸润,ZO-1、Occludin和Claudin-1蛋白的表达显著下降,差异有统计学意义(P<0.05);高剂量复方肠泰组与空白对照组比较,差异均无统计学意义(P>0.05)。结论高剂量复方肠泰制剂对小鼠肠黏膜屏障功能具有一定的保护作用,其机制可能与肠上皮紧密连接蛋白表达升高以及肠道免疫功能调节有关。
[关键词]溃疡性结肠炎;紧密连接蛋白;肠屏障功能
溃疡性结肠炎(ulcerative colitis,UC)是一种自身免疫性疾病,病因不明,发病机制至今也没有确定,一般认为是环境因素、基因和免疫因素三者相互作用的结果[1]。在临床上,这种疾病发病率逐年增高,治疗难度较大,且反复发作,较难有效控制。国内外近期研究普遍认为其发作与肠道屏障功能密切相关[2],本研究采用更接近人类UC病理及免疫特点的葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导C57小鼠建立实验性UC模型,探讨UC发病的可能机制。现报道如下。
1材料与方法
1.1材料
1.1.1实验动物清洁级6~8级雌性C57BL/6小鼠共60只,购自上海斯莱克实验动物有限责任公司。采用数字表法随机分为空白对照组(Control)、模型组(Model)、低剂量肠泰组(4.3 g/kg,LCT)、高剂量肠泰组(17.1 g/kg,HCT)、美沙拉嗪对照组(Mesalazine)和硫唑嘌呤对照组(Azathioprine)共6组。实验动物饲养于上海同济大学医学院清洁级动物房。
1.1.2药物及复方肠泰制备黄柏(CortexPhellodendri)50 g,地榆(radixsanguisorbae)、地锦草(EuphorbiahumifusaWilld.)和辣蓼(PolygonumflaccidumMeissn.)各37.5 g(购自上海同仁堂药店)。药物制备方法:取黄柏粗粉,加7倍量的70%乙醇,提取2次,每次2 h,滤过,合并滤液,回收乙醇,备用。药渣与其余3味,加15倍的水煎煮2次,每次1.5 h,合并滤液,浓缩至相对密度为1.00~1.05,与黄柏浓缩液合并,继续浓缩,最终得到的浓缩液分装后冻存于-80 ℃冰箱备用。
1.1.3实验试剂DSS(MP公司)、莎尔福美沙拉嗪肠溶片(Dr. Falk Pharma GmbH公司)、硫唑嘌呤片(上海信谊药厂有限公司)、羧甲基纤维素钠(国药集团化学试剂有限公司)、甲醛(国药集团化学试剂有限公司)、水合氯醛(美仑生物)、RIPA裂解液(碧云天生物技术研究所)、ELISA试剂盒(eBioscience公司)、Western blot 抗体抗(Cell Signaling Technology公司)、二抗(北京鼎国生物技术公司)。
1.1.4主要仪器旋转蒸发仪(上海亚荣生化仪器厂)、电子天平(梅特勒-托利多公司)、酶标仪(Thermo scientific公司)、Haier立式超低温保存箱(青岛海尔特种电器有限公司)、冷冻高速离心机与转膜仪(Bio-rad公司)、化学发光成像系统(GE公司)、透射电镜(日立H-800公司)。
1.2方法
1.2.1模型的建立和评价60只C57BL/6小鼠分完组后进入清洁级动物房,正常饲养3 d后造模,除空白对照组自由饮用灭菌水外,其余各组均自由饮用配置完毕的1.5% DSS水溶液共7 d。每天在固定时间段对小鼠进行灌胃等药物干预(各组给药剂量为:美沙拉嗪500 mg/kg,硫唑嘌呤2 mg/kg,低剂量复方肠泰4.3 g/kg,高剂量复方肠泰17.1 g/kg,模型组和空白组以生理盐水代替),药物均以0.5%羧甲基纤维素钠(sodium carboxymethylcellulose,CMC)溶液助溶,同时每天按时称质量记录,仔细观察各组小鼠活动形态。每天换一次垫料,观察粪便形态并测隐血评分。7 d后取材,每组取1只留作透射电镜用,剩余所有小鼠麻醉后取出结肠段,迅速量取长度并选取各组代表性的结肠段作直观对照图。每组各3只小鼠的整段结肠冻存于-80 ℃冰箱留作检测细胞因子;剩余3只留作检测蛋白使用,剪取一段结肠组织后均用PBS缓冲液冲洗后冻存于-80 ℃冰箱。
1.2.2小鼠结肠组织HE染色检测各组炎症细胞水平差异在距离小鼠肛门1 cm处剪取一段长约2 cm的结肠组织,纵向剖开,并用预冷的PBS缓冲液冲洗肠道内容物、组织液及血液,将洗净后的结肠组织浸入4%多聚甲醛中固定,常规石蜡包埋,切片后进行苏木精-伊红(HE)染色,脱水透明后树胶封固,光镜下观察。
1.2.3透射电镜(TEM)观察各组结肠组织紧密连接每组各1只小鼠进行麻醉,从麻醉后的小鼠体内取出一小段结肠末端组织,用4 ℃预冷的PBS冲洗内容物和组织液,迅速使用预冷的手术刀片取下一小片所需的组织,立即放入4 ℃存放的2.5%戊二醛固定液中固定2 h后漂洗,并用1%锇酸后固定,乙醇梯度脱水并树脂包埋,过夜固化,切片后枸橼酸铅染色,水洗干燥后电镜观察。
1.2.4Western blot检测ZO-1,Occludin,Claudin-1蛋白的表达从-80 ℃取出不同组别间各3只小鼠的一段结肠组织置于研钵中,液氮处理后使用研磨棒将其彻底碾成粉末,将这些粉末混匀后收集到EP管中,加入适量RIPA裂解液,混匀后置于4 ℃高速震荡20 min后,转入高速冷冻离心机中4 ℃离心10 min后取上清,95 ℃蛋白变性10 min后分装,存入-80 ℃冰箱备用。将制备好的蛋白液体进行SDS-PAGE电泳,半干转将蛋白从凝胶上转至PVDF膜上,5%脱脂牛奶封闭,一抗孵育过夜,PBST冲洗后二抗孵育,最后在化学发光系统下进行显影。
1.2.5ELISA检测小鼠结肠组织中细胞因子水平截取小鼠整段结肠,置于匀浆器中研磨成浆液,4 ℃离心后取上清,分装后放入-80 ℃备用。使用相应的ELISA试剂盒按照规定检测TNF-α、IL-6、IFN-γ、IL-10这4个细胞因子水平。
1.3统计学处理采用GraphPad Prism 5.0进行数据处理并统计学分析,2组数据间的比较用t检验,P<0.05表示差异有统计学意义。
2结果
2.1复方肠泰制剂抑制小鼠实验性溃疡性结肠炎生成小鼠经DSS造模后出现体质量明显下降、少动、便血等症状,造模完成后,模型组小鼠结肠明显缩短并且整体充血红肿。和空白对照组相比,HCT组小鼠的结肠长度和体质量差异均无统计学意义(P>0.05)。该结果提示高剂量复方肠泰制剂对小鼠结肠炎的发生具有明显抑制作用,见图1。
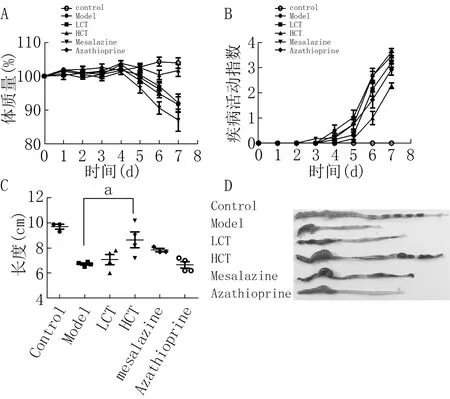
注:A为各组小鼠在整个实验周期内的体质量相对变化量的比较;B为各组小鼠在整个实验周期中的疾病活动指数评分比较;C为各组小鼠的结肠长度比较;D为各组小鼠代表性结肠外观比较;Control为空白对照组,Model为模型组,LCT为低剂量组,HCT为高剂量组,Mesalazine为美沙拉嗪对照组,Azathioprine为硫唑嘌呤对照组图1 复方肠泰制剂对各组小鼠体质量、疾病活动指数及长度外观的影响
2.2光镜下小鼠结肠组织病理变化表现DSS诱导模型组小鼠结肠组织黏膜受损,溃疡累及黏膜全层,黏膜下层水肿,炎细胞浸润,而HCT组由于药物干预,结果为较少形成溃疡,甚至没有出现炎症,见图2。

注:A为空白对照组; B为模型组;C为低剂量肠泰组;D为高剂量肠泰组; E为美沙拉嗪对照组;F为硫唑嘌呤对照组图2 各组小鼠结肠远端的组织病理结果(HE染色×200)
2.3各组小鼠结肠组织超微结构的观测结果与空白对照组相比,模型组小鼠结肠段超微结构可见部分微绒毛萎缩脱落,排列稀疏,紧密连接处稍有开放,细胞间隙扩大。高剂量组结肠微绒毛排列整齐,紧密连接处结构清晰无损坏,与空白对照组没有可见差异。该结果提示高剂量复方肠泰对小鼠肠黏膜屏障功能具有保护作用,见图3。

注:A为空白对照组; B为模型组;C为低剂量肠泰组;D为高剂量肠泰组; E为美沙拉嗪对照组;F为硫唑嘌呤对照组图3 各组小鼠结肠组织超微结构观察结果(TEM×5 000)
2.4紧密连接蛋白ZO-1,Occludin,Claudin-1的表达水平通过Western blot检测,可以得出结果,即DSS造成模型组小鼠肠道组织紧密连接蛋白受到较大破坏,紧密连接蛋白水平明显降低;相比空白对照组小鼠肠道组织紧密连接蛋白的高表达,HCT组小鼠无明显可见差异,见图4。

注:Control为空白对照组,Model为模型组,LCT为低剂量组,HCT为高剂量组,Mesalazine为美沙拉嗪对照组,Azathioprine为硫唑嘌呤对照组图4 各组小鼠结肠组织中ZO-1,Occludin,Claudin-1水平
2.5小鼠结肠组织中TNF-α、IL-6、IFN-γ、IL-10的表达水平DSS诱发UC小鼠后,模型组结肠匀浆液中促炎细胞因子TNF-α、IL-6、IFN-γ水平明显升高,与空白对照组相比差异有统计学意义(P<0.05)。HCT组经过药物干预后,这些细胞因子水平与模型组相比差异无统计学意义(P>0.05)。而对于抑炎细胞因子IL-10的水平,模型组和HCT组相比表现出升高趋势,但差异无统计学意义(P>0.05),见图5。

注:Control为空白对照组,Model为模型组,LCT为低剂量组,HCT为高剂量组,Mesalazine为美沙拉嗪对照组,Azathioprine为硫唑嘌呤对照组;A为TNF-α;B为IL-6;C为IFN-γ;D为IL-10。与空白对照组比较aP<0.05图5 各组小鼠结肠组织匀浆液中细胞因子检测水平
3讨论
正常情况下,肠道除具有消化吸收功能外,在预防肠源性感染方面也起着非常重要的作用,这主要是基于完整的肠道黏膜屏障功能。其可以选择性的转运离子、营养成分及其他有用物质,且有效阻止肠腔内细菌、毒素及炎性介质等的旁细胞渗透转运,维持机体的生理平衡[3-5]。研究认为UC易感基因和环境因素诱导肠黏膜屏障损坏,一旦肠黏膜屏障受损,黏膜下层暴露在大量抗原中,机体激活天然免疫反应如升高促炎细胞因子 TNF-α、IFN-γ等,这些炎性因子可明显损伤肠道屏障功能[6-7],使肠黏膜通透性增加,肠道内寄居的大量微生物及其代谢产物可引发或进一步恶化肠道炎症。无论从实验研究还是从临床病例来看,在各种肠道疾病中都能观察到肠屏障功能受损,肠道通透性增加[8-9]。因此可以判断肠道感染及炎症与UC发病过程密切相关。
UC已被世界卫生组织评为世界难治性疾病之一,并发症多,常易复发。目前临床治疗药物主要为氨基水杨酸类、糖皮质激素类和免疫抑制剂类,但是这些药物往往治标不治本[10]。中药安全性高,不良反应少,并以其多靶点多组分的特点在多病因的复杂慢性疾病中具有西药无法比拟的优势[11]。复方肠泰制剂的治疗作用前期已有研究证实[12],也已经进入临床研究阶段。该复方制剂由黄柏、地榆、地锦草、辣蓼共4味传统中药组成,黄柏性寒味苦,能清肠腑之热,燥肠中之湿,为君药;地榆味苦、酸,性微寒,清热凉血,泻火敛疮;地锦草性平味辛,清热解毒止泻,两者为臣药;辣蓼味辛性温,温中化湿,既可加强燥湿止泻之力,又可制约黄柏过于苦寒之弊,为佐使药。四药合用,具有清热燥湿、凉血解毒之效。现代医学研究表明,黄柏中的多种生物碱成分能够通过下调促炎细胞因子及其他炎症介质表达、抑制T细胞过度增殖活化等发挥抗炎、免疫调节作用[13-14];地榆、地锦草、辣蓼也分别具有抗病原微生物、抗炎、免疫调节作用[15-17]。
本实验采用中药复方肠泰制剂对UC小鼠发病进程进行有效控制,通过7 d一个完整的造模周期,观察发现HCT组的动物在体质量及疾病活动指数等指标上均强于模型组,证实复方肠泰制剂对UC小鼠的保护作用;通过常规HE染色观察到动物体内结肠组织的炎症状况,HCT组没有出现符合炎症的病理组织学改变,说明肠泰对炎症形成具有一定的抑制作用。同时从超微结构和蛋白免疫印迹发现HCT组紧密连接蛋白的水平没有出现大幅度改变,进一步说明复方肠泰制剂对UC小鼠肠黏膜屏障的修复能力。最后通过ELISA检测到细胞因子TNF-α、IFN-γ和IL-6的变化水平,从侧面反映复方肠泰制剂对UC发病的减轻和维护作用。
综上,本研究结果显示复方肠泰制剂对UC可有效预防,其机制可能通过修复受损的肠道屏障功能来抑制炎症,缓解炎症进程,启示可以从维护肠道黏膜屏障方面来深入研究UC发病机理。了解肠黏膜屏障在UC发病过程中的病理生理作用有助于发现新的治疗方法,也可为临床治疗UC提供参考。
[参考文献]
[1]Basso PJ, Fonseca MT, Bonfá G, et al. Association among genetic predisposition, gut microbiota, and host immune response in the etiopathogenesis of inflammatory bowel disease[J]. Braz J Med Biol Res, 2014, 47(9): 727-737.DOI:10.1590/1414-432.x2014932.
[2]Camilleri M, Madsen K, Spiller R, et al. Intestinal barrier function in health and gastrointestinal disease[J]. Neurogastroenterol Motil, 2012, 24(6): 503-12.DOI:10.1111/j.1365-2982.2012.01921.x.
[3]Sanchez de Medina F, Ortega-Gonzalez M, Gonzalez-Perez R, et al. Host-microbe interactions: the difficult yet peaceful coexistence of the microbiota and the intestinal mucosa[J]. Br J Nutr, 2013, 109(suppl 2): S12-S20.DOI:10.1017/s0007114512004035.
[4]Sánchez de Medina F, Romero-Calvo I, Mascaraque C, et al. Intestinal inflammation and mucosal barrier function[J]. Inflamm Bowel Dis, 2014, 20(12): 2394-2404.DOI:10.1097/MIB.0000000000000204.
[5]Knights D, Lassen KG, Xavier RJ. Advances in inflammatory bowel disease pathogenesis: linking host genetics and the microbiome [J]. Gut, 2013, 62(10): 1505-1510.DOI:10.1136/gutjnl-2012-303954.
[6]Alex P, Zachos NC, Nguyen T, et al. Distinct cytokine patterns identified from multiplex profiles of murine DSS and TNBS-induced colitis[J]. Inflamm Bowel Dis, 2009, 15(3): 341-352.DOI:10.1002/i6d.20753.
[7]Lee SH. Intestinal permeability regulation by tight junction: implication on inflammatory bowel diseases[J]. Intest Res, 2015, 13(1): 11-18.DOI:10.5217/ir.2015.13.1.11.
[8]Zhao H, Zhang H, Wu H, et al. Protective role of 1,25(OH)2 vitamin D3 in the mucosal injury and epithelial barrier disruption in DSS-induced acute colitis in mice[J]. BMC Gastroenterol, 2012, 12: 57.DOI:10.1186/1471-230x-12-57.
[9]Dorofeyev AE, Vasilenko IV, Rassokhina OA, et al. Mucosal barrier in ulcerative colitis and Crohn's disease[J]. Gastroenterol Res Pract, 2013, 2013: 431231.DOI:10.1155/2013/431231.
[10] de Boer NK, van Bodegraven AA, Jharap B, et al. Drug Insight: pharmacology and toxicity of thiopurine therapy in patients with IBD[J]. Nat Clin Pract Gastroenterol Hepatol, 2007, 4(12): 686-694.DOI:10.1038/ncpgasthep1000.
[11] Salaga M1, Zatorski H, Sobczak M, et al. Chinese herbal medicines in the treatment of IBD and colorectal cancer: a review[J]. Curr Treat Options Oncol, 2014, 15(3): 405-420.DOI:10.1007/s11864-014-0288-2.
[12] Liu BG1, Jia XM, Cao YY, et al. Changtai granule, a traditional Chinese drug, protects hapten-induced colitis by attenuating inflammatory and immune dysfunctions[J]. J Ethnopharmacol, 2008, 115(1): 1-8.DOI:10.1016/j.jep.2007.08.045.
[13] Kawano M, Takagi R, Kaneko A, et al. Berberine is a dopamine D1- and D2-like receptor antagonist and ameliorates experimentally induced colitis by suppressing innate and adaptive immune responses[J]. J Neuroimmunol, 2015, 289: 43-55.DOI:10.1016/j.jneuroim.
[14] Yan F, Wang L, Shi Y, et al. Berberine promotes recovery of colitis and inhibits inflammatory responses in colonic macrophages and epithelial cells in DSS-treated mice[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 302(5): G504-514.DOI:10.1152/ajpgi.00312.2011.
[15] Jo S, Ryu J, Kim H, et al. Anti-inflammatory effects of Sanguisorbae Radix on contact dermatitis induced by dinitrofluorobenzene in mice[J]. Chin J Integr Med, 2015, 11(1):37-39.DOI:10.1007/s11655-015-2148-8.
[16] Luyen BT, Tai BH, Thao NP, et al. Anti-inflammatory components of Euphorbia humifusa Willd[J]. Bioorg Med Chem Lett, 2014, 24(8): 1895-1900.DOI:10.1016/j.6mll.2014.03.014.
[17] Mazid MA, Datta BK, Nahar L, et al. Analgesic and diuretic properties of alpha-santalone from Polygonum flaccidum[J]. Phytother Res. 2010, 24(7): 1084-1087.DOI:10.1002/ptr.3053.
(本文编辑:张阵阵)
Protective effect of compound Changtai on the intestinal mucosal barrier in the treatment of ulcerative colitis in rats
He Lijuan, Zhang Jundong, An Maomao, Jiang Yuanying
(New Drug Research and Development Center, School of Pharmacy, Second Military Medical University,Shanghai 200433, China)
[Abstract]ObjectiveTo verify the protective effect of compound Changtai on the intestinal mucosal barrier in the treatment of ulcerative colitis (UC), and also to explore the possible mechanism involved.Methods The animal model of ulcerative colitis induced by dextran sodium sulfate (DSS) was established as a first step. The experimental animals were divided into 6 groups, i.e. the blank control group, the model group, the compound Changtai treatment groups with two different dosages (4.3 g/kg, 17.1g/kg), the mesalazine and azathioprine control groups. Seven days after the development of the model, changes in body weight and disease activity index (DAI) were observed and recorded. Colon ultrastructures in the animals of various groups were closely observed by transmission electron microscopy; inflammation in the animals of various groups was observed by HE staining; the levels of TNF-α, IL-6, IFN-γ and IL-10 in the colon of various animal groups were detected by ELISA; and the expression levels of ZO-1, Occludin and Claudin-1 in the colon of various groups were detected by Western blot.ResultsSignificant differences could be seen in the body weight, DAI, colon length in the animals of the model group, as compared with those of the control group(P<0.05). The levels of TNF-α,IL-6 and IFN-γ in the colon were significantly decreased(P<0.05), and the expression levels of Occludin, Claudin-1 and ZO-1 were also significantly decrease(P<0.05). Histopathological detection indicated that inflammatory infiltration was evident. Transmission electron microscopy detection showed a damaged opening dot in the tight junction protein in the colon of the model group. No significant differences could be noted, when comparisons were made between the high dosage Changtai group and the blank control group(P<0.05).ConclusionThe high dosage compound Changtai seemed to have certain protective effect on the intestinal mucosal barrier, the possible mechanism involved might be related with the increased expression level of the tight junction protein and the regulation of intestinal immune function.
[Key words]Ulcerative colitis; Tight junction protein; Intestinal barrier function
(收稿日期:2016-02-02)
[中图分类号]R735.2
[文献标识码]A[DOI]10.3969/j.issn.1009-0754.2016.02.007
[通信作者]姜远英,电子信箱:13761571578@163.com
[基金项目]国家自然科学基金项目(81274164)
·论著·
[作者单位]200433上海,第二军医大学药学院新药研究中心(何丽娟、姜远英);同济大学附属第十人民医院(张军东);同济大学医学院(安毛毛)
