食品中10种色素的高效液相色谱同时检测方法
2016-05-22李小云赵喜玲宋丹萍
李小云, 赵喜玲, 李 琪, 宋丹萍, 曾 慧, 张 宏,*
( 1. 四川师范大学 化学与材料科学学院, 四川 成都 610066; 2. 四川师范大学 生命科学学院, 四川 成都 610101; 3. 四川师范大学 植物资源开发与应用研究所, 四川 成都 610101; 4. 四川省眉山市动物疾病控制中心, 四川 眉山 620010)
食品中10种色素的高效液相色谱同时检测方法
李小云1, 赵喜玲1, 李 琪2,3, 宋丹萍4, 曾 慧2, 张 宏1,2*
( 1. 四川师范大学 化学与材料科学学院, 四川 成都 610066; 2. 四川师范大学 生命科学学院, 四川 成都 610101; 3. 四川师范大学 植物资源开发与应用研究所, 四川 成都 610101; 4. 四川省眉山市动物疾病控制中心, 四川 眉山 620010)
采用高效液相色谱法建立食品中10种黄色色素的检测方法.甲醇作为溶剂对饮料、糖果、糕点3类样品进行提取,甲醇(A)-0.02 mol/L乙酸铵溶液(B)-乙腈(C)为流动相,Macherey-Nagel C18色谱柱(4.6 mm×250 mm,5 μm)为固定相,柱温25 ℃,流速1.0 mL/min,波长435 nm,进样量20 μL.结果显示,10种色素的线性范围为0.25~160.0 μg/mL,饮料、糖果、糕点样品中各色素的加标回收率分别在88.0%~103.6%、88.0%~98.3%、81.4%~106.7%之间.该方法重现性好,灵敏度和准确度高,适用于食品中该10种黄色色素的分析.
食用色素; 非食用色素; 高效液相色谱
在食品加工业中通常加入各种色素以提高食品的色泽,增加食欲.色素按其用途可分为食用色素和非食用色素.大部分食品中使用较多的是黄色色素.色素使用过程中添加过量、违规添加等现象时有发生,某些色素过量摄入会危害健康[1].因此,食品中色素的分析测定显得尤为重要.
色素的检测方法主要是液相色谱法[2-4]以及液相色谱-质谱联用(LC-MS)[5-6].N. Yoshioka等[7]报道了食品中合成色素的检测方法,其中大部分为非食用色素.目前检测食品中合成色素的国家标准,基本以聚酰胺吸附法为样品前处理方法[8-9],而非食用色素的检测尚未有较为全面的国家标准.由于国家标准方法《食品中禁用物质的检测——碱性橙染料》[10]仅规定了碱性橙Ⅱ、碱性橙21、碱性橙22的分析测定;因此,针对非食用色素的分析检测还不完善.文献报道的色素处理方法较为繁杂,而能将样品前处理简单化,并且能同时检测含有天然色素、合成色素和非食用黄色色素的液相色谱方法研究较少.本文将允许添加的合成黄色色素柠檬黄、日落黄以及喹啉黄、天然色素姜黄素和非食用色素酸性间胺黄、碱性嫩黄O、碱性橙2、碱性橙21、碱性橙22、酸性橙Ⅱ等10种黄色色素作为研究对象,建立一种能同时检测多种色素的高效液相色谱法.
1 实验部分
1.1 试剂与仪器 柠檬黄(CAS:1934-21-0)、日落黄(CAS:2783-94-0)、酸性间胺黄(CAS:587-98-4)均购于AccuStandard公司,喹啉黄(CAS:8004-92-0)、姜黄素(CAS:458-37-7)、酸性橙Ⅱ(CAS:633-96-5)、碱性嫩黄O(CAS:2465-27-2)均购于Dr.Ehrenstorfer GmbH公司,碱性橙2(CAS:532-82-1)、碱性橙21(CAS:3056-93-7)、碱性橙22(CAS:4657-00-5)购于北京振翔工贸有限公司,甲醇、乙腈(均为色谱纯)购于美国BRC公司,其余试剂(分析纯)购于科密欧试剂有限公司.
PDA-100液相色谱仪(美国戴安公司),Direct-Q 5型超纯水仪(美国Millipore公司),Buchi R-3型旋转蒸发仪(上海亚荣生化仪器厂),BP211D型十万分之一电子天平(德国赛多利斯公司).
1.2 色谱条件 色谱柱:Macherey-Nagel C18柱(4.6 mm×250 mm,5 μm);进样量:20 μL;柱温:25 ℃;流速:1.0 mL/min;检测波长:435 nm;流动相:甲醇(A)、0.02 mol/L乙酸铵溶液(B)、乙腈(C);各流动相梯度洗脱的体积分数见表1.
1.3 实验方法
1.3.1 标准品溶液制备 准确称取各色素标准品50.0 mg于25 mL容量瓶中,甲醇溶解并定容,作为质量浓度为2.0 mg/mL的各单色素标准储备液,待用.取各单标色素的标准储备液4 mL至50 mL容量瓶,甲醇定容,得到质量浓度160 μg/mL混合储备液,待用.
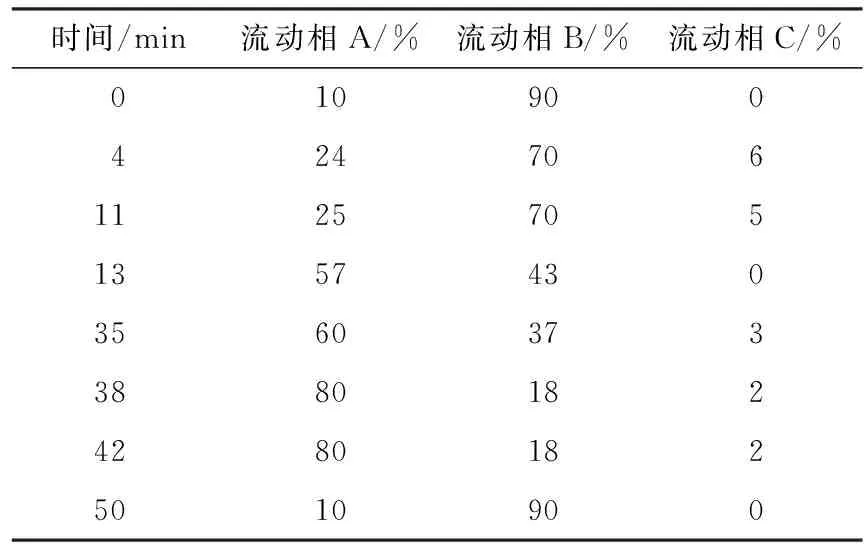
表 1 各流动相梯度洗脱的体积分数
1.3.2 样品溶液制备 称取饮料样品20.0 g,旋至近干,加入20 mL甲醇,超声20 min,离心15 min,取上层清液旋蒸至近干,甲醇定容至10 mL,溶液过0.45 μm滤膜,待测.
糖果样品称取2.5 g,超纯水加热溶解后,加入10 mL甲醇,超声30 min,离心15 min,取上层清液,剩余残渣重复上述操作1次,合并2次提取液旋蒸至近干,甲醇定容至20 mL,溶液过0.45 μm滤膜,待测.
糕点、冰淇淋样品称取2.5 g,先加入10 mL石油醚,充分搅拌后倒出溶液,再向残渣加入5 mL石油醚,搅拌后除去油脂干燥.再向样品中加入30 mL甲醇,超声20 min,离心15 min,取上层清液,剩余残渣重复上述操作2次,合并3次提取液旋蒸至近干,甲醇定容至10 mL,溶液过0.45 μm滤膜,待测.
1.3.3 线性范围的建立 取一定体积的混标储备液分别配制成质量浓度为0.25、0.5、1.0、5.0、10.0、20.0、40.0、60.0、100.0、160.0 μg/mL的混合标准液,在1.2色谱条件下进行分别测定.
1.3.4 精密度的考察 分别取0.25、10和100 μg/mL低、中、高3个质量浓度混合标准溶液按1.2项下色谱条件连续平行测定6次.
1.3.5 稳定性的考察 饮料、糖果和糕点样品各取1份,分别加入低质量浓度0.25 μg/mL混标液,样品按1.3.2项方法处理后,按1.2所述色谱条件分别在0、6、12、24和48 h进样分析.
1.3.6 重现性的考察 各取饮料、糖果和糕点样品6份,分别加入质量浓度0.25 μg/mL的混合标液,按1.3.2项方法制备样品溶液,按1.2项色谱条件进行分析,测定峰面积,计算出10种色素的质量浓度及RSD值.
1.3.7 回收率的测定 分别称取9份饮料样品20.0 g、糖果样品2.5 g和糕点样品2.5 g,根据1.3.2项样品处理,饮料、糖果和糕点样品中添加0.25、10和40 μg/mL的低、中、高3个质量浓度的混合标准工作液.按1.2项色谱条件测定,计算9次的平均回收率.
1.4 样品的测定 分别准确称取2.50 g的糖果和糕点样品,称取20.0 g饮料样品.按1.3.2所述的前处理方法和1.2所述色谱条件对样品进行提取和色谱分析.
2 结果与讨论
2.1 色谱条件的确定
2.1.1 检测波长的选择 分别对10种色素在波长190~800 nm范围内采集紫外光谱图,其中日落黄、酸性橙Ⅱ、碱性橙21、碱性橙22等4种色素的最大吸收波长在490 nm左右,同时在430 nm左右也都有一定的紫外吸收,其余6种色素的最大吸收波长均在430 nm左右,综合各种色素的最大吸收波长,最后选择435 nm作为检测波长,在此波长下每个色素均能被检测.
2.1.2 流动相的选择 试验选择比较了甲醇-水体系、甲醇-缓冲盐体系共5种溶液.结果发现:流动相仅使用甲醇-水溶液时,10种色素很难完全分离;使用甲醇-乙酸铵溶液作为流动相时,10种色素能实现基本分离;但碱性橙21、酸性橙Ⅱ和碱性橙2等3种色素保留时间较接近.当加入少量乙腈时,分离效果更好,碱性橙21和酸性橙Ⅱ能实现完全分离.故选择甲醇-乙腈-0.02 mol/L乙酸铵溶液组成流动相体系.
2.1.3 pH的选择 试验分别比较了10种色素在pH=5.0、7.1、5.8时的分离情况.结果表明:在pH=5.8时,10种组分分离效果较理想;在pH=5.0时,日落黄、柠檬黄不能被很好地洗脱下来,部分色谱峰完全重叠;在pH=7.1时,喹啉黄与杂质峰完全重叠,碱性嫩黄O与碱性橙21、碱性橙21与酸性橙Ⅱ、碱性橙22与姜黄素不能达到完全分离.故选取pH=5.8的0.02 mol/L乙酸铵溶液.
2.1.4 流速的选择 试验分别考察流速为0.8、1.0、1.2 mL/min时10种混合标准物质的出峰情况.当流速为0.8 mL/min时,碱性橙21和酸性橙Ⅱ之间未能实现完全分离;流速为1.0 mL/min时,各组分之间均能实现完全分离,且分离度大于1.5;流速为1.2 mL/min时,碱性橙21和酸性橙Ⅱ分离度未达到1.5以上.综合考虑最终确定流速为1.0 mL/min.
2.1.5 柱温的选择 本试验分别考察了20、25、30 ℃对10种色素分离情况的影响.结果表明:柱温在20 ℃时酸性橙Ⅱ和碱性橙2分离度未能达到1.5以上.柱温为25 ℃时,各组分均能实现完全分离,分离度在1.6以上.柱温在30 ℃时,碱性橙21与酸性橙Ⅱ色谱峰完全重叠,碱性橙2包含杂质峰.综合考虑选择最适宜的柱温为25 ℃.
2.2 方法学的验证
2.2.1 线性范围的建立 在选定的最佳条件下,10种色素的线性范围、线性方程、相关系数、检出限(S/N=3)、定量限(S/N=10)见表2.该10种色素在质量浓度0.25~160 μg/mL范围内线性关系良好.
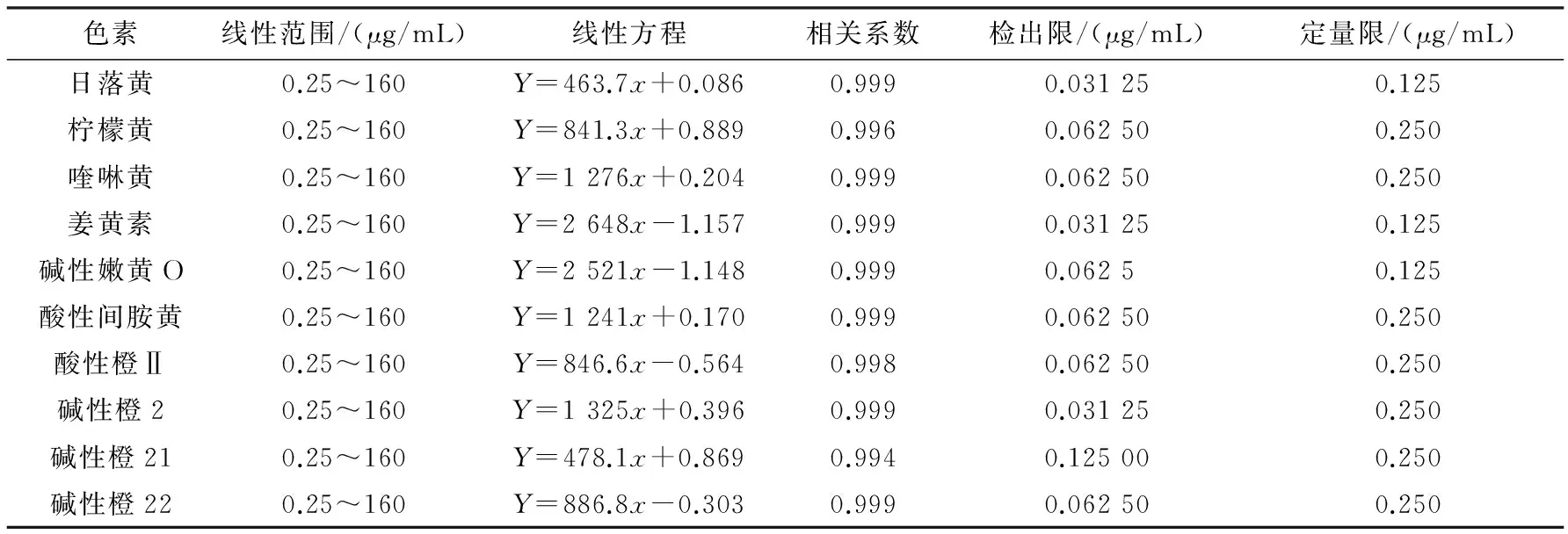
表 2 10种色素的线性范围、线性方程、相关系数和检出限(n=3)
2.2.2 精密度 10种色素的标准溶液在1.2色谱条件下测定峰面积,计算RSD值,10种色素的RSD值均小于5%;结果表明精密度良好.
2.2.3 稳定性 按1.2所述色谱条件分别在0、6、12、24、48 h进样分析.结果表明:饮料、糖果和糕点样品中色素的质量浓度随时间无明显变化,表明样品在48 h内稳定性良好.
2.2.4 重复性 按1.2所述色谱条件进行分析,饮料、糖果和糕点样品中色素的RSD值在1.5%~4.9%范围内(n=6),结果表明本实验方法重复性良好.
2.2.5 回收率的测定 按1.2项色谱条件平行测定3次,计算各样品的回收率.饮料、糖果、糕点样品中各色素的加标回收率分别在88.0%~103.6%、88.0%~98.3%、81.4%~106.7%之间.结果表明本实验方法数据准确,此方法可行.
2.3 样品处理方法的确定
2.3.1 提取溶剂的选择 试验选取了甲醇、甲醇-丙酮、乙腈-正己烷、乙醇-氨水-水(质量浓度比为:80∶1∶19,下同)4种提取溶剂作为比较.考察加入混标的饮料样品均能提取出色素.其中甲醇和乙醇-氨水-水的提取效果比甲醇-丙酮、乙腈-正己烷好,样品经测定后发现甲醇溶剂能把10种色素全部提取出来,并且杂峰少;乙醇-氨水-水溶剂提取出的色素在柠檬黄的保留时间处有干扰峰.
考察含有混标的糖果样品,甲醇和乙醇-氨水-水溶剂提取效果较为理想,其中甲醇提取的10种色素能实现较好的分离.乙醇-氨水-水提取的色素,未检测到姜黄素,且酸性橙Ⅱ和碱性橙的峰重叠.
考察加入混标的糕点样品时,甲醇和甲醇-丙酮溶剂提取后,溶液澄清,经检测甲醇-丙酮提取溶剂的提取效果比甲醇溶剂的提取效果稍差.综合考虑,本实验选取甲醇作为饮料、糖果、糕点样品的提取溶剂.
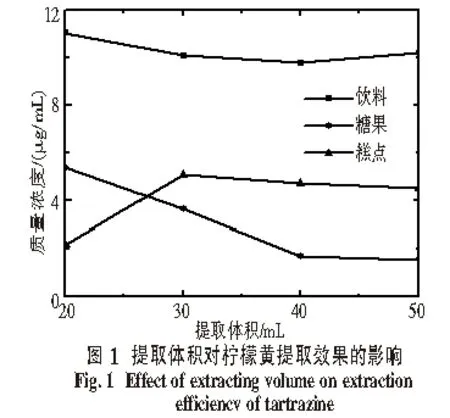
2.3.2 提取体积的考察 实验以甲醇为提取溶剂,当饮料样品提取体积为20 mL时,提取的柠檬黄质量浓度最高.提取体积逐渐增大时,其质量浓度有所降低.糖果样品中柠檬黄的提取量随提取体积的增加呈下降趋势.糕点样品在提取体积增加到30 mL时,提取效果明显增加;继续增大提取体积时,提取结果有所下降.综合考虑,饮料、糖果样品的提取体积为20 mL,糕点样品的提取体积为30 mL,结果见图1.
2.3.3 提取次数的考察 实验分别考察了1~4次不同提取次数对添加有柠檬黄色素的饮料、糖果和糕点3种样品提取效果的影响,结果见图2.结果表明饮料样品的提取效果随提取次数增加呈小幅下降.糖果样品分别提取2和3次,提取的柠檬黄质量浓度基本一致,当增加到提取4次后,柠檬黄质量浓度降低;糕点样品随着提取次数增加呈上升状态,当提取次数达到3次以上,柠檬黄质量浓度不再增加.故饮料样品提取1次,糖果样品提取2次,糕点样品提取3次.

2.3.4 提取时间的考察 实验考察了10、20、30和40 min不同提取时间对添加有柠檬黄色素的饮料、糖果和糕点样品提取效果的影响,结果见图3.当饮料和糕点样品提取时间为20 min时,柠檬黄质量浓度达到最大值,此后随时间的增加而减小.糖果样品中柠檬黄质量浓度随提取时间的增加呈先增大后减小的趋势,当提取时间为30 min时柠檬黄达到最大值.因此,确定饮料和糕点样品的提取时间为20 min,糖果样品为30 min.

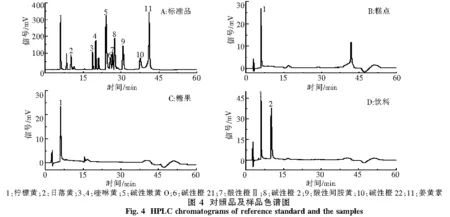
2.4 样品测定及结果 在最佳实验条件下,对样品进行分析测定,实验结果见图4.饮料、糖果、糕点样品检测结果表明,碳酸饮料基本都含有柠檬黄和日落黄色素中的1种或2种,小部分果蔬汁饮料检测含有少量柠檬黄或日落黄.绝大多数糖果含有柠檬黄,糕点样品的馅儿料中多添加有柠檬黄或日落黄2种人工合成色素,样品中均未检测到超标或违法添加非食用色素的产品.
3 讨论
本文在实验中选用Kromasil C18柱、Macherey-Nagel C18色谱柱进行比较.2种色谱柱初始时都能对10种色素实现良好地分离,但Kromasil C18色谱柱使用一段时间后柱效明显下降,而Macherey-Nagel C18色谱柱则表现出良好的性能,并且各色素之间的分离度良好,故选择Macherey-Nagel C18色谱柱.
[1] 宋丹萍,张宏,李琪. 国内外食用色素标准的比较及检测方法的研究进展[J]. 食品科学,2014,35(3):295-300.
[2] 范文锐,吴青,劳扬,等. 高效液相色谱法同时测定食品中7种非食用色素[J]. 分析化学,2012,40(2):292-297.
[3] 张婉,王覃,杜宇,等. 超高效液相色谱法同时测定饮料中5种人工合成色素[J]. 食品科学,2011,32(4):177-180.
[4] 杨琳,陈青俊,丁献荣,等. 反相高效液相色谱法测定食品中的多种黄色工业染料[J]. 食品工业科技,2011,32(2):350-352.
[5] FENG F, ZHAO Y S, YONG W, et al. Highly sensitive and accu-rate screening of 40 dyes in soft drinks by liquid chromatogram-phyelectrospray tandem mass spectrometry[J]. J Chromatography,2011,B879(20):1813-1818.
[6] 沈磊. 高效液相色谱-串联质谱测定食品中工业色素的研究[D]. 石家庄:河北科技大学,2013.
[7] YOSHIOKA N, ICHIHASHI K. Determination of 40 synthetic food colors in drinks and candies by high-performance liquid chromatography using a short column with photodiode array detection[J]. Talanta,2008,74(5):1408-1413.
[8] 食品中合成着色剂的测定:GBT 5009.35—2003[S]. 北京:中国标准出版社,2003.
[9] 刘艳琴,王浩,杨红梅,等. 固定相萃取-HPLC法同时测定糕点中8种人工色素[J]. 食品研究与开发,2010,31(2):139-142.
[10] 食品中禁用物质的检测-碱性橙染料高效液相色谱法:GB/T 23496—2009[S]. 北京:中国标准出版社,2009.
(编辑 余 毅)
Simultaneous Determination of 10 Pigments in Food Samples by HPLC
LI Xiaoyun1, ZHAO Xiling1, LI Qi2,3, SONG Danping4, ZENG Hui2, ZHANG Hong1,2
( 1. College of Chemistry and Materials Science, Sichuan Normal University, Chengdu 610066, Sichuan; 2. College of Life Science, Sichuan Normal University, Chengdu 610101, Sichuan; 3. Development and Application Institute of Plant Resources, Sichuan Normal University, Chengdu 610101, Sichuan; 4. Meishan Center for Animal Disease Prevention and Control, Meishan 620010, Sichuan)
To establish a method for simultaneous determination 10 kinds of yellow pigments in food with high performance liquid chromatography (HPLC). The pigments were extracted with methanol from drinks, candy and cake samples. The HPLC detection conditons were methanol (A), 0.02 mol/L ammonium acetate solution (B), acetonitrile (C) as the mobile phase gradient, Macherey-Nagel C18 column (4.6 mm×250 mm, 5 μm) as the stationary phase, column temperature 25 ℃, the flow rate 1.0 mL/min, detection wavelength 435 nm, injection volume 20 μL. The linear range of 10 kinds of pigment were 0.25~160.0 μg/mL, and the recoveries in drinks, candy, cakes samples were 88.0%~103.6%, 88.0%~98.3%, 81.4%~106.7%. This method showed good reproducibility, sensitivity and accuracy and it could be applied for determination of 10 kinds of yellow pigments in food.
food coloring; non-food coloring; HPLC
2016-01-03
四川省教育厅青年基金(2006B035)和四川省攀枝花市科技局重点项目(2008CY-S-1)
O657.72
A
1001-8395(2016)06-0895-05
10.3969/j.issn.1001-8395.2016.06.022
*通信作者简介:张 宏(1965—),女,教授,主要从事天然产物开发与应用的研究,E-mail:Zhanghong651@aliyun.com
