加拿大蓬挥发油对Hela细胞的体外抗肿瘤活性初探
2016-05-22杜润元马丹炜朱晓换王亚男
杜润元, 廖 颖, 马丹炜, 朱晓换, 王亚男
(四川师范大学 生命科学学院, 四川 成都 610101)
加拿大蓬挥发油对Hela细胞的体外抗肿瘤活性初探
杜润元, 廖 颖*, 马丹炜, 朱晓换, 王亚男
(四川师范大学 生命科学学院, 四川 成都 610101)
为了探讨加拿大蓬挥发油的体外抗肿瘤活性,采用MTT比色法探究挥发油对人宫颈癌Hela细胞的抑制作用,并采用AO/EB染色法观察Hela细胞在挥发油作用下的形态变化.结果表明:加拿大蓬挥发油对Hela细胞生长具有抑制作用,细胞活力随着处理浓度的升高和处理时间的延长而降低,其中处理8、24和48 h的IC50分别是22.72、18.06和6.78 mg/L,在加入泛caspase抑制剂(Z-VAD-FMK)后,这种抑制作用得到缓解,24 h的IC50上升至29.9 mg/L,表明该挥发油可能激活了Hela细胞中的caspase蛋白酶活性.AO/EB染色观察发现,加拿大蓬挥发油处理Hela细胞后使其呈现典型凋亡形态的特征.由此推断,加拿大蓬挥发油可能是通过诱导Hela细胞的凋亡来抑制细胞增殖.
加拿大蓬; 挥发油; Hela细胞; 增殖抑制作用; 细胞凋亡
含有挥发油成分的植物资源在自然界中分布广泛,已经发现许多植物挥发油具有显著的抗肿瘤活性,它们能通过各种不同的作用机制抑制癌细胞生长[1-2],因此以挥发油为研究对象,将其开发为抗癌药物具有巨大市场前景和理论意义.随着人们对癌症研究的深入和对抗癌药物的开发,许多来源于植物的抗肿瘤有效成分相继被发现,挥发油也成为目前抗肿瘤药物研究的热点.经过一些学者的前期研究,右旋柠檬烯(d-limonene)正在进行临床Ⅰ期实验[3],紫苏醇(Perillyl alcohol)也到了临床Ⅱ期的研究阶段[4].β-榄香烯(β-elemene)在我国已研发为二类抗肿瘤新药——榄香烯乳注射液,目前已广泛用于治疗食道癌、肺癌、脑肿瘤以及其他各类癌症[5].加拿大蓬(ErigeronCanadensisL.),别名小飞蓬草、白酒草,一年生草本植物,菊科白酒草属,原产于北美,具备极强的竞争优势和入侵性[6],已大面积入侵我国多个省市[7].加拿大蓬挥发油具有多种生物活性,如具有明显的抗炎抗虫、杀菌抗病毒、抗凝血等效果[8].加拿大蓬由于具有较强的入侵性而在我国广泛分布,资源丰富,如能开发其药用价值而为人类所用,在一定程度上可控制其进一步蔓延,起到趋利避害的作用.本研究以加拿大蓬挥发油为材料,旨在初步探索其抑制离体培养宫颈癌Hela细胞增殖效果及可能的机制,为加拿大蓬开发利用提供依据.
1 材料与方法
1.1 实验材料 受试植株加拿大蓬采自于成都市龙泉驿区;人宫颈癌Hela细胞由四川大学华西医院提供;改良型1640培养基(赛默飞世尔生化制品有限公司);新生牛血清(天杭生物科技有限公司);胰蛋白酶消化液(成都哈里生物公司);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT,Biosharp生物公司);二甲基亚砜(DMSO,Amresco生化公司);泛caspase抑制剂(Z-VAD-FMK,Eyotime Biotechnology公司);氟尿嘧啶(5-Fluorouracil,中国食品药品检定研究院);吖啶橙/溴化乙锭(AO/EB,Biosharp生物公司).
1.2 实验方法
1.2.1 挥发油的提取 加拿大蓬挥发油采用水蒸气蒸馏法提取,把整株加拿大蓬切成小段,放于挥发油提取器加热,蒸汽冷凝回流,收集挥发油,用无水Na2SO4过滤除水,置于-20 ℃保存备用.
1.2.2 细胞培养 Hela细胞用含10%小牛血清、1%青链霉素混合液的1640培养基,于37 ℃、饱和湿度细胞培养箱培养,每2 d传代一次,细胞处于对数期时进行相关实验.
1.2.3 MTT法检测细胞活力 胰酶消化Hela细胞后离心,稀释细胞浓度至5×104个/mL,按每孔100 μL接种于96孔板,放于培养箱中孵育过夜,细胞贴壁后,处理组加入经DMSO稀释为不同浓度的加拿大蓬挥发油2 μL,每孔补加98 μL培养基,使挥发油的最终质量浓度分别为0(溶剂对照)、12.5、25、50、100 mg/L;阳性对照组加入2 μL氟尿嘧啶(FU,终浓度80 mg/L)补加98 μL培养基;空白对照加入100 μL 1640培养基,调零组加入200 μL不含细胞的培养基;每实验组均设5个重复.分别继续培养8、24和48 h后,每孔加入20 μL 5 g/L的MTT试剂(调零组不加MTT),继续培养4 h;小心吸除培养基,每孔加入150 μL DMSO,置于多功能酶标仪内,震荡5 min,调零孔调零后,在490 nm下测吸光度值(OD值).按公式:细胞活力%=(OD处理组/OD溶剂对照组)×100%,计算细胞活力,实验重复3次.以挥发油浓度作为横坐标,细胞活力作为纵坐标,作线性回归曲线,根据拟合公式计算半抑制浓度IC50.
1.2.4 泛caspase抑制剂对挥发油抑制效果的影响 按1.2.3实验方法接种细胞,细胞贴壁后,除调零组外,每孔加入泛caspase抑制剂 (Z-VAD-FMK)30 μm于CO2培养箱中孵育30 min后,再加入不同浓度加拿大蓬挥发油,每孔补加培养基98 μL,使挥发油的终质量浓度分别为0(溶剂对照)、12.5、25、50和100 mg/L;阳性对照、空白对照均按1.2.3方法设定,测定OD值后,计算细胞的活力.
1.2.5 AO/EB荧光染色观察细胞凋亡的形态 细胞培养至对数生长期,用胰酶消化离心,稀释细胞至1×105个/mL,取2 mL细胞悬液接种于6孔板,培养过夜,细胞贴壁后,实验组加入不同浓度的加拿大蓬挥发油溶液,使其最终质量浓度分别为0(溶剂对照)、12.5、25、50和100 mg/L;阳性对照组加入FU(80 mg/L).培养24 h后,胰酶消化后收集全部细胞,用PBS洗涤后离心倒弃PBS,再加100 μL PBS制成细胞悬液,加入2 μL AO/EB染液,充分混匀,染色2 min,取10 μL滴在载玻片上,轻盖盖玻片,镜检拍照.

2 结果与分析
2.1 加拿大蓬挥发油对Hela细胞生长活力的影响 Hela细胞经不同浓度加拿大蓬挥发油处理不同时间后,细胞活力通过MTT法测定,溶剂对照组细胞活力为100%,以质量浓度80 mg/L FU处理Hela细胞作为阳性对照,与溶剂对照组相比,所有实验组均有显著性差异(P<0.05).如图1所示,加拿大蓬挥发油对体外培养Hela细胞具有显著的抑制细胞增殖作用,且随着处理浓度的增加和处理时间的延长,Hela细胞生长活力逐渐降低.8、24和48 h 处理组的IC50质量浓度分别为22.72、18.06和6.78 mg/L.

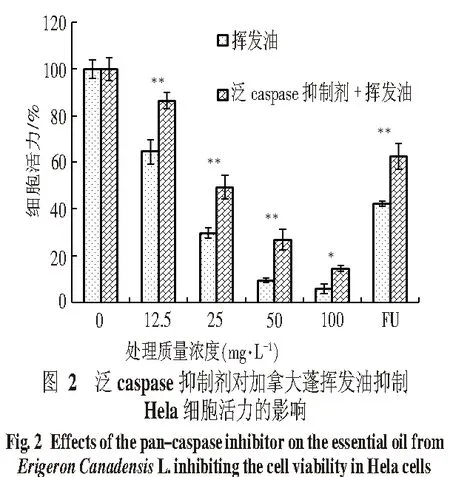
2.2 泛caspase抑制剂对加拿大蓬挥发油抑瘤活性的影响 未经泛caspase抑制剂(Z-VAD-FMK)预处理和经泛caspase抑制剂预处理的Hela细胞,用不同浓度加拿大蓬挥发油处理24 h后,细胞活力通过MTT法测定,结果如图2所示,在各浓度处理组中,未加泛caspase抑制剂与加泛caspase抑制剂相比,细胞活力均有显著差异,*表示P<0.05,**表示P<0.01.经泛caspase抑制剂处理,质量浓度12.5 mg/L挥发油处理Hela细胞24 h后,细胞活力从66.44%上升到86.38%;其他质量浓度处理其细胞活力从29.5%、9.31%、5.63%分别上升到49.17%、26.68%、14.27%(P<0.05).经过泛caspase抑制剂处理后,加拿大蓬挥发油对Hela细胞的抑制效果明显降低.说明泛caspase抑制剂能明显缓解加拿大蓬挥发油对Hela细胞的抑制,加拿大蓬挥发油可能诱导了Hela细胞凋亡从而发挥抑制细胞生长的作用.
2.3 加拿大蓬挥发油对Hela细胞形态的影响 图3中,A、B、C、D挥发油处理质量浓度分别为0、12.5、50、100 mg/L,处理时间为8 h;F、G、H、I挥发油处理质量浓度分别为0、12.5、50、100 mg/L,处理时间为24 h;K、L、M、N挥发油处理质量浓度分别为0、12.5、50、100 mg/L,处理时间为48 h;E、J、O质量浓度分别为80 mg/L FU处理8、24、48 h.图3中箭头表示凋亡小体.如图3所示,加拿大蓬挥发油处理Hela细胞8、24、48 h,经AO/EB着色后,对照组全为着色均匀、圆形或椭圆形的活细胞(图3A、F、K);12.5 mg/L处理组出现着色不均匀的早期凋亡细胞,细胞核皱缩、核内见明亮斑点,并出现凋亡小体(图3B、G、L);50 mg/L处理细胞核进一步固缩,染色质皱缩裂解,凋亡小体数升高(图3C、H、M);100 mg/L处理组几乎全为晚期凋亡细胞,细胞核畸变、碎裂(图3D、I、N).随着挥发油处理浓度升高和处理时间增加,正常Hela细胞减少,凋亡细胞增多.
3 讨论
许多植物的挥发油对癌细胞增长有明显的抑制效果.如莪术[Curcuma(zedoaria) Christm Rosc.]挥发油及其3种成分能显著抑制子宫内膜癌细胞和肝癌细胞的增长[9];姜黄(CurcumalongaL.)挥发油能抑制人白血病细胞HL260和人肝癌细胞HepG2的增长[10],本研究结果表明,加拿大蓬挥发油对Hela细胞的增殖有明显的抑制效应,随着挥发油浓度增高和处理时间延长,这种抑制效应明显增强,表现出明显的浓度和时间双重效应,其处理8、24、48 h的IC50分别为22.72、18.06和6.78 mg/L.与李美[11]对野胡萝卜(DaucuscarotaL.)挥发油处理人宫颈癌Hela细胞6、12、24 h的IC50质量浓度183.88、108.22、99.58 mg/L相比,加拿大蓬挥发油对体外培养Hela细胞的抑制效果优于野胡萝卜挥发油.与阳性对照FU相比,加拿大蓬挥发油对Hela细胞的抑制效果更强.由此可见,加拿大蓬挥发油中具有抗肿瘤活性物质.根据杨莉[12]对加拿大蓬挥发油成分分析表明,柠檬烯的含量超过一半,柠檬烯对肿瘤细胞具有显著的抑制效应,临床上已经进入Ⅰ期试验[3],本研究中加拿大飞蓬挥发油所表现出的对Hela细胞增殖的抑制作用是否是因其含有柠檬烯还有待进一步探索.

细胞凋亡是细胞在受到外界刺激后,由特定基因控制和一系列蛋白参与的主动死亡过程,主要表现为细胞核固缩碎裂,染色质凝聚,出现凋亡小体[13].在细胞凋亡过程中,天冬氨酸特异的半胱氨酸蛋白酶(caspase)起重要作用[14].Z-VAD-FMK能阻断凋亡,是一种能透过细胞膜不可逆转的泛caspase抑制剂[15].本研究表明Z-VAD-FMK预处理能有效降低加拿大蓬挥发油对Hela细胞增殖的抑制作用,由此推测加拿大蓬挥发油对细胞增长的抑制作用可能是通过激活caspase蛋白酶,从而引起细胞凋亡.AO/EB双染结果表明,Hela细胞经加拿大蓬挥发油处理后,细胞皱缩、染色加深、并出现凋亡小体,随着处理质量浓度的增加,晚期凋亡细胞数增加.
由此可见,加拿大蓬挥发油可能是通过诱导细胞凋亡来抑制人宫颈癌Hela细胞增长.由于加拿大蓬挥发油是混合物,在后续的实验中,本研究室将对其抗肿瘤主效成分及其抗肿瘤机制进行深入研究.
[1] SOEUR J, MARROT L,PEREZ P, et al. Selective cytotoxicity of Aniba rosaeodora essential oil towards epidermoid cancer cells through induction of apoptosis[J]. Mutation Research,2011,718(1/2):24.
[2] SHARMA M, AARAWAL S K, SHARMA P R, et al. Cytotoxic and apoptotic activity of essential oil from Ocimum viride towards COLO 205 cells[J]. Food and Chemical Toxicology,2010,48(1):336-344.
[3] 李思思,王涛,董志红,等. 右旋柠檬烯的研究进展及其新型专利技术[J]. 河南医学研究,2013,22(4):636-638.
[4] 张美慧,徐莉英,惠子,等. 紫苏醇类似物的合成及其体外抗肿瘤细胞增殖活性[J]. 沈阳药科大学学报,2014(10):768-771.
[5] 陈美婉,钟章锋,王胜鹏,等.β-榄香烯抗癌活性及其新型给药系统的研究进展[J]. 中国新药杂志,2012(12):1358-1361,1388.
[6] 徐海根,强胜. 中国外来入侵物种编目[M]. 北京:环境科学出版社,2004:162-163.
[7] 张红,贾贵芳,王亚男,等. 蚕豆根缘细胞对加拿大蓬挥发油的响应[J]. 四川师范大学学报(自然科学版),2011,34(3):398-400.
[8] IZABELA P, LEAZEK C, WIKTOR K, et al. Anticoagulant and anti-platelet activity of polyphenolic-polysaccharide preparation isolated from the medicinal plantErigeronCanadensisL.[J]. Thrombosis Research,2011,127(4):328-340.
[9] 彭炳先,周欣,石京山,等. 莪术挥发油及其中3种成分抗肝癌和子宫内膜癌的研究[J]. 华西药学杂志,2007,22(3):312.
[10] 石雪蓉,顾健,谭睿. 姜黄挥发油抗肿瘤作用机制研究[J]. 植物药理与临床,2003,19(6):15.
[11] 李美. 野胡萝卜挥发油对Hela细胞凋亡与坏死的影响[D]. 杭州:浙江师范大学,2012.
[12] 杨莉. 加拿大蓬化感作用及抑菌活性研究[D]. 长春:吉林农业大学,2011.
[13] 张伶,陈柳,胡德凤,等. 合成的西红花糖苷体外抗肿瘤活性研究[J]. 四川师范大学学报(自然科学版),2014,37(6):905.
[14] 翟中和. 细胞生物学[M]. 4版. 北京:高等教育出版社,2011:341-351.
[15] SLEE EA. Benzyloxycarbonyl-Val-Ala-Asp (OMe) fluoromethylketone (Z-VAD-FMK) inhibits apoptosis by blocking the processing of CPP32[J]. Biochem,1996,315(1):21-24.
(编辑 郑月蓉)
Primary Studies on in Vitro Antitumor Activities of Essential Oil fromErigeronCanadensisL. on Hela Cells
DU Runyuan, LIAO Ying, MA Danwei, ZHU Xiaohuan, WANG Yanan
(College of Life Science, Sichuan Normal University, Chengdu 610101, Sichuan)
To investigate the anti-tumor activity of the essential oil fromErigeronCanadensisL., the inhibitory effect of the oil was studied by MTT assay on human cervical cancer Hela cells. The morphologic changes in Hela cells induced by the essential oil were observed by AO/EB staining. The results showed that: the essential oil inhibited HeLa cells’ proliferation significantly in a dose and time -dependent manner. The IC50of essential oil on Hela cells for 8,24,48 h were 22.72,18.06,6.78 mg/L. The inhibitory effect was relieved after adding the pan-caspase inhibitor (Z-VAD-FMK), and IC50was increased to 29.9 mg/L at 24 h, indicating that the essential oil may activate the caspase in Hela cells. Typical morphologic changes of apoptosis were observed after the treatment with the essential oil fromErigeronCanadensisL. in Hela cells by using AO/EB staining. By inference, the essential oil fromErigeronCanadensisL.. may inhibit the proliferation of Hela cells possibly by inducing apoptosis.
ErigeronCanadensisL.; essential oil; Hela; proliferation inhibition; apoptosis
2015-07-17
四川省教育厅重点科研项目(14ZA0024)
R737.33
A
1001-8395(2016)06-0911-04
10.3969/j.issn.1001-8395.2016.06.025
*通信作者简介:廖 颖(1976—),女,副教授,主要从事植物提取物抗肿瘤活性及环境生态与健康的研究,E-mail:421135278@qq.com
