Zn2+配位双模板印迹聚合物的制备表征及同时萃取升麻中的阿魏酸和咖啡酸
2016-05-17王素素张月李辉吉首大学化学化工学院湖南吉首46000植物资源保护与利用湖南省高校重点实验室湖南吉首46000
王素素,张月,李辉,(吉首大学化学化工学院,湖南 吉首 46000;植物资源保护与利用湖南省高校重点实验室,湖南 吉首46000)
Zn2+配位双模板印迹聚合物的制备表征及同时萃取升麻中的阿魏酸和咖啡酸
王素素1,张月1,李辉1,2
(1吉首大学化学化工学院,湖南 吉首 416000;2植物资源保护与利用湖南省高校重点实验室,湖南 吉首416000)
摘要:以Zn2+-阿魏酸-咖啡酸配合物为模板制备了双分子印迹聚合物,优化了制备条件,用傅里叶红外光谱和扫描电镜对分子印迹聚合物进行结构表征,测试了分子印迹聚合物的吸附特性,探讨了分子印迹聚合物固相萃取应用效能并对萃取条件进行了优化。结果表明,当预反应混合液中金属离子、模板总量(阿魏酸-咖啡酸摩尔比为2∶3)、功能单体及交联剂用量比为1∶1∶3∶30(摩尔比)时,所得印迹聚合物对两种模板(阿魏酸和咖啡酸)均具有最好的吸附性能,吸附量分别达51.12mg/g和70.26mg/g。吸附动力学测试表明吸附3h,分子印迹聚合物可达到吸附平衡。用分子印迹聚合物进行固相萃取时,优化的淋洗过程为1.00mL H2O、1.00mL甲醇-H2O (3/7,体积比)及1.00mL甲醇-H2O-ACN (4/4/2,体积比),洗脱溶剂为2.00mL甲醇。在优化条件下,分子印迹聚合物可同时选择富集升麻初提液中的阿魏酸和咖啡酸,二者回收率分别为92.67%和95.42%,而且产品中杂质少于用硅胶萃取所得产品。
关键词:阿魏酸;咖啡酸;复合模板;分子印迹聚合物;固相萃取
第一作者:王素素(1988—),女,研究生,研究方向为生命科学中的分离分析新方法。E-mail 545197163@qq.com。联系人:李辉,教授,研究方向为生命科学中的分离分析新方法。E-mail lihuijsdx@163.com。
分子印迹技术旨在构造对目标化合物具有高选择性甚至专一结合能力的超分子化合物[1],由于其中的结合位点与目标分子在形状、大小及化学功能基方面的匹配性,分子印迹聚合物可用于对复杂体系中目标化合物的选择富集甚至专一识别[2]。迄今,分子印迹技术已广泛应用在固相萃取、色谱分离、传感技术、免疫分析及模拟酶催化等领域[3-7]。在过去关于分子印迹的大多数研究中,主要集中在对单一模板的印迹制备与分子识别,这些研究显示了单一模板印迹聚合物较高的分子识别选择性[8-11]。然而由于印迹识别的交叉选择作用,印迹位点除对模板分子显示高选择识别能力外,还对其结构类似物具有一定的选择结合能力,甚至在某些情况下使用虚拟模板印迹聚合物对目标化合物进行选择富集[12-13],从而大大扩展了分子印迹聚合物的应用范围。利用几种结构相似化合物为模板制备的多模板分子印迹聚合物保留了各化合物的功能基团、大小及分子形状信息,因而对多种模板分子具有预定的选择识别作用。张路等[14]用三聚氰胺和双氰胺混合物为模板制备的双分子印迹聚合物,对两种模板分子的印迹效应远高于各自为模板的分子印迹聚合物。王丽敏等[15]制备的双模板分子印迹聚合物对模板的吸附率是单模板分子印迹聚合物的3.6倍,且对模板分子具有更高的选择性。TAO等[16]以氧四环素和金霉素为模板制备的双分子印迹聚合物对四环素类化合物具有选择识别及固相萃取能力。基于此,可选择某一类化合物(如多酚类、生物碱类、黄酮类等)中几种代表性化合物的混合物作模板制备多模板分子印迹聚合物,并利用其对多种模板分子及其结构类似物的交叉选择识别性实现对这类化合物的同时富集和选择分离。这对药用植物活性部位的选择富集和分离及新药开发均具有重要应用价值。
升麻为一种辛凉解表中药,性甘味辛,具有发表透疹、清热解毒、升举阳气之功效。临床上常用于治疗风热头痛、咽喉肿痛及久泻脱肛等病症[17]。升麻中的苯丙酸类成分主要有咖啡酸和阿魏酸(其分子结构如图1所示)等,前者具有抗菌、抗病毒、解毒及抗凝血的作用;阿魏酸可抑制血小板聚集、抗血栓形成及调节人体免疫等功效[18-20]。利用升麻中的咖啡酸及阿魏酸等苯丙素类成分可开发新型抗炎药物,但同时高效选择提取升麻中的这些苯丙素类化合物仍是分离和纯化领域的难题。常规的溶剂提取及树脂分离选择性不高,难以控制条件实现对植物活性部位的同时选择萃取[21]。采用多种同类化合物为模板分子,通过构造与之相匹配的印迹识别位点,可以实现分子印迹聚合物选择富集多种同类化合物[22-23]。目前,还未见阿魏酸-咖啡酸复合模板分子印迹制备及应用的报道。本研究拟以阿魏酸和咖啡酸作为模板分子制备双模板分子印迹聚合物,并考察所得印迹材料对升麻中阿魏酸和咖啡酸同时选择萃取能力,以期开发新的固相萃取方法实现对升麻中几种苯丙素类化合物的同时富集和分离分析,为苯丙素类新型抗炎药物开发提供技术基础。
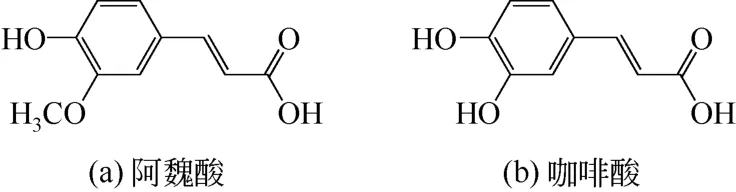
图1 阿魏酸和咖啡酸的分子结构
1 实验部分
1.1试剂与材料
阿魏酸(FA,99%)、咖啡酸(CA,98%)、4-乙烯基吡啶(4-VP)和乙二醇二甲基丙烯酸酯(EDMA)购自阿拉丁化学有限公司;分析纯的偶氮二异丁腈(AIBN)、乙腈(ACN)、甲醇、乙酸和二甲基亚砜(DMSO)购自天津市科密欧化学试剂公司;分析纯的乙酸锌和乙二胺四乙酸二钠(EDTA)购自天津市光复科技发展有限公司;硅胶(200目)购自青岛海洋化学试剂厂。水为二次蒸馏水,使用前用0.45 μm微孔滤膜过滤。
升麻药材为市售品,经鉴定为正品。
升麻样品溶液的制备:称取20.00g升麻样品于60℃干燥后,粉碎成细粉并过100目筛。精密称取生药粉末1.00g,置锥形瓶中,然后加入 0.50mol/L NaOH 溶液 10.00mL,超声提取 20min,冷却后过滤,滤液用稀 HCl 调 pH值为2.0,然后用5.0mL乙酸乙酯萃取3 次,合并萃取液,减压蒸馏脱除溶剂后,用甲醇溶解并定容至 25.00mL,即得升麻样品溶液。
1.2设备和仪器
LC2010-AHT型高效液相色谱,日本岛津公司;S-3400扫描电镜,日本岛津公司;IR-Affinity-1 傅里叶变换红外光谱仪,日本岛津公司;3H-2000BET-A氮吸附比表面测定仪,贝士德仪器科技(北京)有限公司;电子天平(精确到0.01mg),上海民桥精密科技有限公司;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司;电热鼓风干燥箱,上海博讯实业有限公司医疗设备厂;DF-101S集热式加热磁力搅拌器,巩义市予华仪器有限公司;KQ-250E 超声振荡器,昆山市超声仪器有限公司。
1.3分子印迹聚合物的制备
准确称取15.52mg 阿魏酸、21.60mg 咖啡酸和36.69mg乙酸锌溶于6.00mL乙腈-二甲基亚砜(5/1,体积比,下同)混合溶液中,室温震荡10min,加入63.08mg功能单体4-VP,震荡30min,再加入1.189g交联剂EDMA和30.00mg的引发剂AIBN,充分混合后,转入20mL圆底烧瓶中,超声脱气15min,通入氩气15min,密封。将圆底烧瓶放入60℃恒温水浴锅中聚合反应24h。将所得的块状聚合物粉碎,过200目筛后,用20mL丙酮沉降4次,去除上层悬浮小颗粒,过滤,将得到的聚合物用20.0mL 0.10mmol/L的EDTA溶液浸泡2次(每次2h)和20.0mL去离子水浸泡2次(每次2h),以除去金属离子及溶剂分子,过滤后,再将聚合物放入索氏提取器中,用甲醇-乙酸(9/1)混合溶液回流提取24h,以除去模板分子,然后用甲醇浸泡2次(每次2h),除去残余溶剂,过滤后的固体放入真空干燥箱于60 ℃中干燥24 h,即得分子印迹聚合物,放于干燥器中备用。
非印迹聚合物(NIP)的制备过程与印迹聚合物的制备过程一样,但不加模板分子。按表1改变两种模板的比例及功能单体的用量,制得一系列分子印迹聚合物MIP1~MIP8和非印迹聚合物NIP1~NIP2。
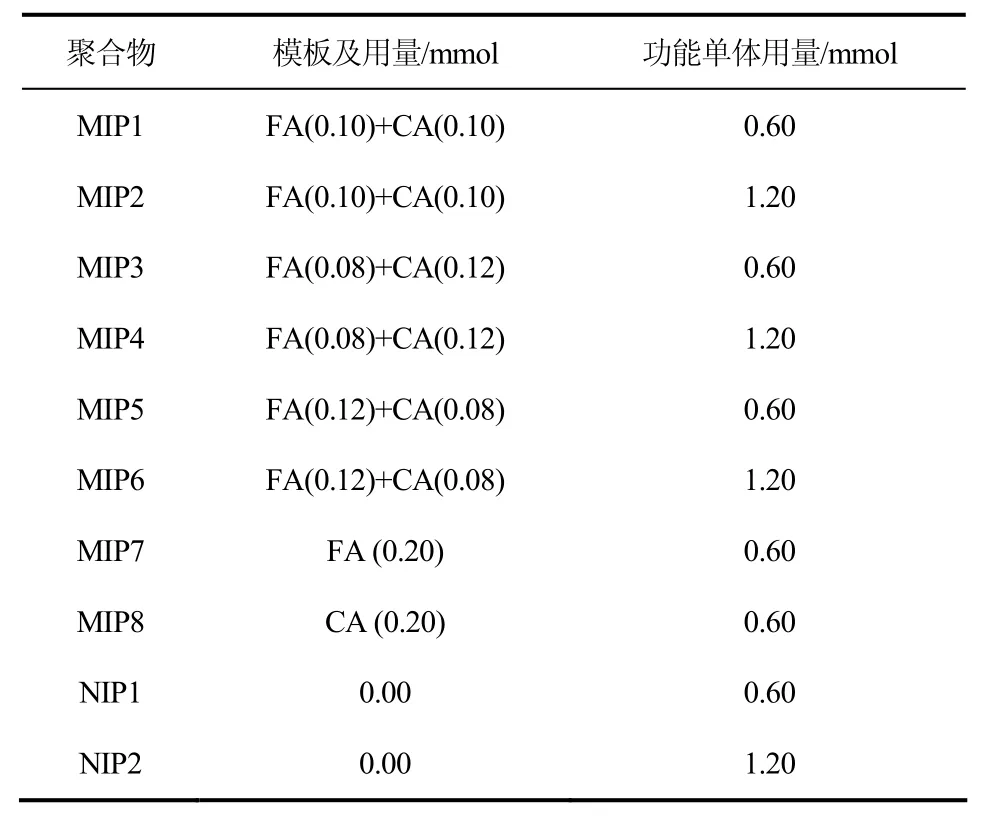
表1 双模板分子印迹聚合物的制备
1.4吸附动力学
准确称取分子印迹聚合物10.00mg于磨口锥形瓶中,加入10.00mL浓度为0.10mg/mL阿魏酸或咖啡酸乙腈溶液,每间隔0.50h,用2.0mL注射器取样0.20mL并用针头过滤器过滤,滤液用高效液相色谱分析,按方程(1)计算模板分子的吸附量qe(mg/g)。

其中,C0为底物的初始浓度,mg/mL;C'为任意时刻的底物浓度,mg/mL;V为溶液体积,mL;W为吸附剂的质量,g。
1.5分子印迹固相萃取
1.5.1分子印迹固相萃取柱的制备
称取150.00mg 聚合物MIP3均匀装填到体积为3.00mL带有滤板的聚丙烯固相萃取空柱中,依次用5.00mL甲醇-乙酸(9/1)溶液,5.00mL甲醇溶液,5.00mLACN溶液及5.00mL去离子水进行活化处理后,备用。
1.5.2样品溶液的装载
取1.00mL样品溶液,装入分子印迹固相萃取柱中,收集流出液并用HPLC检测目标化合物是否泄漏。
1.5.3洗涤和洗脱
将吸附有目标化合物的分子印迹聚合物柱,按照表2所设计的8种方法分别进行洗涤和洗脱,每种方法设计了3个洗涤步骤和1个洗脱步骤。
1.6高效液相色谱分析
高效液相色谱分析在C18柱(4.6mm×150mm,5mm,依利特分析仪器有限公司)上进行。流动相为甲醇-水-乙酸(40/57/3)混合溶液,流速为0.70mL/min,检测波长为323 nm,进样量为10 μL,柱温为30℃。用标准曲线法进行定性和定量分析。
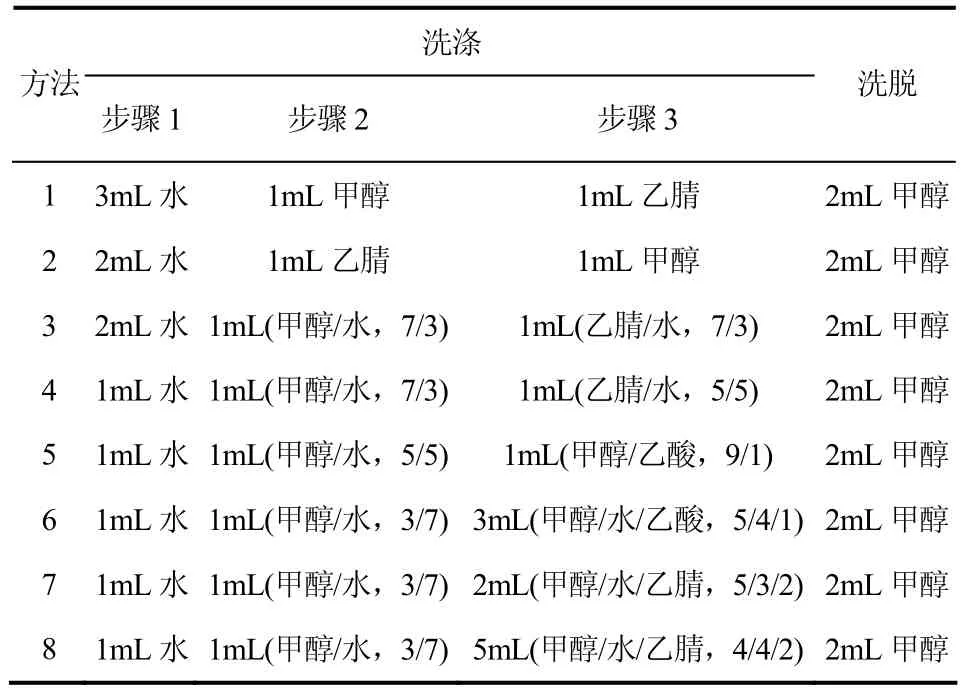
表2 分子印迹固相萃取方法及洗脱过程
2 结果与讨论
2.1分子印迹聚合物的制备及条件优化
以乙腈-二甲基亚砜混合液为溶剂(5/1),阿魏酸与咖啡酸混合物为模板,采用金属离子配位印迹法制备了双模板印迹聚合物。固定金属离子(Zn2+)和模板的总量分别为0.2mmol,改变2种模板分子的摩尔比及功能单体的用量,制备了6种双分子印迹聚合物(MIP1-6)。同时还制备了2种单模板印迹聚合物(MIP7-8)和2种非印迹聚合物(NIP1-2)。制备时各单体用量如表1所示。
2.1.1优化功能单体用量
以阿魏酸和咖啡酸的吸附量为指标,改变功能单体的用量分别为0.60mmol和1.20mmol,所得分子印迹聚合物(MIP1-6)对2种模板的吸附量如图2所示。可以发现,当其他条件相同时,功能单体的用量为0.6mmol(即模板与功能单体摩尔比为1∶3)时,制备的分子印迹聚合物对两种模板吸附量最大。而当功能单体用量为1.2mmol,即模板与功能单体用量比为1∶6时,吸附量反而较低。这种因功能单体用量大而致使分子印迹聚合物吸附量低的现象可能是由于功能单体发生了自身缔合的缘故。功能单体发生分子缔合后,印迹位点无法准确形成并固定,引起特异性识别位点数目降低及传质阻力增加,从而最终导致聚合物吸附量下降。同样的情况在文献[24]中也见报道。另外,图2也显示了2种单模板印迹聚合物(MIP7~MIP8)和非印迹聚合物(NIP1~NIP2)对2种模板分子的静态吸附量。均存在因功能单体用量增加而聚合物吸附量降低的现象。因此模板与功能单体用量比为1∶3。
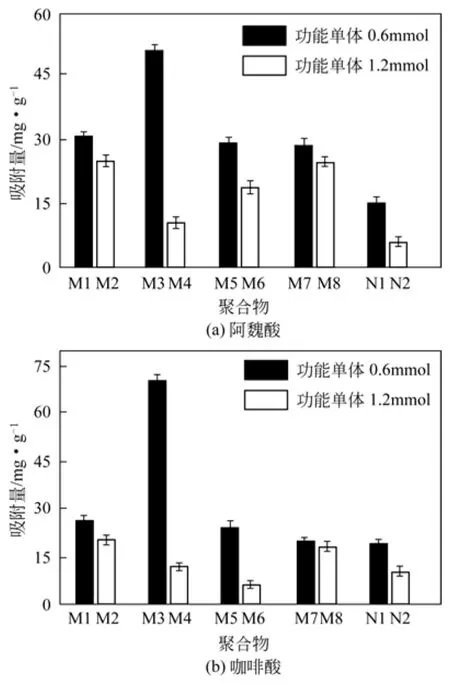
图2 阿魏酸及咖啡酸在聚合物上的吸附量及标准偏差(n=3)
2.1.2优化两种模板分子的用量比
固定模板分子总量和功能单体用量分别为0.20mmol和0.60mmol,改变咖啡酸与阿魏酸的摩尔比分别为1∶1、3∶2和2∶3,制得了3种双分子印迹聚合物MIP1、MIP3和MIP5(参见表1)。通过比较3种分子印迹聚合物对2种模板的吸附量(图3),发现MIP3对两种模板的吸附量最大,对阿魏酸、咖啡酸的吸附量分别为51.12mg/g和70.26mg/g。这表明模板分子的结构和用量对印迹位点的形成具有重要影响。过去,作者课题组采用沉淀聚合法制备咖啡酸或绿原酸印迹微球的过程中,也曾发现咖啡酸易于得到均匀微球,而在同样的条件下,绿原酸则不能[25]。
2.2双模板印迹聚合物的结构表征
2.2.1红外光谱分析
采用KBr压片法,用傅里叶变换红外光谱仪在4000~400cm−1范围测试了阿魏酸、咖啡酸、双模板印迹聚合物MIP3及非印迹聚合物NIP1的红外光谱,结果如图4所示。对阿魏酸,3438cm−1为—O —H伸缩振动吸收,3017cm−1为甲基的C—H伸缩振动吸收,1692cm−1为C=O伸缩振动吸收,1624cm−1为C=C双键伸缩振动吸收;对咖啡酸,3422cm−1为—O—H伸缩振动吸收,3230cm−1为=C—H伸缩振动吸收,1645cm−1为C=O伸缩振动吸收,1620cm−1为C=C双键伸缩振动吸收;对双模板印迹聚合物,3614cm−1和 3442cm−1处的吸收峰分别为—N—H和—O—H伸缩振动,2958cm−1处的吸收峰分别为甲基中—C—H的对称伸缩振动,1733cm−1处的吸收峰为—C=O伸缩振动,1641cm−1处的吸收峰为—C=C的伸缩振动,1461cm−1处的吸收峰为吡啶环的—C=N伸缩振动,1263cm−1和1163cm−1处的吸附峰分别是—C—O—C的对称和不对称伸缩振动。这些红外吸收峰的形成及吸收位置的变化表明了印迹位点的有效生成。对非印迹聚合物NIP1,3634cm−1和3448cm−1处的吸收峰分别为—N—H和—O—H伸缩振动,2991cm−1处的吸收峰分别为甲基中—C—H的对称伸缩振动,1733cm−1处的吸收峰为—C=O伸缩振动,1601cm−1处的吸收峰为—C=C的伸缩振动,1461cm−1处的吸收峰为吡啶环的—C=N伸缩振动,1263cm−1和1163cm−1处的吸附峰分别是—C—O—C的对称和不对称伸缩振动,这些红外吸收主要来自功能单体、交联剂及溶剂分子等。

图3 双分子印迹聚合物MIP1、MIP3及MIP5对阿魏酸和咖啡酸的吸附量(n=3)
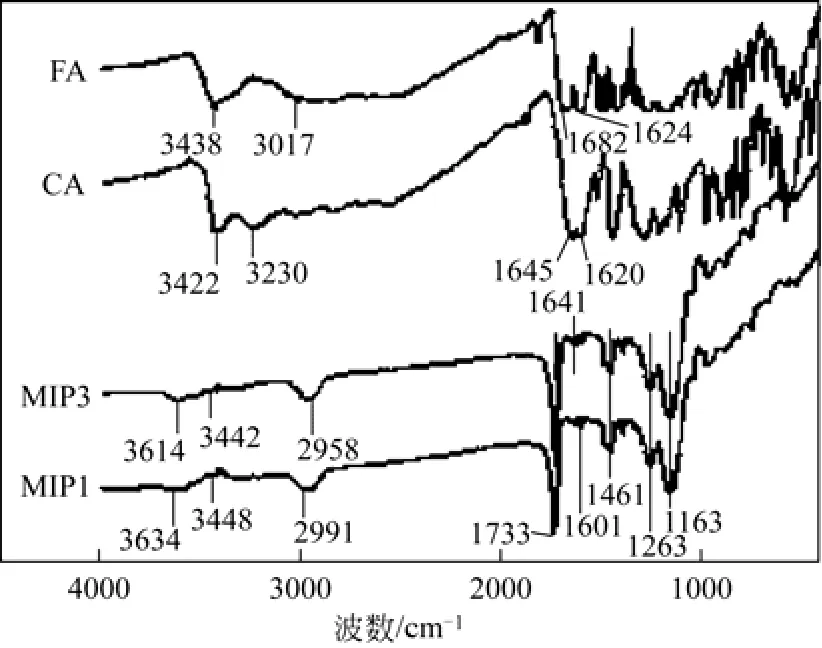
图4 阿魏酸、咖啡酸、双模板印迹聚合物MIP3及非印迹聚合物NIP1的红外光谱图
2.2.2电镜分析和比表面测试

图5 分子印迹聚合物MIP3(a)及非印迹聚合物NIP1(b)的扫描电镜图
图5为双模板印迹聚合物MIP3及非印迹聚合物NIP1的扫描电镜图,可以观察到MIP3的表面粗糙,结构疏松并有很多微小孔穴,这些孔穴有利于分子印迹聚合物的表面吸附;而非印迹聚合物NIP1结构致密,表面较为平整光滑。图6给出了分子印迹聚合物MIP3和非印迹聚合物NIP1的比表面测定结果.显然分子印迹聚合物的比表面积(82.7176m2/g)比非印迹聚合物(18.7022m2/g)要大许多。比表面积越大,越有利于吸附,因此分子印迹聚合物的吸附量高于非印迹聚合物(见图2)。
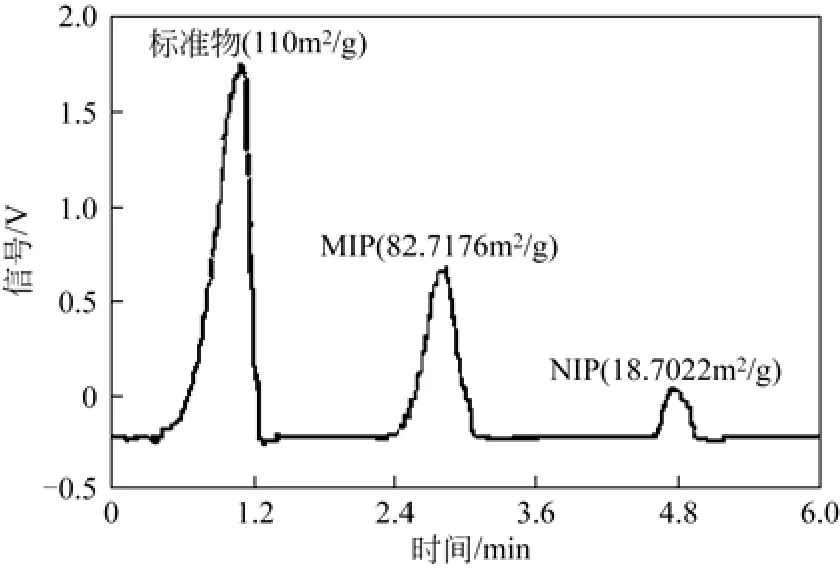
图6 聚合物的比表面积测试
2.3分子印迹固相萃取模拟样品溶液
分别测试了分子印迹固相萃取阿魏酸和咖啡酸模拟样品溶液的效能。将阿魏酸和咖啡酸模拟样品溶液上样后,按照表2所设计的8种洗脱方法分别进行洗涤和洗脱,每种方法设计了3个洗涤步骤和1个洗脱步骤。8种洗脱方法中各洗涤和洗脱步骤的产品回收率如表3所示。从中可知,对2种目标化合物而言,方法8在选择性和回收率方面均最好。因此,洗涤步骤的优化洗涤溶剂为1mL水、1mL(甲醇/水,3/7)和5mL(甲醇/水/乙腈,4/4/2)。再用2mL甲醇洗脱目标产物。在优化条件下,分子印迹固相萃取阿魏酸和咖啡酸的回收率分别为101.3% 和105.4%。
2.4吸附动力学
图7给出了双模板印迹聚合物MIP3对阿魏酸[图7(a)]和咖啡酸[图7(b)]的吸附量随时间的变化关系。从图7(a)可知,在2.5h前,分子印迹聚合物对阿魏酸的吸附量随着时间而迅速增加,吸附速率最快,这是因为吸附刚开始时,特异性和非特异性位点均未饱和,模板分子迅速占据印迹位点的原故;之后,吸附量缓慢增加;3h后吸附量几乎不再增加,这是由于印迹位点几乎被模板分子所占据,达到了吸附平衡状态,这表明复合模板印迹聚合物对阿魏酸分子较快的吸附动力学。分子印迹聚合物对咖啡酸的吸附量随时间的变化规律与此相似。而非印迹聚合物对2种模板分子的吸附量则随时间延长而缓慢增加,需要较长时间才能达到吸附平衡。
2.5样品应用
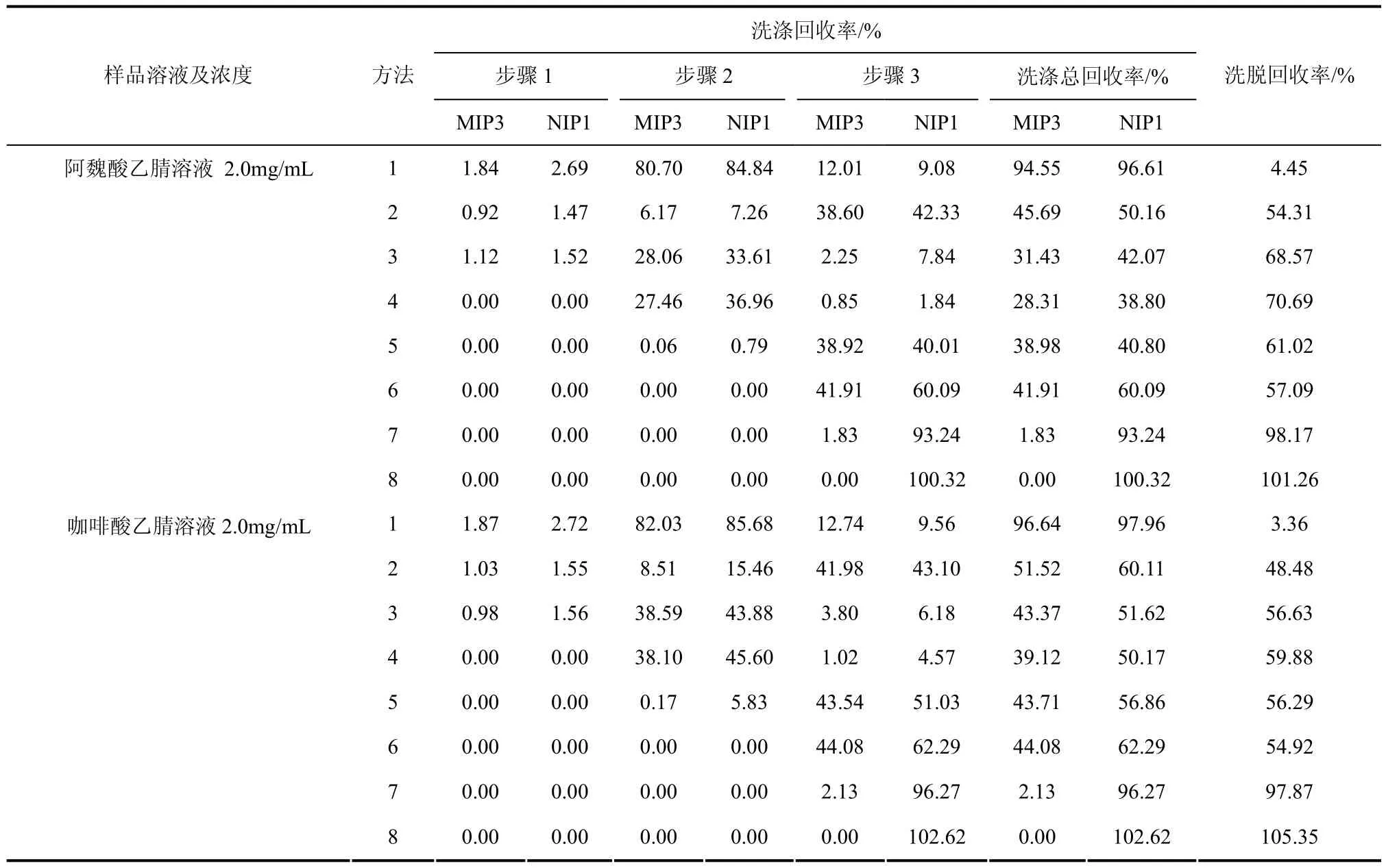
表3 分子印迹固相萃取阿魏酸及咖啡酸模拟样品溶液
在优化条件下,用分子印迹固相萃取柱提取升麻样品溶液。获得的产品经减压蒸馏脱除溶剂后,再溶解在甲醇溶液中,并用HPLC测定,得到色谱图如图8所示。图8(a)为咖啡酸与阿魏酸对照品的液相色谱图,咖啡酸的保留时间是3.67min,阿魏酸的保留时间是5.48min。图8(b)为产品的色谱图,可以发现升麻样品溶液中的阿魏酸和咖啡酸,通过分子印迹固相萃取得到了选择富集,阿魏酸和咖啡酸的回收率分别为92.67%和95.42%。此外,为了评价分子印迹聚合物的选择富集能力,测试了在优化洗脱条件下[洗涤溶剂为1mL水、1mL甲醇/水(3/7) 和5mL甲醇/水/乙腈(4/4/2);洗脱溶剂为2mL甲醇],硅胶固相萃取升麻样品溶液所得产品的高效液相色谱图,示于图8(c)中。比较图8(b)和8(c),发现分子印迹萃取的产品杂质较少,而硅胶萃取所得产物杂质较多,这是由分子印迹聚合物对模板分子的选择保留性能所决定的。利用双模板分子印迹聚合物对模板的选择富集性能也可用于选择脱除汽油中的苯并噻吩和二苯并噻吩[26]。
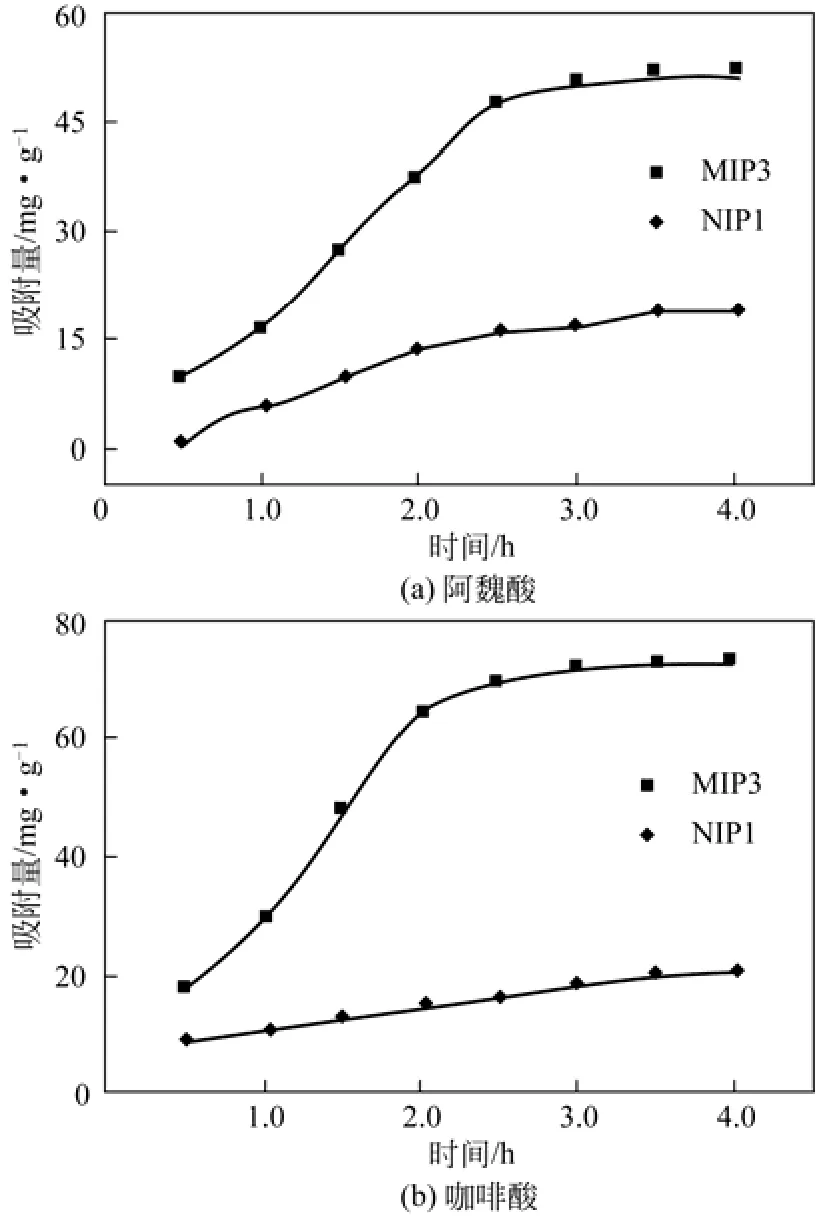
图7 双模板分子印迹聚合物MIP5对阿魏酸及咖啡酸的吸附动力学
3 结论
以Zn2+-阿魏酸-咖啡酸配合物为模板分子,控制阿魏酸-咖啡酸物质的量比为2∶3,调节预反应混合液中金属离子、模板分子、功能单体及交联剂用量比为1∶1∶3∶30(摩尔比),成功制备了阿魏酸-咖啡酸双分子印迹聚合物。所得印迹聚合物对阿魏酸和咖啡酸均具有较快的吸附动力学,平衡吸附量分别达51.12mg/g和70.26mg/g。分子印迹固相萃取的优化洗涤溶剂为1.00mLH2O、1.00mL甲醇-H2O (3/7)及1.00mL甲醇- H2O-ACN (4/4/2),然后用2.00mL甲醇洗脱目标化合物。该分子印迹聚合物可用于对升麻样品中阿魏酸和咖啡酸的选择富集,二者回收率分别为92.67%和95.42%。

图8 咖啡酸、阿魏酸对照品、MIP-SPE萃取产品及硅胶固相萃取产品的高效液相色谱图
参考文献
[1]CHAPUIS F,PICHON V,LANZA F,et al. Retention mechanism of analytes in the solid-phase extraction process using molecularlyimprinted polymers:application to the extraction of triazines from complex matrices[J]. J. Chromatogr. B,2004,804:93-101.
[2]YAN C,ZHANG B B,LIU W Y,et al. Rapid determination of sixteen sulfonylurea herbicides in surface water by solid phase extraction cleanup and ultra-high-pressure liquid chromatography coupled with tandem mass spectrometry[J]. J. Chromatogr. B,2011,879:3484-3489.
[3]AHMADI F,AHMADI J,RAHIMI-NASRABADI M. Computational approaches to design a molecular imprinted polymer for high selective extraction of 3,4-methylenedioxymethamphetamine from plasma[J]. J. Chromatogr. A,2011,1218:7739-7747.
[4]ALIZADEH T,GANJALI M R,ZARE M,et al. Selective determination of chloramphenicol at trace level in milk samples by the electrode modified with molecularly imprinted polymer[J]. Food Chem.,2012,130:1108-1114.
[5]XIAO D B,ZHEN L. Facile preparation of glycoprotein-imprinted 96-well microplates for enzyme-linked immunosorbent assay by boronate affinity-based oriented surface imprinting[J]. Anal. Chem.,2014,86:959-966.
[6]TAN-PHAT H,PIOTR P,FRANCIS D,et al. Molecularly imprinted polymer for recognition of 5-fluorouracil by RNA-type nucleobase pairing [J]. Anal. Chem.,2013,85:8304-8312.
[7]谭先周,李辉,逯翠梅,等. 纳米TiO2基绿原酸印迹聚合物的制备及其吸附研究[J]. 化工进展,2013,32(2):388-393.
[8]LIU C M,LIANG R P,WANG X N,et al. A versatile polydopamine platform for facile preparation of protein stationary phase for chip-based opentubular capillary electrochromatography enantioseparation[J]. J. Chromatogr. A,2013,1294:145-151.
[9]WENG X X,BI H Y,LIU B H,et al. On-chip chiral separation based onbovine serum albumin-conjugated carbon nanotubes as stationary phase ina microchanne[J]. Electrophoresis,2006,27:3129-3235.
[10]QU P,LEI J P,SHENG J,et al. Simultaneous multiple enantiosepa-ration with a one-pot imprinted microfluidic channel by microchip capillary electrochromatography[J]. Analyst,2011,136:920-926.
[11]WANG Y X,WANG S H,NIU H Y,et al. Preparationof polydopamine packed Fe3O4nanoparticles and their application for enrich-ment of polycyclic aromatic hydrocarbons from environmental water samples[J]. J. Chromatogr. A,2013,1283:20-26.
[12]YOU Q P,PENG M J,ZHANG Y P,et al. Preparation of magnetic dummy molecularly imprinted polymers for selective extraction and analysis of salicylic acid in Actinidia chinensis[J]. Anal. Bioanal. Chem.,2014,406(3):831-839.
[13]HU J H,FENG T,LI W L,et al. Surface molecularly imprinted polymers with synthetic dummy template for simultaneously selective recognition of nine phthalate esters[J]. J. Chromatogr. A,2014,1330:6-13.
[14]张路,赵燕萍,张闪闪,等. 双模板分子印迹聚合物在奶粉检验中的应用研究[J]. 化学试剂,2015,37(6):495-499.
[15]王丽敏,李英华. 铅离子双印迹吸附剂的制备及其在原子吸收光谱法测定水中痕量铅中的应用[J]. 理化检验:化学分册,2014,50(5):589-593.
[16]TAO J,YAN W,QING D,et al. Preparation of mixed-templates molecularly imprinted polymers and investigation of the recognition ability for tetracycline antibiotics[J]. Biosens. Bioelectron.,2010,25:2218-2224.
[17]王晓明,张帆,刘莹,等. LC-MS/MS法测定升麻中咖啡酸、阿魏酸、异阿魏酸含量的研究[J]. 天津中医药,2014,31(11):686-689.
[18]SHIYI O,KIN-CHOR K. Ferulic acid:pharmaceutical functions,preparation and applications in foods[J]. Sci. Food Agric.,2004,84 (11):1261-1269.
[19]乔福斌,张建芳,李成田,等. 灯盏花素、阿魏酸钠联合贝那普利治疗早期糖尿病肾病的疗效观察[J]. 天津中医药,2010,27(6):458-459.
[20]胡益勇,徐晓玉. 阿魏酸的化学和药理研究进展[J]. 中成药,2006,28(2):253-255.
[21]许高燕,刘莹雯,银董红,等. 高效液相色谱串联质谱法测定水溶性迷迭香提取物中迷迭香酸、阿魏酸和咖啡酸的含量[J]. 分析科学学报,2006,22(5):567-569.
[22]刘芃岩,申杰,刘磊. 复合模板印迹聚合物净化液相色谱-质谱联用法测定鱼肉中氟喹诺酮类残留[J]. 分析化学,2012,40(5):693-698.
[23]韦寿莲,刘玲,黎京华,等. 双分子印迹聚合物微球选择固相萃取环境和食品样品中壬基酚和双酚A[J]. 分析化学,2015,43(1):105-109.
[24]李鸣芳,王兵. 合成引发方式对槲皮素-钴(II)配位印迹聚合物结构与性能的影响[J]. 化学学报,2012,70(7):921-928.
[25]CHITOSE M,HUI L,HISAMI M,et al. Molecularly imprinted polymer for chlorogenic acid by modified precipitation polymerization and its application to extraction of chlorogenic acid from Eucommia ulmodies leaves[J]. J. Pharmaceu. Biomed. Anal.,2015,114:139-144.
[26]LIU W F,LIU X G,YANG Y Z,et al. Selective removal of benzothiophene and dibenzothiophene from gasoline using double template molecularly imprinted polymers on the surface of carbon microspheres[J]. Fuel,2014,117:184-190.
Preparation and characterization of Zn2+-bi-templates imprinted polymers for the simultaneous extraction of ferulic acid and caffeic acid in Rhizoma Cimicifugae
WANG Susu1,ZHANG Yue1,LI Hui1,2
(1College of Chemistry and Chemical Engineering,Jishou University,Jishou 416000,Hunan,China;2Key Laboratory of Plant Resource Conservation and Utilization,Jishou University,Jishou 416000,Hunan,China)
Abstract:A group of bi-templates imprinted polymers (MIPs) was synthesized using Zn2+-ferulic acid-caffeic acid complex as the template. The preparation conditions were optimized. Structural characterizations were performed using FTIR and SEM and the adsorption capacity was tested. Also,the applicability of this MIP in the solid phase extraction was explored after the washing and elution conditions were optimized. Results indicated that when the molar ratio of Zn2+-two templates (the molar ratio of ferulic acid to caffeic acid was 2∶3)-functional monomer-cross linker was 1∶1∶3∶30 in the pre-polymerization mixture,the obtained imprinted polymer possessed the highest adsorption capacity toward two templates,with a value of 51.12mg/g for ferulic acid and 70.26mg/g for caffeic acid. The adsorption equilibrium can be reached within 3h. The optimized conditions for this MIPsphase extraction were 1.00mL H2O,1.00mL methanol- H2O mixture (3/7,volume ratio) and 1.00 mL methanol-H2O-acetonitrile mixture(4/4/2,volume ratio) for the washing procedure and 2.00 mL methanol for the elution one. This MIP revealed selective enrichment capability toward ferulic acid and caffeic acid in the crude extract of Rhizoma Cimicifugae,with recovery rates of 92.67% and 95.42% respectively under the optimized conditions. The product contains less impurities than that obtained by silica solid phase extraction.
Key words:ferulic acid; caffeic acid; mixed-templates; molecularly imprinted polymers; solid phase extraction
中图分类号:TQ 31
文献标志码:A
文章编号:1000–6613(2016)04–1132–08
DOI:10.16085/j.issn.1000-6613.2016.04.026
收稿日期:2015-09-14;修改稿日期:2015-10-27。
基金项目:国家自然科学基金面上项目(21077042)、湖南省高校科技创新团队支持计划、吉首大学研究生培养创新基地开放项目(2014KFXM02)及吉首大学研究生专项(37)。
