固定化离子液体固相萃取—电化学联用测定痕量双酚A
2015-04-20黄良等
黄良等

摘 要 以咪唑改性的苯乙烯型大孔树脂填料制备固相萃取小柱,进行固定化离子液体固相萃取,结合β环糊精修饰离子液体碳糊电极,发展痕量双酚A的电化学联用快速检测技术。实验优化影响萃取效率的因素,获得最佳萃取条件(萃取填料用量0.4 g,样品体积200 mL,上样液pH 7.0, 5 mL甲醇为洗脱溶剂,萃取流速4.5 mL/min)。测得固定化离子液体树脂对双酚A的最大吸附容量为10.1 mg/g,富集倍数为40倍。双酚A的浓度线性范围在2.3~228 μg/L,检出限为0.95 μg/L。联用方法灵敏、实用性强,用于实际样品中双酚A分析,结果与HPLC方法一致。
关键词 固定化离子液体; 固相萃取; 离子液体碳糊电极; 双酚A; 电化学检测
1 引 言
双酚A(Bisphenol A,BPA)是合成聚碳酸酯、环氧树脂等材料的主要原料,广泛用于制造食品饮料包装、塑料(奶)瓶和医用品等。它是一种具有雌激素样活性的内分泌干扰物质,长期暴露将导致动物胚胎毒性和致畸性,安全性问题备受国际关注,各国已陆续禁止或限制含双酚A制品的生产与使用。BPA在环境中浓度低[1],基质复杂,建立高效富集检测方法对于其污染监控十分必要[2]。
目前, 双酚A的分析主要采用色谱法[3],包括高效液相色谱(HPLC)[4,5]、液相色谱质谱联用、气相色谱质谱联用[6]以及毛细管电泳等,这些方法选择性好,但样品预处理复杂费时,分析成本高, 限制了其应用。目前传感器技术广泛应用于物质的快速检测,纳米材料、分子印迹聚合物和生物活性物质均被用于构建BPA的电化学、化学发光等传感器[2],特异性强、灵敏、便携;不过,多数传感器难以重复使用[7],有时基质效应对样品测定影响较大,实际应用很少。本研究组基于咪唑离子液体与β环糊精(βCD)特性,研制BPA的βCD修饰离子液体碳糊电极,在重现性、稳定性和重复使用性等方面具备明显的实用性[8]。样品预处理是决定BPA分析速度和准确性的主要环节。目前广泛使用的固相萃取(SPE)技术[9],操作方便、净化效果好,但常用的C18填料对BPA缺乏特异性,而分子印迹聚合物印迹容量和传质效率偏低,在水环境的识别力有限[10]。新型萃取材料是实现BPA特异性和高效富集的关键。
固定化离子液体(Supported ionic liquids,SILs)是将离子液体通过吸附、包埋或者键合等方法,固定在固体载体表面,既结合了固相载体材料的物化性质,又保持了离子液体蒸气压小、溶解性优异、可设计等特性[11],固定化后离子液体比表面积增加,稳定性增强。SILs自2009年报道以来[12]就被视为可替代传统固相萃取吸附剂[13],提高了HPLC联用分析的选择性与提取性能,还避免了离子液体流失与有机溶剂毒性[14]。相对于其它固相萃取材料,SILs聚合物还具有柱容量高、pH稳定性好、制备简便、萃取选择性强等优点。研究指出[15],咪唑类离子液体包含氢键位点、芳香环等功能团,可与苯酚、烷基酚发生多重相互作用,成功用于液相微萃取[16,17]和固相微萃取[18]。目前尚未见到SILs固相萃取富集BPA的报道。
本研究以咪唑改性的苯乙烯型大孔吸附树脂为填料,制备SILs固相萃取小柱富集双酚A。结合βCD修饰离子液体碳糊电极[8],建立SILsSPE与电化学联用分析方法,实现复杂样品中痕量BPA的快速测定。
2 实验部分
2.1 仪器与试剂
CHI660A电化学工作站(上海辰华仪器有限公司); 三电极系统(β环糊精修饰离子液体碳糊电极(βCD/ILCPE)为工作电极、Ag/AgCl为参比电极、铂丝为辅助电极); 氮气吹干仪(北京八方世纪科技有限公司); 扫描电镜(荷兰Philips); 能谱分析系统(日本浩视公司); 超快速液相色谱仪(日本岛津公司); MilliQ超纯水系统。
双酚A(Alfa Aesar公司); 1丁基3甲基咪唑四氟硼酸盐(BMIMBF4, Aladdin公司); 石墨粉(Sigma公司); β环糊精(Aladdin公司); 其它试剂均为分析纯以上; 实验室用水皆为超纯水(18.2 MΩ·cm)。0.01 mol/L BPA标准储液由无水甲醇配制,每次测定时,用超纯水稀释至所需浓度; 0.1 mol/L醋酸盐缓冲液(pH 5.5)由CH3COOK和CH3COOH配制。溶液均避光4 ℃保存。
甲基咪唑改性的苯乙烯型大孔吸附树脂(SILs)由中国科学院长春应用化学研究所提供[19],结构图和SEM图(图1)表明,树脂平均粒径约500 μm,表面有大量孔穴。能谱分析显示复合材料主要含C, N, O元素,其中N为2.98%(w/w),甲基咪唑氯盐含量约为12.5 mg/g。
2.2 实验方法
2.2.1 固相萃取小柱的制备及萃取流程 准确称取适量SILs树脂,均匀填装在底部垫有筛板的聚丙烯固相萃取柱空管(3 mL)内。SPE小柱每次使用前依次用5 mL甲醇和二次水活化和平衡。
萃取过程: 将200 mL样品溶液加入活化后的SPE柱使目标物保留; 用5 mL甲醇水(10∶90, V/V)淋洗萃取柱,洗去杂质,小柱氮吹至干; 以适量甲醇洗脱目标物,收集洗脱液,40 ℃下氮吹至近干,加入5 mL醋酸盐缓冲溶液(pH 5.5)即得预富集样品。
2.2.2 测定条件 (1)电化学测定 采用前期研制的对BPA具有选择性识别与电催化作用的βCD/ILCPE为工作电极,制备方法参照文献\[8\]。电极使用前在称量纸上打磨抛光,用二次水冲净。在0.1 mol/L醋酸盐缓冲液(pH 5.5)中,采用三电极体系,于0.2~1.0 V范围对样品进行微分脉冲伏安法阳极化扫描,富集电位0.5 V,富集时间300 s,扫描速度20 mV/s。(2)液相色谱紫外检测 XDB C18色谱柱(250 mm×4.6 mm, 5 μm); 流动相: 甲醇水(70∶30,V/V); 流速: 1.0 mL/min; 柱温: 30
SymbolpB@ C; 检测波长: 280 nm。
2.2.3 样品采集处理 (1)自来水 取实验室自来水,0.22 μm微孔滤膜过滤后备用; (2)闽江江水 在闽江福州城区段随机采集水样1500 mL,用0.22 μm微孔滤膜过滤后备用; (3)矿泉水瓶 将市售的聚丙烯矿泉水瓶洗净干燥,剪成约5 mm × 5 mm的碎片,称取1.0 g,常温下用100 mL甲醇超声提取4 h,提取液用氮吹至近干,用甲醇定容至5 mL,避光备用。
3 结果与讨论
3.1 固相萃取条件的优化
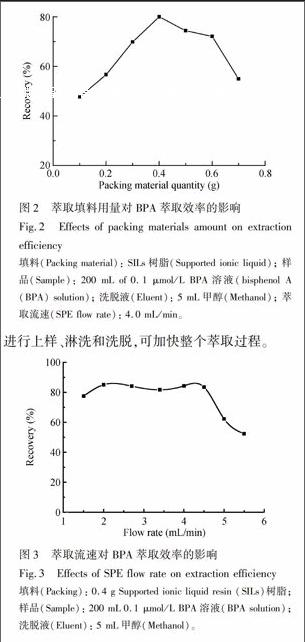
3.1.1 固定化离子液体用量的影响 分别将不同质量的SILs树脂制备固相萃取柱用于SPE,图2表明,SILs填料用量对BPA的回收率有较大影响: 用量不足时,目标物吸附不完全,回收率低; 增大SILs填料用量,使BPA回收率逐渐增加,在0.4 g时达到最大; 之后回收率开始下降,这是由于萃取剂用量过多使得SPE柱内压力升高,同时对结构类似共存物质吸附增加,导致与BPA的作用位点减少。
3.1.2 上样液pH值的影响 考察了pH 4.0~10.0 范围内萃取小柱对BPA的吸附情况,其回收率基本不变,pH适用范围宽。BPA(pKa=8.9)在pH<8.9时呈分子状态,与SILs之间主要发生ππ相互作用、氢键和疏水作用; 当pH>8.9时,BPA发生解离,但回收率没有增加,可以推断BPA与萃取剂之间的静电作用及离子交换作用基本可以忽略。分析水样时,中性条件下直接上样,SILsSPE柱借助上述作用,对分子化的双酚A及其结构类似物产生非选择性富集,排除样品基质以及2,4二硝基苯酚(pKa=4.1)等解离物质的干扰。
3.1.3 萃取流速的影响 实验表明,萃取流速慢有利于对BPA的吸附和洗脱,但过慢则影响萃取速度; 另一方面,上样和洗脱流速的过度增加都会导致BPA回收率减小,反映其在萃取剂上的作用不完全。如图3,萃取流速控制在2.0~4.5 mL/min范围,可获得较高的BPA回收率; 以流速4.5 mL/min进行上样、淋洗和洗脱,可加快整个萃取过程。
3.1.4 洗脱溶剂对洗脱效果的影响 分别对不同的洗脱溶剂(甲醇、乙醇、乙腈、丙酮、乙酸乙酯)进行实验优化,采用甲醇和丙酮洗脱时BPA的回收率较高,乙酸乙酯最低,这与咪唑型离子液体易于溶解其中有关。为提高SILsSPE柱的重复使用次数,最大程度减少固定液流失造成的误差,选择不与SILs互溶的甲醇作为洗脱溶剂。
研究了不同体积甲醇(1~15 mL)对目标物洗脱效率的影响。随着洗脱溶剂体积增大,BPA的回收率明显增加; 当洗脱溶剂体积增至5 mL时,回收率已达最大值; 继续加大至15 mL,洗脱效率基本不变。
3.2 动态吸附实验
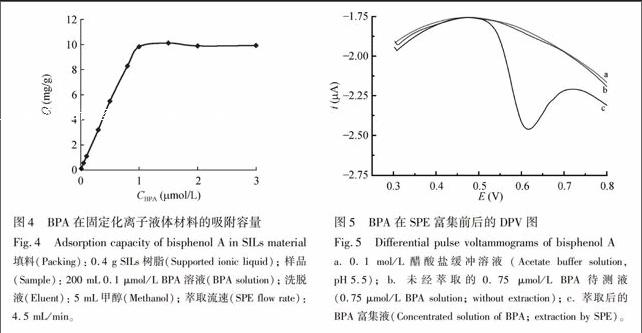
取不同浓度的BPA测试液200 mL,调节pH≈7,按2.2节依次进行富集、洗脱和微分脉冲伏安(DPV)测定,测得萃取回收后溶液中BPA的平衡浓度Ce(mol/L)。按式(1)求出BPA在萃取柱上的吸附容量Q(mg/g)。
3.3 萃取前后BPA的电化学响应对比
在0.1 mol/L醋酸盐缓冲溶液(pH 5.5) 中,分别对未经萃取的测试液以及经SILsSPE萃取后的预富集溶液进行DPV扫描,测定BPA在0.67 V电位处的氧化峰电流,采用标准曲线法进行定量分析。萃取前后DPV对比图显示,经过SPE富集(图5c),BPA峰电流较富集前(图5b)增加了约40倍。
3.6 实际样品分析
按照2.6节采集和处理样品,分别进行SILsSPE提取富集和电化学测定(SILsSPEED法),采用SPEHPLCUV标准方法[20]进行对比实验(表1),两种方法均未测出BPA,回收实验测得的BPA加标含量较为接近,在置信度为95%时,Paired ttest结果P>0.05,显示方法间无显著性差异。SILsSPEED法测定快速、稳定、重现性好,测试成本低廉,更加适合复杂样品快速检测。
References
1 Rubin B S. J. Steroid Biochem. Mol. Biol., 2011, 127(12): 27-34
2 Ragavan K V, Rastogi N K, Thakur M S. TrACTrends Anal. Chem., 2013, 52: 248-260
3 BallesterosGómez A, Rubio S, PérezBendito D. J. Chromatogr. A, 2009, 1216(3): 449-469
4 TAN XiaoWang,WEI RuiPing,SONG YanXi,YI GuYang. Chinese J. Anal.Chem., 2012,40(9): 1409-1414
谭小旺, 魏瑞萍, 宋燕西, 易谷洋. 分析化学, 2012, 40(9): 1409-1414
5 LI Yu, LIU JianLin,WANG XiaoLi, JIAN YingHong, DONG DeMing, LI Na. Chem. J. Chinese Universities, 2008, 29(11): 1242-1248
李 鱼, 刘建林, 王晓丽, 翦英红, 董德明, 黎 娜. 高等学校化学学报, 2008, 29(11): 1242-1248
6 LI MinJie, JIN Fen, YANG LiLi, WU RiNa, SHAO Hua, JIN MaoJun, WANG Jing. Chinese J. Anal. Chem., 2014, 42(9): 1288-1294
李敏洁, 金 芬, 杨莉莉, 乌日娜, 邵 华, 金茂俊, 王 静. 分析化学, 2014, 42(9): 1288-1294
7 Yang X Y, Kirsch J, Fergus J, Simonian A. Electrochim. Acta, 2013, 94: 259-268
8 Yu X W, Chen Y K, Chang L P, Zhou L, Tang F X, Wu X P. Sens. Actuat. B, 2013, 186: 648-656
9 Geng Y Y, Ding M Y, Chen H, Li H F, Lin J M. Talanta, 2012, 89: 189-194
10 Watabe Y, Kondo T, Morita M, Tanaka N, Haginaka J, Hosoya K. J. Chromatogr. A, 2004, 1032(12): 45-49
11 Sun P, Armstrong D W. Anal. Chim. Acta, 2010, 661(1): 1-16
12 Fontanals N, Ronka S, Borrull F, Trochimczuk A W, Marcé R M. Talanta, 2009, 80(1): 250-256
13 Fontanals N, Borrull F, Marcé R M. TrACTrends Anal. Chem., 2012, 41: 15-26
14 RuizAceituno L, Sanz M L , Ramos L. TrACTrends Anal. Chem., 2013, 43: 121-145
15 Yang Q W, Xing H B, Su B G, Bao Z B, Wang J, Yang Y W, Ren Q L. AIChE J., 2013, 59(5): 1657-1667
16 Brinda Lakshmi A, Balasubramanian A , Venkatesan S. CLEANSoil, Air, Water, 2013, 41(4): 349-355
17 Zhou Q X, Gao Y Y, Xie G H. Talanta, 2011, 85(3): 1598-1602
18 Peng J F, Liu J F, Hu X L, Jiang G B. J. Chromatogr. A, 2007, 1139(1): 165-170
19 NIU Li, ZHANG QiXiang, XU XiaoYu. China. Patent, 200710055629, 2007
牛 利, 张齐贤, 许晓宇. 中国专利, 200710055629, 2007
20 GB/T 23296.162009, Food Contact MaterialsPolymerDetermination of 2,2bis(4Hydroxyphenyl) Propane(bisphenol A) in Food SimulantsHigh Performance Liquid Chromatography. National Standards of the Peoples Republic of China
食品模拟物中2,2二(4羟基苯基)丙烷(双酚A)的测定 高效液相色谱法. 中华人民共和国国家标准. GB/T 23296.162009
Abstract A simple and green method for the determination of trace bisphenol A(BPA) was established by coupling supported ionic liquid solid phase extraction to βcyclodextrin modified ionic liquid carbon paste electrodebased electrochemical detection (SILsSPEED). The synthesized imidazolium ionic liquid modified styrene type macroporous resin was used as adsorbent for SPE of BPA. The critical parameters that affect the extraction efficiency were optimized, including 0.4 g of packing material quantity, 200 mL of sample solution at pH 7.0, 5 mL of methanol as an eluent solvent, and 4.5 mL/min of the SPE flow rate. Dynamic adsorption test showed that the maximum adsorption capacity of BPA on the SILsSPE cartridge was 10.1 mg/g, and the enrichment factor was 40. The calibration curve showed a good linearity between the anodic current and the BPA concentration in the range of 1.0×10-1.0×10mol/L (i.e. 2.3-228 μg/L). The detection limit was 4.16×10mol/L (equal to 0.95 μg/L). The SILsSPEED method was applied to the analysis of water and plastic samples and the results agreed well with HPLC method.
Keywords Supported ionic liquids; Solid phase extraction; Ionic liquidbased carbon paste electrode; Bisphenol A; Electrochemical detection
(Received 8 September 2014; accepted 29 November 2014)
This work was supported by the National Natural Science Foundation of China (No.21375019), the Key Science & Technology Project of Fujian Province (No. 2011Y0038) of China, and the Science & Technology Project of China state Bureau of Quality Supervision and Quarantine (No. 2013IK103) and the National Science Foundation for Fostering Talents in Basic Research (No. J1103303)
