二氧化硫在脱钙后海水体系中的溶解平衡
2016-05-17谢英惠曹海楠赵颖颖袁俊生河北工业大学海洋科学与工程学院天津300130
谢英惠,曹海楠,赵颖颖,袁俊生(河北工业大学海洋科学与工程学院,天津 300130)
二氧化硫在脱钙后海水体系中的溶解平衡
谢英惠,曹海楠,赵颖颖,袁俊生
(河北工业大学海洋科学与工程学院,天津 300130)
摘要:CO2脱钙后海水与标准海水相比,具有更少的Ca2+和更多的HCO3−,理论上HCO3−可与SO2溶于水后产生的亚硫酸氢根反应,促进SO2的溶解。为此本文以N2为惰性载气,研究了1atm下,温度变化范围为34.0~63.9℃,SO2在标准海水、NaHCO3含量增多的海水以及钙离子减少的海水中的溶解性能,以期实现海水CO2脱钙与烟道气脱硫的耦合。结果表明SO2在标准海水中的溶解度随着温度的升高显著降低,且SO2溶解度的数值与温度呈近似线性关系;海水中HCO3−含量的增加会提高SO2在此水体系中的溶解度;而海水中钙离子的减少对SO2在此水体系中的溶解性能并无显著影响。因此与标准海水体系相比,CO2脱钙后海水体系对SO2具有更好的溶解性能,为利用CO2脱钙后海水进行烟气脱硫,从而实现海水脱钙与烟气脱硫的耦合提供了理论支持及基础数据。
关键词:脱钙海水;溶解性能;二氧化硫
第一作者:谢英惠(1958—),男,教授。E-mail yinghuix@126.com。联系人:赵颖颖,副教授。E-mail luckyzhaoyy@126.com。袁俊生,教授。E-mail jsyuan2012@126.com。
SO2是大气中的主要污染物之一,分布范围广,主要来源于煤、石油燃烧和含硫矿石的冶炼等,所以高效脱硫技术的开发对于控制SO2大气污染具有重要意义[1-3]。烟气脱硫是世界公认的最为经济、有效的减少及控制SO2排放的措施[4-5]。海水烟气脱硫技术是利用海水天然的酸碱缓冲能力及吸收酸性气体的能力脱除烟道气中SO2的一种湿法脱硫技术。海水脱硫技术已经相对成熟,对于沿海城市来说,在滨海电厂应用海水脱硫装置有广阔的前景[6-7]。此外,随着世界船舶总吨位的急剧增长、低质高硫分燃油的普遍使用,船舶废气中的硫氧化物亟待处理,而海水脱硫技术也可应用于海上船舶废气的处理[8-9]。在脱硫工厂设计和操作中,SO2在海水中的溶解度数据对于进一步优化海水脱硫工艺条件具有重要意义。目前海水脱硫还存在效率低的问题,因此研究提高海水中SO2溶解度迫在眉睫[10]。
国内外已有不少学者研究测量了不同条件下SO2在海水中的溶解度,DOUABUL等[11]研究了蒸馏水和除二氧化碳后海水中SO2的溶解性能;赵毅[12-13]、RODRIGUEZ-SEVILLA[14]、AL-ENEZI[15]等分别研究了不同温度和盐度的海水中SO2的溶解性能;王亮[16]测量了海水淡化副产浓海水和莱州湾沿岸地下卤水中SO2的溶解度;赵伟等[17]利用模拟方法研究了不同分压下SO2在海水中的溶解度。海水溶解和吸收SO2后会产生大量亚硫酸,使海水呈酸性且不稳定,而在酸性环境中易分解释放SO2,导致脱硫效率降低。碱性是影响海水吸收SO2的主要因素,因此可以通过适当增大海水的碱性以提高脱硫效率。王慧[18]考察了海水碱性对SO2溶解速率的影响,发现增加碱度的海水对SO2的吸收明显增强;也有研究表明在水中SO2和CO2的溶解度互相影响[19],而在海水中两者的溶解度影响并未涉及。本文作者[20]在前期利用烟道气中的CO2进行海水脱钙的研究过程中,发现CO2脱钙后海水中的HCO3−含量明显增加,这也导致了此海水体系的碱性增强,因此进一步研究了此海水体系对SO2溶解性能的影响。通过测量SO2在NaHCO3含量增大的海水以及钙离子减少的海水中的溶解性能,为海水CO2脱钙与烟气脱硫工艺耦合提供了理论基础,具有重要的现实意义及理论价值。
1 实验装置及实验方法
实验所用的标准海水参照文献[20]数据配制,具体配比如表1所示。实验所用恒温水浴锅控温误差为±0.1℃;SO2和N2气体浓度均为99.99%。海水中SO2的浓度用碘量法滴定。
实验装置如图1所示。实验装置搭建完成后,检查系统的气密性。实验装置先通入20min纯氮气(99.99%),然后通入SO2气体,气体先经过减压器减压后进入转子流量计(25~250mL/min),再经缓冲瓶进入SO2吸收装置。将吸收装置置于磁力搅拌恒温水浴锅中,控制反应温度及一定搅拌速度,出气口连接氢氧化钠溶液。
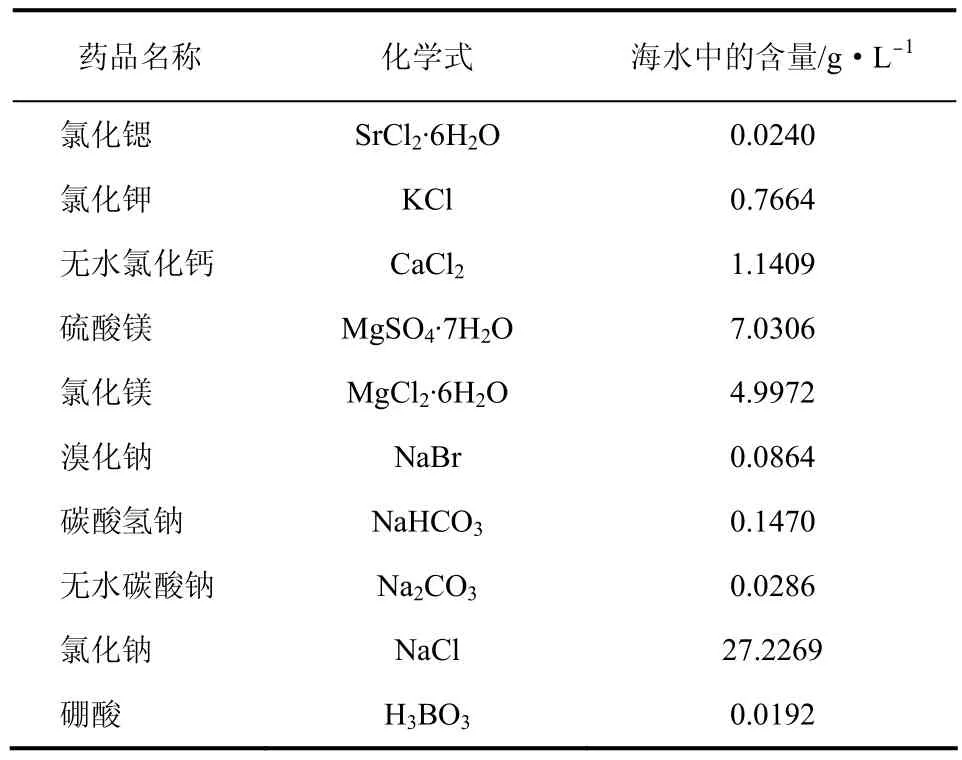
表1 标准海水的配制方法
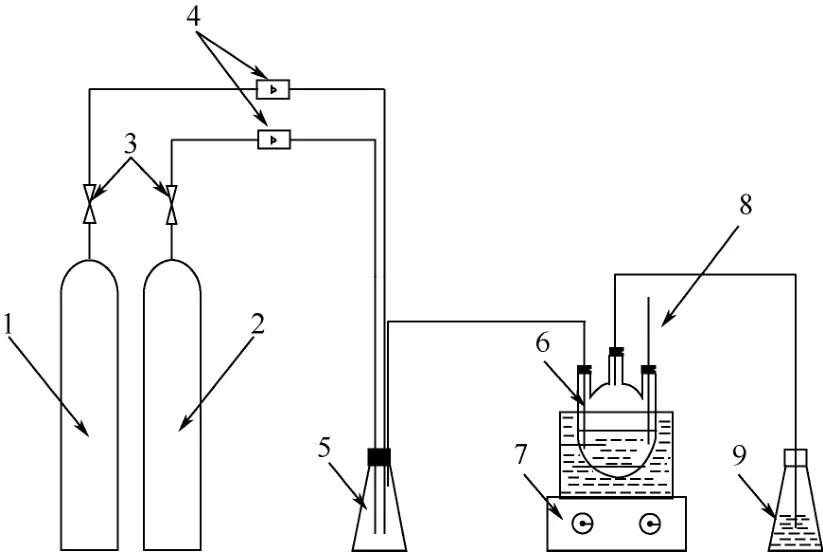
图1 SO2吸收系统装置
设定磁力恒温搅拌器的温度和转速,提前打开装置预热30min,三口烧瓶中装入200mL待测海水后置于恒温搅拌器内恒温1h,观察温度计示数,直至温度计示数能长时间维持恒定,并以此温度计示数为实验温度。此时开始通入气体,先通入20min纯氮气,然后通入SO2气体,每隔一定时间取样,测定海水中的SO2浓度以及海水pH值,直至海水中SO2浓度和海水pH值不再变化,此时SO2在海水中的溶解达到平衡,记录SO2的溶解数据。同一温度进行多次实验测量SO2溶解度,取平均值作为此温度下的SO2溶解度。
SO2在海水中的溶解度以吸收SO2后海水消耗碘的量计,其计算公式如式(1)所示。
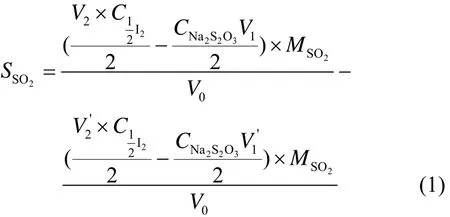
式中,SSO2为SO2在海水中的溶解度,g/L;V0为移取海水的体积(空白海水及反应后海水),mL;V1为通SO2后海水消耗Na2S2O3的体积,mL;V2为量取的碘液的体积,mL:;CNa2S2O3为Na2S2O3溶液的摩尔浓度,mol/L;MSO2为SO2的相对分子质量,g/mol;C½I2为碘标液的浓度,mol/L。
2 结果与讨论
2.1SO2在标准海水中的溶解度测定
为了考察温度对SO2在标准海水中的溶解性能的影响,本文实验部分测定了SO2在34.0~63.9℃的溶解度,如图2所示。可以看出,SO2在标准海水中的溶解度随着温度的提升显著降低,并且SO2的溶解度与温度呈近似线性关系。这是由于随着海水体系温度的增加,SO2的逸出速度随之加快,破坏并加速了碳酸型缓冲体系的结束以及亚硫酸缓冲体系的形成,从而使SO2在海水中的溶解度随温度的升高而降低。
图3(a)是不同温度下标准海水的pH值随SO2通入时间的变化曲线,如图所示,不同温度下标准海水的pH值变化趋势基本相同。反应初始时,溶液pH值快速下降,然后出现一个转折点,随即pH值下降趋势变缓,直至不变。图3(b)是截取0~40min内的海水pH值随时间的变化曲线,从图中的变化趋势可以看出,海水体系的pH值随着海水温度的增加下降速率有所增加,温度越高,pH值变化的转折点出现越早。标准海水pH值随时间的变化过程中有两个比较快的下降阶段。第一个阶段发生在0~2min内,pH值快速由8下降至2附近。这是因为SO2溶解在海水中会先与海水体系中的微量碱性成分发生反应,致使海水体系的pH值快速降低。之后海水的pH值较之前下降速度减慢是由于碳酸氢根以及碳酸根体系产生的缓冲作用;第二阶段发生在2~6min内,pH值由2附近下降至1附近,在这个阶段,海水体系中的HCO3−和CO32−完全反应,释放出CO2,海水体系中的缓冲体系由碳酸型转换成亚硫酸型,此时海水体系主要由亚硫酸氢根与亚硫酸根形成的新缓冲体系来调节海水pH值。海水体系的pH值由于新的缓冲体系的作用在6min以后下降缓慢,直至pH值不再变化,SO2溶解达到平衡。

图2 不同温度下SO2在标准海水的溶解度

图3 标准海水pH值随SO2通入时间的变化
2.2海水体系中HCO3−含量对SO2在海水中溶解度的影响
在前期烟道气海水脱钙的实验研究中发现,脱钙后海水中被脱除的钙离子被钠离子所替代,烟道气中的CO2溶于海水中部分形成了CO32−以脱除钙离子,但因CO2的溶解是一个两步电离过程,所以脱钙后的海水还存在大量的HCO3−。在传统的海水烟气脱硫过程中,需要通入CO2以利用其电离形成的HCO3−使SO2加速溶解电离。因此本实验通过改变海水中NaHCO3的含量以考察脱钙后海水中过量的HCO3−对SO2在海水中的溶解度影响。NaHCO3的加入量以海水中钙离子的摩尔量计,如式(2)。

式中,mNaHCO3为NaHCO3质量,g;mCaCl2为标准海水中CaCl2质量,g;MCaCl2为CaCl2相对分子质量,g/mol;i为CaCl2摩尔量的倍数,i=0.4,0.6,0.8;MNaHCO3为NaHCO3相对分子质量,g/mol。
图4为NaHCO3量增加的海水中SO2溶解度随温度的变化与标准海水中SO2溶解度对比图。如图4所示,改变NaHCO3量(i=0.4,0.6,0.8)后SO2在海水中的溶解度随温度的变化趋势与标准海水的相同,当温度升高时,SO2的溶解度降低。SO2在NaHCO3量为i=0.4的海水中的溶解度与标准海水中最为接近。随着i值的增大,SO2的溶解度明显增大,并且不同温度下均大于标准海水。推断原因如下:在SO2溶解于海水的过程中,主要受到海水体系中碱度、温度及盐度的影响。SO2刚开始溶解在海水体系时,主要是与海水中的微量碱性物质发生化学反应。同时,SO2溶于海水后,与海水中的HCO3−发生如式(3)的反应,使得SO2溶于海水的溶解平衡不断向右进行。而烟道气脱钙海水体系中碳酸氢根的量明显高于标准海水,所以有更多的SO2与HCO3−反应,从而加大了SO2在海水中的溶解能力,所以CO2脱钙海水体系因NaHCO3含量增大而具有更大的溶解SO2的性能。
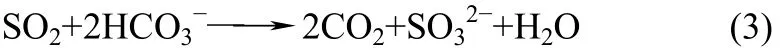
2.3钙离子量对SO2在海水中溶解度的影响
CO2脱钙后海水中碳酸氢根离子浓度增加,而钙离子浓度降低,因此需要考察钙离子的浓度变化是否对SO2在海水中的溶解性能造成影响。SO2在34.3℃不同钙离子含量的海水中溶解度如图5所示,SO2在海水中的溶解度随着钙离子去除量的增加几乎不变。主要是由于钙离子含量的改变几乎不改变海水的碱度及盐度,因此在SO2吸收过程中钙离子含量不影响SO2在海水中的溶解。

图4 HCO3−增加的海水中SO2溶解度随温度的变化

图5 钙离子减少的海水中SO2溶解度
3 结论
本文研究了1atm下SO2在标准海水体系、脱钙后海水体系HCO3−含量增大以及钙离子减少的3种海水体系中不同温度的溶解性能,得出以下结论。
(1)在SO2溶解于海水体系的过程中,SO2在海水中的溶解度随着温度增加而迅速下降。
(2)随着脱钙海水中HCO3−含量的增加,SO2在此海水体系中的溶解度大幅增加。
(3)脱钙海水中钙离子的浓度变化对SO2在海水体系中的溶解性能无影响。
研究表明,与标准海水体系相比,CO2脱钙后海水体系对SO2具有更好的溶解性能,这为用CO2脱钙后海水再进行海水烟气脱硫实现海水脱钙与海水烟气脱硫的耦合提供了理论支持及基础数据;同时为烟道气的固碳和脱硫开辟了新的途径。
参考文献
[1]蒋文举,赵群科,尹华强,等. 烟气脱硫脱硝技术手册[M]. 北京:化学工业出版社,2007.
[2]杨风. 二氧化硫减排技术与烟气脱硫工程[M]. 北京:冶金工业出版社,2004.
[3]肖文德,吴志泉. 二氧化硫脱除与回收[M]. 北京:化学工业出版社,2001.
[4]SRIVASTAVA R K,JOZEWICZ W,SINGER C. SO2scrubbing technologies:a review[J]. Environmental Progress,2001,20(4):219-228.
[5]王思粉,冯丽娟,李先国. 浅析我国海水烟气脱硫技术及改进[J].热力发电,2011,40(1):4-7.
[6]张佩,冯丽娟,张静伟,等. 烟气海水脱硫工艺技术基础研究及工业应用发展现状[J]. 化工进展,2009,28(s1):267-271.
[7]李枭鸣,王圣,姜艳靓,等. 沿海燃煤电厂采用海水脱硫的环境影响适用性分析研究[J]. 环境科学与管理,2015,40(1):94-97.
[8]GAIAZZO G,LANGELLA G,MICCIO F,et al. An experimental investigation on seawater SO2scrubbing for marine application[J]. Environmental Progress & Sustainable Energy,2012,32(4):1179-1186.
[9]刘万鹤. 海水脱硫技术在船舶柴油机排气中的应用[J]. 中国航海,2013,36(2):109-113.
[10]DARAKE S,RAHIMI A,HATAMIPOUR M S,et al. SO2removal by seawater in a packed-bed tower:experimental study and mathematical modeling[J]. Separation Science and Technology,2014,49(7):988-998.
[11]DOUABUL A,RLLEY J. Solubility of sulfur dioxide in distilled water and decarbonated seawater[J]. Chem. Eng. Data,1979,24:274.
[12]赵毅,张琼,陈颖敏,等. 海水烟气脱硫实验研究[J]. 华北电力大学学报,1999,26(2):80-84.
[13]ZHAO Y,MA S,WANG X,et al. Experimental and mechanism studies on seawater flue gas desulfurization[J]. Journal of Environmental Sciences,2003,15(1):123-128.
[14]RODRIGUEZ-SEVILLA J,ALVAREZ M,DIAZ M C,et al. Absorption equilibria of dilute SO2inseawater[J]. J. Chem. Eng. Data,2004,49(6):1710-1716.
[15]AL-ENEZI G,ETTOUNEY H,EL-DESSOUKY H,et al. Solubility of sulfur dioxide in seawater[J]. Industrial&Engineering Chemistry Research,2001,40:1434-1441.
[16]王亮. 海水体系对二氧化硫吸收性能研究[D]. 青岛:中国海洋大学,2007.
[17]赵伟,彭乔. 二氧化硫在海水中的溶解性研究[J]. 热力发电,2009,38(4):35-38.
[18]王慧. 海水烟气脱硫及其动力学研究[D]. 青岛:中国海洋大学,2008.
[19]MIRI R,AAGAARD P,HELLEVANG H. Examination of CO2-SO2solubility in water by SAFT1. implications for CO2transport and storage[J]. Phys. Chem. B,2014,118(34):10214-10223.
[20]ZHAO Y Y,YUAN J S,ZHANG J J,et al. A different approach for seawater decalcification pretreatment using carbon dioxide as precipitator[J]. Desalination,2013,322(1):151-158.
Solubility equilibrium of SO2in the decalcified seawater
XIE Yinghui,CAO Hainan,ZHAO Yingying,YUAN Junsheng
(School of Marine Science and Engineering,Hebei University of Technology,Tianjin 300130,China)
Abstract:Compared with normal seawater,the content of HCO3−in the seawater of calcium removed using CO2is higher. Because HCO3−can react with hydrogen sulfite produced by sulfur dioxide dissolving in water,which in return helps increase the solubility of sulfur dioxide. Therefore,the effect of the amount of HCO3−and Ca2+on the solubility of sulfur dioxide in seawater was studied at temperatures of 34.0—63.9℃ with N2as inert carrier gas and under 1atm. The results showed that the solubility of SO2in standard seawater significantly reduced linearly with increasing temperature. The increase of HCO3−ion concentration in demineralized seawater will enhance the solubility of SO2in water. But there is no significant effect of the reduction of Ca2+ion concentration on the SO2solubility within the studied scope. It can be concluded that sulfur dioxide shows a better dissolution performance in the seawater decalcified by CO2than in the standard seawater,and this study provides a theoretical support to the coupling of flue gas desulfurization and seawater decalcification using CO2.
Key words:decalcified seawater;solubility;sulfur dioxide
中图分类号:TQ 132.2
文献标志码:A
文章编号:1000–6613(2016)04–1012–05
DOI:10.16085/j.issn.1000-6613.2016.04.007
收稿日期:2015-11-02;修改稿日期:2015-12-31。
基金项目:国家“十二五”科技支撑计划(2015BAB09B00)、国家自然科学基金(21306037)、天津市自然科学基金(13JCQNJC05600、14JCYBJC20700)及河北省高层次人才资助项目(C2013003041)。
