乙酸乙酯酯缩合法合成乙酰乙酸乙酯的热力学分析
2016-05-17李丹丁同梅田恒水
李丹,丁同梅,田恒水
(华东理工大学化工学院,上海200237)
乙酸乙酯酯缩合法合成乙酰乙酸乙酯的热力学分析
李丹,丁同梅,田恒水*
(华东理工大学化工学院,上海200237)
用Benson基团贡献法和Joback法对乙酸乙酯酯缩合法生成乙酰乙酸乙酯反应的焓变,吉布斯自由能和反应平衡常数进行了计算与分析。结果显示,在25~240℃内,反应的焓变均为正,说明此反应为吸热反应,随着反应温度的升高吸热量减少;反应的吉布斯自由能一直为正,理论上是不能自发进行的;该反应的平衡常数很小,但是随着温度的升高,平衡常数相应有所增大。要使反应顺利进行需加入适当的催化剂,而为了提高反应的转化率,可以采取升高反应温度,或在反应过程中移走生成物的手段使反应不断向所需方向进行。
乙酰乙酸乙酯;合成;乙酸乙酯;酯缩合;热力学;基团贡献法;Joback法
乙酰乙酸乙酯(ACE)是重要的精细有机化工原料,广泛应用于医药、聚酯、染料及香料等行业[1]。目前,ACE的工业生产方法主要为双乙烯酮法[2],用浓硫酸催化双乙烯酮与无水乙醇酯化合成乙酰乙酸乙酯,工艺流程较长,后期处理复杂,能耗高,对环境污染较大。
用Claisen酯缩合方法制备ACE,以乙酸乙酯(EA)为原料,乙醇钠为催化剂,采用反应精馏过程强化技术,促进EA自身酯缩合生成ACE,副产物只有乙醇,可实现清洁生产,原子利用率也较高,顺应绿色化工的趋势。然而,对ACE热力学计算少有分析总结。因此,本文基于基团贡献法计算了ACE的ΔHf0、S0和Cp0等热力学数据,并从热力学上对该反应可行性进行了分析。
在催化剂存在下,含有α-H的EA中羰基碳进行缩合,脱去一分子乙醇得到ACE,反应方程式如下:

通过对此工艺的研究发现,该反应体系在乙醇钠为催化剂[3]的条件下效果较好,且必须控制适当的反应温度,反应温度过低或者催化剂不当则反应转化率和选择性将很低;反应温度过高则产物ACE会发生分解生成相当量的副产物去水乙酸[4]。
1 热力学数据
1.1 理想气体状态下生成热和绝对熵的估算
298K时各物质的标准摩尔生成热ΔHf,g0和绝对熵Sf,g0采用Benson基团贡献法[5-7]估算,计算式如下:

各基团的Hi和Si贡献值查表[8]可知。乙酸乙酯、乙酰乙酸乙酯、乙醇的对称数分别是9、9、3,所涉及的组分均无光学异构。Benson法的估算误差很小,如298K下乙醇的文献值[9]为ΔHf,g0=-235.1 kJ/mol,Sf,g0=282.7 J/(mol·K),估计值的误差仅分别为0.13%和0.64%。
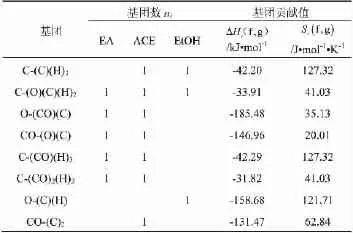
表1Benson法基团贡献值(298K)

表2 298K理想气体时各物质的和
1.2 理想气体热容的估算
要计算不同温度下各组分的生成热,需要不同温度下的热容。Benson法提供了不同温度下各个基团的热容数据,但是数据较少,温度间隔太大,而Joback法通过估算给出一个热容与温度的关系式,可以计算一定范围内任意温度下的热容值,如式(3)。


表3Joback法基团贡献值
Joback法各基团对热容的贡献值如表3所示。利用表3中数据及公式(3),可以得到各物质的气相热容与温度T的关系式。
乙酸乙酯:

乙酰乙酸乙酯:

乙醇:

1.3 汽化热的估算
本实验涉及原料及产物均为液体状态,即体系为液态均相体系,要计算各组分液态下的生成热,需要各组分在对应温度下的汽化潜热。首先根据基团贡献法计算正常沸点下的蒸发热ΔHb,采用马沛生的方法(基团贡献值见表4)计算式如下:

然后利用Watson经验方程求得气化热与温度的关系:

其中,碳酸二乙酯、乙酰乙酸乙酯与丙二酸二乙酯的临界温度(Tc)的估算,采用MXXC法:

式(5)中需要的各物质的n可以采用Viswanath和Kuloor建议的方程计算:


表4Tc和ΔHb的基团贡献值
通过计算可得到相关物质的汽化热ΔHv(T)与温度的关系式如下:
乙酸乙酯:

乙酰乙酸乙酯:

乙醇:

2 化学平衡常数的估算
根据各物质的热力学数据计算了不同温度下的反应热和平衡常数,进而分析反应的平衡转化率。反应中所有物质任意温度下的液相生成和绝对熵由式(8)~(9)计算[10]:

再通过式(10)~(13)计算反应焓ΔrH、熵变ΔrS、吉布斯自由焓变ΔrG以及平衡常数Kp:

3 结果与讨论
由式(8)~(13)可计算出此反应反应热ΔrH、反应熵ΔrS及反应吉布斯自由能ΔrG随温度的变化,同时列出了不同温度下平衡常数KP,结果如表5所示。

表5 不同温度下反应的ΔrH、ΔrS、ΔrG以及平衡常数Kp
由计算结果可知,在25~240℃内,反应的焓变均为正,说明此反应为吸热反应,随着反应温度的升高吸热量减少;反应的吉布斯自由能一直为正,理论上是不能自发进行的;由表5也可知,该反应的平衡常数很小,但是随着温度的升高,平衡常数相应有所增大。
通过以上分析可知,要使反应顺利进行需加入适当的催化剂;为了提高反应的转化率,可以采取升高反应温度,或在反应过程中移走生成物的手段使反应不断向所需方向进行。通过实验研究发现,以乙醇钠为催化剂,二甲苯为溶剂,采用反应精馏强化脱除乙醇促进反应的发生,在120℃反应4 h,乙酸乙酯转化率可达到83.19%,乙酰乙酸乙酯的选择性为46.84%。
[1]高洪建,余中心.抗菌药中间体开发进展[J].精细化工中间体,2001,31(2):1-6.
[2]金栋.双乙烯酮的生产和应用[J].四川化工与腐蚀控制.2001,4(3):35-38.
[3]何广科,陈山,马鸿飞,等.克莱森酯缩合反应中碱性试剂作用的探讨[J].化学教育,2014,(10):57-59.
[4]郑祖彪,寒冰冰,张东东.乙酰乙酸乙酯制备实验的改进[J].黄山学院学报,2014,16(3):42-45.
[5]王贺玲,王杲,何鑫凯,等.DMC与苯胺合成苯氨基甲酸甲酯的热力学分析[J].天然气化工·C1化学与化工,2008,33(1):70-74.
[6]王桂荣,赵新强,王延吉.合成甲苯2,4-二氨基甲酸甲酯反应体系的热力学分析[J].化学工业与工程,2005,22 (1):8-13.
[7]Cohen N,Benson S W.Estimation of heats of formation of organic compounds by additivity methods[J].Chem Rev, 1993,93:2419-2438.
[8]卢焕章,等.石油化工基础数据手册[M].北京:化工出版社,1984.
[9]马沛生.化工数据[M].北京:中国石化出版社,2003.
[10]胡英,吕瑞东,刘国杰,等.物理化学[M].第四版.北京:高等教育出版社,1999.
Thermodynamics analysis of ethyl acetoacetate synthesis from ethyl acetate by ester condensation
LI Dan,DING Tong-mei,TIAN Heng-shui
(Department of Chemical Engineering,East China University of Science and Technology,Shanghai 200237,China)
The formation enthalpy,Gibbs free energy and equilibrium constant for the reaction of ethyl acetate condensation to ethyl acetoacetatewere estimated by Benson group contribution method and Joback method.The results showed that,in 25 to 240℃, the formation enthalpy is positive,which indicated that the reaction is endothermic,and the heat absorption capacity decreases with the rise of temperature;the Gibbs free energy is positive,which indicated the reaction could not occur spontaneously;and the equilibrium constant is small but increases with the rise of temperature.So it required adding suitable catalysts to let the reaction take place smoothly,raising the reaction temperature to increase the conversion,or removing the products from the reaction system to promote the positive reaction.
ethyl acetoacetate;synthesis;ethyl acetate;ester condensation;thermodynamics;group contribution method;Joback method
TQ203.3;TQ225.24
A
1001-9219(2016)02-12-03
2015-05-07;作者简介:李丹(1989-),女,硕士研究生,电邮lidan1211@163.com;*联系人:田恒水,教授,博导,电话021-64252198,电邮hstian@ecust.edu.cn。
