痰涂片镜检在涂阳肺结核患者随访中的准确性研究
2016-05-16夏辉陈丽柳正卫李发滨王晓萌赵雁林
夏辉 陈丽 柳正卫 李发滨 王晓萌 赵雁林
痰涂片镜检在涂阳肺结核患者随访中的准确性研究
夏辉 陈丽 柳正卫 李发滨 王晓萌 赵雁林
目的 以MTB分离培养的结果为参考,探讨痰涂片镜检在涂阳肺结核随访患者中的疗效监测及评估其准确性。方法 纳入2010年1月至2011年7月黑龙江省和浙江省各2个县(市)787例涂阳肺结核患者。收集经标准化抗结核药物治疗至2个月末的679例随访患者痰标本,开展MTB痰涂片镜检和分离培养。以MTB分离培养的结果为参考,对有培养结果的670例患者计算痰涂片镜检用于疗效监测的敏感度和特异度,以评估痰涂片镜检对疗效监测的准确性。结果 679例随访患者抗结核药物治疗2个月末,痰涂片镜检结果有522例(76.9%)发生阴转,其中初治患者454例(454/578,78.5%)痰涂片镜检阴转,高于复治患者[68例(68/101,67.3%)],二者差异有统计学意义(χ2=6.09,P=0.014)。670例患者治疗至2个月末分离培养结果有582例(86.9%)阴性,其中初治患者502例(502/569,88.2%),复治患者80例(80/101,79.2%),二者分离培养阴转率的差异有统计学意义(χ2=6.11,P=0.013)。以分离培养结果为参考标准,治疗至2个月末痰涂片镜检的敏感度和特异度分别为69.3%(61/88,95%CI:59.7%~78.9%)和83.7%(487/582,95%CI:80.7%~86.7%)。其中,初治患者的敏感度和特异度分别为64.2%(43/67,95%CI:52.7%~75.7%)和84.1%(422/502,95%CI:80.9%~87.3%);复治患者分别为85.7%(18/21,95%CI:70.7%~100.0%)和81.3%(65/80,95%CI:72.8%~89.8%);治疗至2个月末痰涂片镜检对初治与复治患者疗效监测的敏感度、特异度差异均无统计学意义(χ2=3.28,P=0.070;χ2=0.40,P=0.527)。结论 在结核病治疗过程中应用痰涂片镜检进行疗效监测的敏感度和特异度均较低,应结合分离培养技术提高其准确性。
结核,肺; 痰/显微镜检查; 细菌学技术; 治疗结果; 评价研究
我国目前主要依赖于痰涂片镜检进行肺结核的诊断与随访时的疗效监测。以往研究显示抗结核药物治疗前痰涂片镜检的敏感度较低,约为40%~80%[1-2],但特异度较高接近100%[3-4],因此可用于肺结核的诊断。但由于痰涂片镜检方法既能检测活菌,也能够检测到被药物杀死的结核分枝杆菌,即患者虽抗结核治疗有效,但由于痰标本中会存在少量死菌,导致痰涂片镜检结果仍为阳性,因此利用痰涂片镜检作为抗结核治疗的疗效监测可能无法准确反映其真实疗效,而且目前对其疗效监测的准确性在国内研究也很少[5-6]。本研究在基层结核病医疗机构以结核分枝杆菌分离培养为参考标准,分别收集确诊涂阳肺结核患者在按照标准化抗结核药物治疗方案[7]治疗至2个月末的晨痰和夜间痰各1份进行痰涂片镜检,检测其在抗结核治疗中疗效监测的准确性,以评价患者的治疗效果[7]。
资料和方法
1.患者一般资料:纳入2010年1月至2011年7月黑龙江省五常市、双城市及浙江省常山县、浦江县4个县(市)的787例痰涂片镜检阳性的活动性肺结核患者。收集患者年龄、性别、治疗史、初诊时及按照标准抗结核药物治疗至2个月末的胸部X线摄影资料。纳入患者年龄10~88岁,平均年龄为(46.8±18.4)岁;男557例(70.8%),女230例 (29.2%);初诊时患者的MTB分离培养结果有13例(1.6%)发生污染,730例(92.8%)培养阳性,44例(5.6%)培养阴性;787例患者经标准化抗结核药物治疗至2个月末,有88例患者未按要求返回进行随访,20例患者返回随访但未采集到痰标本;故共收集679例随访患者痰标本,开展MTB痰涂片镜检和分离培养,排除分离培养污染的9例患者,对有培养结果的670例患者进行痰涂片镜检,并进行疗效监测准确性的分析。
2.实验室检测方法:采集初诊患者就诊时的3份痰标本(即时痰、夜间痰、晨痰)和随访患者的2份痰标本(夜间痰、晨痰)进行MTB痰涂片镜检[7]。前者用于肺结核诊断,后者用于监测患者对抗结核药物治疗的效果。每例患者至少选取一份痰标本进行MTB分离培养。痰涂片镜检采用萋-尼染色[8],MTB分离培养采用简单法[9]。
3.统计学分析:采用Excel进行数据录入,SPSS 17.0软件进行数据整理和分析。构成比、阴转率、特异度、敏感度的比较采用卡方检验或Fisher精确检验,以P<0.05为差异有统计学意义。
结 果
1.纳入涂阳肺结核患者的痰涂片阳性级别分布:787例纳入患者的的痰涂片阳性级别见表1,其中涂片结果为“+”者最高[324例(41.2%)]。初、复治患者“++++”级别所占比率差异有统计学意义(χ2=6.27,P=0.012),其他阳性级别差异均无统计学意义(P值均>0.05)。
2.纳入涂阳肺结核患者的MTB痰涂片镜检与分离培养的结果分析:787例患者初诊时进行分离培养,13例(1.6%)发生污染,730例(92.8%)阳性,44例(5.6%)阴性。培养阴性的患者随着痰涂片镜检阳性级别的升高,分离培养阴性的例数也逐渐降低,有29例(65.9%)发生在痰涂片镜检结果为1~8条/300视野和“+”级别,仅有2例(4.5%)发生在涂片结果为“++++”级别(表2)。
3.抗结核药物治疗至2个月末痰涂片镜检与MTB分离培养的结果分析:按照标准化抗结核药物治疗方案治疗至2个月末,收集到679例随访患者的痰标本,522例(76.9%)痰涂片镜检发生阴转,其中初治患者454例(454/578,78.5%)痰涂片镜检阴转,复治患者68例(68/101,67.3%)阴转(表3)。初治患者治疗至2个月末痰涂片镜检阴转率高于复治患者,二者差异有统计学意义(χ2=6.09,P=0.014)。

表1 纳入时涂阳肺结核患者的痰涂片阳性级别在初治、复治患者中的分布

表2 774例肺结核患者痰涂片镜检与分离培养结果
注a:除去13例分离培养发生污染的菌株
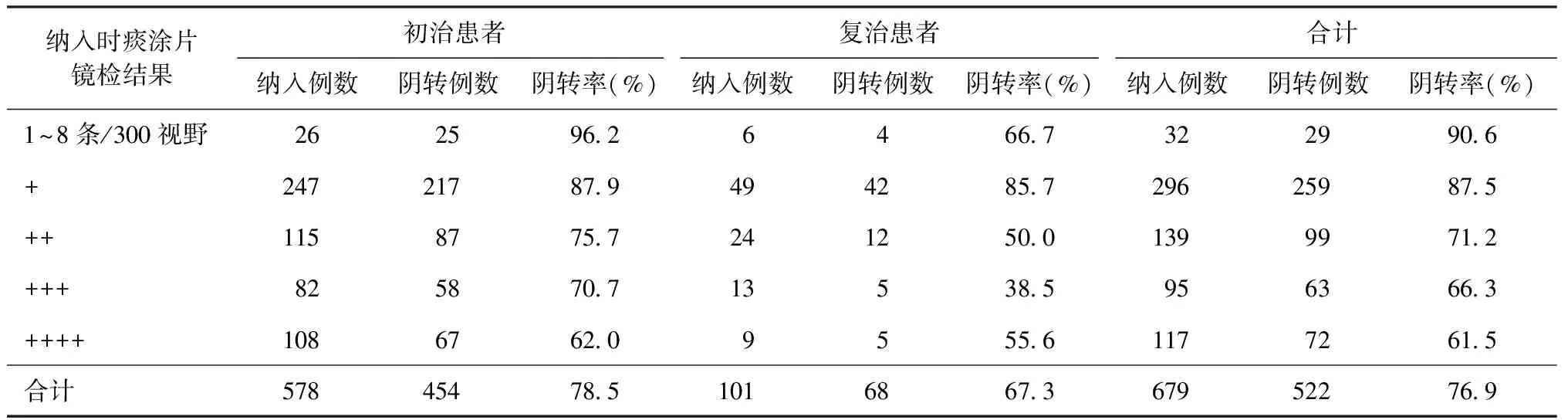
表3 679例患者抗结核药物治疗至2个月末的痰涂片镜检阴转情况
按照标准化抗结核治疗方案治疗至2个月末,收集679例随访患者的痰标本,分离培养时9例(1.3%)发生污染,其他670例患者有分离培养结果。其中582例(86.9%)分离培养阴性,初治患者有502例(502/569,88.2%),复治患者80例(80/101,79.2%),二者分离培养阴转率的差异有统计学意义(χ2=6.11,P=0.013)。治疗至2个月末分离培养阴转率(86.9%)高于痰涂片镜检阴转率(76.9%),且差异具有统计学意义(χ2=22.63,P<0.001)。不同痰涂片镜检阳性级别与初、复治肺结核患者在抗结核药物治疗至2个月末时分离培养结果见表4。
4.抗结核药物治疗至2个月末的痰涂片镜检效能及准确性分析:679例随访患者中,除去9例分离培养发生污染的患者,对有培养结果的670例患者进行分析。以分离培养结果为参考标准,在抗结核治疗中痰涂片镜检在监测疗效时的敏感度为69.3%(61/88,95%CI:59.7%~78.9%),特异度为83.7%(487/582,95%CI:80.7%~86.7%)。其中初治患者中,痰涂片镜检在监测疗效时的敏感度和特异度分别为64.2%(43/67,95%CI:52.7%~75.7%)和84.1%(422/502,95%CI:80.9%~87.3%),复治患者中痰涂片镜检在疗效监测时的敏感度和特异度分别为85.7%(18/21,95%CI:70.7%~100.0%)和81.3%(65/80,95%CI:72.8%~89.8%)。初、复治患者痰涂片镜检在疗效监测时的敏感度、特异度差异均无统计学意义(χ2=3.28,P=0.070;χ2=0.40,P=0.527)。详见表5。
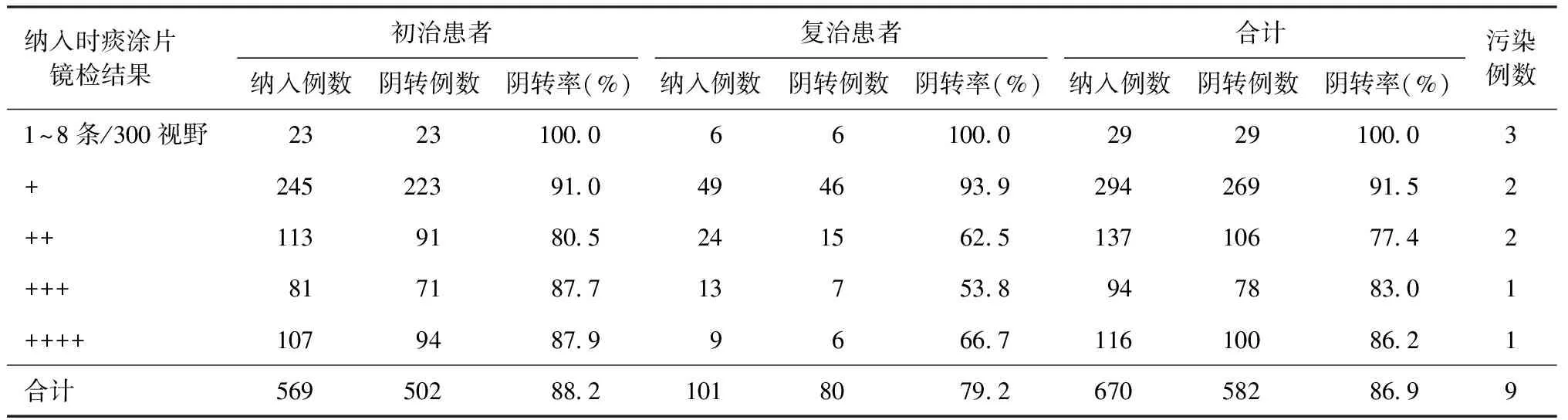
表4 670例患者抗结核药物治疗至2个月末的分离培养阴转情况
注 治疗2个月末分离培养发生污染者均为初治患者

表5 670例患者抗结核药物治疗至2个月末的痰涂片镜检效能及准确性分析
注 敏感度=痰涂片镜检阳性(包含1~8条/300视野,+,++,+++,++++)并分离培养阳性患者例数/分离培养阳性患者例数×100%;特异度=痰涂片镜检阴性并分离培养阴性患者例数/分离培养阴性患者例数×100%
讨 论
规范化的抗结核药物治疗及定期疗效随访对于肺结核的控制非常重要。痰涂片镜检是一种快速、简便、价格低廉的结核病实验室检测技术,其能够通过菌量多少检测出有传染性的患者。在我国,萋-尼染色痰涂片镜检方法是肺结核诊断及抗结核药物治疗疗效监测的主要手段,但痰涂片镜检无法区分死菌和活菌,因此用于疗效监测有一定的局限性。本研究参照检测活菌的分离培养技术结果,探讨了痰涂片镜检在疗效监测时的准确性。
本研究纳入不同痰涂片阳性级别的活动性肺结核患者,在抗结核药物治疗前患者分离培养的阳性率为92.8%(730/787),污染率为1.7%(13/787),达到分离培养质量控制关于涂阳培阳比例及污染率的要求[9],证明研究中分离培养的质量是可信的。研究结果显示随着痰标本含菌量的增加,分离培养阳性率也逐渐增高,由1~8条/300视野时的81.8%提高至“++++”时的98.5%。而分离培养阴性集中于痰涂片阳性级别较低即含菌量少的患者,可能是使用4%NaOH进行培养前处理时将少量细菌灭活;也有可能是患者在本次就诊前使用过对结核分枝杆菌有疗效的药物,如氨基糖苷类药物、氟喹诺酮类药物等,需要进一步研究患者的治疗史以明确原因。
纳入患者按照标准化抗结核治疗方案治疗至2个月末,分离培养阴转率(85.7%)显著高于痰涂片镜检阴转率(76.9%),差异有统计学意义(χ2=22.63,P<0.001),提示日常采用痰涂片镜检作为疗效监测时部分患者虽然涂片镜检为阳性,但检测到的抗酸杆菌可能为药物治疗后的死菌,因此单纯用痰涂片镜检作为治疗中疗效监测会影响疗效判断的准确性。且初治和复治患者间的痰涂片镜检阴转率(78.5%和67.3%)和分离培养阴转率(88.2%和79.2%)差异均有统计学意义(χ2=6.09,P=0.014;χ2=6.11,P=0.013)。与分离培养相比较,在治疗至2个月末时痰涂片镜检的敏感度(69.3%)和特异度(83.7%)均较低,提示部分患者治疗有效即培养已经阴转,但是利用痰涂片镜检时结果仍可能为阳性,说明痰涂片镜检作为疗效监测有一定局限性。本研究治疗至2个月末时痰涂片镜检敏感度与其他研究的数据接近[1-2,10],但是特异度远远低于之前报道的在抗结核药物治疗前获得的数据[3-4],却高于Su等[10]研究的涂阳肺结核患者抗结核药物治疗至2个月末痰涂片镜检的特异度(69.9%)。抗结核治疗过程中痰涂片镜检敏感度低可能是由于肺结核患者经过有效的抗结核药物治疗后,痰标本中的菌量会减少,从而降低痰涂片镜检的敏感度。同样,经过有效的抗结核治疗后,痰标本中会存在一定量的死菌和混杂的非结核分枝杆菌,而分离培养仅能检测活的结核分枝杆菌,因而可能降低疗效监测时痰涂片镜检的特异度;其次,分离培养也存在假阴性问题,即痰涂片中存在活菌但分离培养时未检测到,也是造成痰涂片镜检与之比较特异度低的另一可能原因;另外,本研究采用的是固体培养,固体培养阳性检出率低于液体培养阳性检出率[11],如使用液体培养可能会提高痰涂片镜检的特异度。
本研究中分离培养阴性但痰涂片镜检阳性者有95例,比较这95例患者治疗前与治疗至2个月末的胸片,显示91例(95.8%)患者在治疗至2个月末时胸片表现均有改善,仅有4例变化不明显,提示91例患者的痰涂片镜检阳性可能是由于痰标本中存在大量死菌所致(即假阴性);进一步分析这95例患者的涂片结果,笔者发现1~8条/300视野为15例(15.8%),“+”为55例(57.9%),“++”为22例(23.2%),“+++”与“++++”仅有3例(3.2%),可见,治疗至2个月末痰涂片镜检仍为阳性的患者大部分涂片结果为低阳性级别。因此,在临床实际应用中,若发现治疗至2个月末涂片镜检未阴转但阳性级别较低且胸片表现有明显改善者,应考虑为痰标本中很可能有大量死菌,可认为治疗有效。
本研究也存在一定局限性,首先纳入的复治患者例数较少,因此在比较初复治患者MTB痰涂片镜检与分离培养的效能时准确度较差;其次未对纳入患者进行治疗结束后的随访和分析,因此未能评估疗程结束后的痰涂片镜检在疗效监测方面的准确性。希望未来扩大样本量及进行疗程结束后的相关研究,进一步评价痰涂片镜检在疗效监测中的作用。
我国大部分实验室,特别是基层医疗机构实验室广泛应用痰涂片镜检进行随访时的疗效监测,但本研究结果提示,应用痰涂片镜检进行疗效监测时存在一定局限性,患者治疗至2个月末的镜检结果与分离培养法的一致性较低,需要引起广大基层医务人员的注意。虽然有很多新型的基于分子生物学的结核病实验室检测技术出现,但是大部分新型技术是通过检测结核分枝杆菌核酸的方法,而通过检测核酸的技术同样无法区分死菌或活菌,因此,在抗结核药物治疗过程中这些新技术仍旧无法用于疗效监测。由于分离培养可直接检测到活菌,在判断疗效方面准确性更高。“十二五”结核病防治规划实施之后,我国开展分枝杆菌分离培养的实验室数目逐渐增多,因此,有条件的实验室在患者抗结核药物治疗过程中应结合分离培养检测结果来进行评价,以提高疗效监测的准确性。
[1] Bruchfeld J, Aderaye G, Palme IB, et al. Sputum concentration improves diagnosis of tuberculosis in a setting with a high prevalence of HIV. Trans R Soc Trop Med Hyg, 2000,94(6):677-680.
[2] Apers L, Mutsvangwa J, Magwenzi J, et al. A comparison of direct microscopy, the concentration method and the Mycobacteria Growth Indicator Tube for the examination of sputum for acid-fast bacilli.Int J Tuberc Lung Dis,2003,7(4):376-381.
[3] Chakravorty S, Dudeja M, Hanif M, et al. Utility of universal sample processing methodology, combining smear microscopy, culture, and PCR, fordiagnosis of pulmonary tuberculosis. J Clin Microbiol,2005, 43(6):2703-2708.
[4] Fodor T. Detection of mycobacteria in sputum smears prepared by cytocentrifugation and sedimentation. Tuber Lung Dis, 1995, 76(3):273-274.
[5] 邓闯.1171份痰标本结核分枝杆菌涂片镜检与培养结果分析. 慢性病学杂志, 2013,14(2):112-114.
[6] 李国红,苗润青,贾艳辉,等.1284份痰标本分枝杆菌涂片镜检与培养结果分析.中国防痨杂志,2011, 33(8):492-495.
[7] 肖东楼,赵明刚,王宇.中国结核病防治规划实施工作指南. 北京: 中国协和医科大学出版社, 2009.
[8] 肖东楼,王文杰,许绍发,等.中国结核病防治规划痰涂片镜检标准化操作程序及质量保证手册.北京:中国协和医大学出版社,2008.
[9] 赵雁林,王黎霞,成诗明,等. 中国结核病防治规划分枝杆菌分离培养标准化操作程序集质量保证手册. 北京: 人民卫生出版社,2013.
[10] Su WJ, Feng JY, Chiu YC,et al. Role of 2-month sputum smears in predicting culture conversion in pulmonary tuberculosis. Eur Respir J, 2011,37(2):376-383.
[11] 宋媛媛,夏辉,赵雁林.几种液体分支杆菌分离培养方法的多中心应用评估.医学研究杂志,2013,42(1):30-32.
(本文编辑:孟莉 范永德)
Study on accuracy of sputum smear microscopy for assessment of treatment response among smear positive pulmonary tuberculosis patients
XIAHui*,CHENLi,LIUZheng-wei,LIFa-bin,WANGXiao-meng,ZHAOYan-lin.
*NationalTuberculosisReferenceLaboratory,NationalCenterforTuberculosisControlandPrevention,ChineseCenterforDiseaseControlandPrevention,Beijing102206,China
ZHAOYan-lin,Email:zhaoyanlin@chinatb.org
Objective By comparing with culture results ofMycobacteriumtuberculosis(MTB), to evaluate the performance of smear microscopy on assessment of response to anti-tuberculosis (TB) treatment in patients with smear-positive pulmonary TB. Methods A total of 787 smear-positive pulmonary TB patients were recruited during the period from January 2010 to July 2011 in four counties in Heilongjiang and Zhejiang provinces. The sputum specimens were collected from 679 patients who completed 2 months of standardized anti-TB treatment and then culture and smear microscopy were performed to all specimens. The sensitivity and specificity of smear microscopy for monitoring the response to anti-TB treatment were determined by comparing with the culture results of 670 patients whose culture results were obtained. Results Out of 679 patients, 522 (76.9%) cases were smear microscopy converted. The proportion of smear microscopy conversion was 78.5% (454/578) among new cases, which was significantly higher than that among previously treated cases (67.3% (68/101)) (χ2=6.09,P=0.014). Among 670 cases with culture results at the end of 2 months of treatment, 582 (85.7%) cases were culture converted. The culture conversion rate among new cases (502/569, 88.2%) was significantly higher than that (80/101, 79.2%) among previously treated cases (χ2=6.11,P=0.013). The sensitivity and specificity of smear microscopy for monitoring the response to anti-TB treatment at the end of 2 months of treatment were 69.3% (61/88, 95%CI, 59.7%-78.9%) and 83.7% (487/582, 95%CI, 80.7%-86.7%) respectively in comparison with culture. The sensitivity and specificity of smear microscopy among new cases were 64.2% (43/67, 95%CI: 52.7%-75.7%) and 84.1% (422/502, 95%CI: 80.9%-87.3%) respectively while the sensitivity and specificity among previously treated cases were 85.7% (18/21, 95%CI: 70.7%-100.0%) and 81.3% (65/80, 95%CI: 72.8%-89.8%) respectively. There were no significant difference for both sensitivity and specificity of smear microscopy on assessment of response to anti-TB treatment between new cases and previously treated cases (χ2=3.28,P=0.070;χ2=0.40,P=0.527). Conclusion Smear microscopy has lower sensitivity and specificity when it is used to assess the treatment response during the course of anti-TB treatment and the accuracy can be improved in combination with culture.
Tuberculosis, pulmonary; Sputum/microscopy; Bacteriological techniques; Treatment outcome; Evaluation study
10.3969/j.issn.1000-6621.2016.09.009
102206 北京,中国疾病预防控制中心结核病预防控制中心 国家结核病参比实验室(夏辉、赵雁林);黑龙江省结核病预防控制中心参比实验室(陈丽、李发滨);浙江省疾病预防控制中心结核病预防控制所参比实验室(柳正卫、王晓萌)
赵雁林,Email:zhaoyanlin@chinatb.org
2016-07-14)
基金名称:“十二五”国家科技重大专项(2014ZX10003002)
