多层面验证共培养微环境诱导法诱导骨髓间充质干细胞心肌样分化
2016-05-12何林静邓伏雪胡云凤朱卫文伍家燕
何林静, 邓伏雪, 胡云凤, 朱卫文, 伍家燕, 常 静
(重庆医科大学附属第一医院心血管内科, 重庆 400016)
研究论文
多层面验证共培养微环境诱导法诱导骨髓间充质干细胞心肌样分化
何林静,邓伏雪,胡云凤,朱卫文,伍家燕,常静*
(重庆医科大学附属第一医院心血管内科, 重庆 400016)
摘要:为了多层面探讨共培养微环境诱导法定向诱导骨髓间充质干细胞(MSCs)心肌样分化的可行性,取第3代MSCs与原代心肌细胞(CMs)进行共培养。在显微镜下观察诱导1周后的MSCs形态学变化,用免疫荧光和实时荧光定量聚合酶链式反应(RT-PCR)分别检测诱导的MSCs中心肌肌钙蛋白I(cTnI)、α-肌动蛋白(α-actin)、Nkx-2.5和GATA-4的基因表达变化情况。采用超高效液相色谱-串联质谱(UPLC-MS/MS)分别检测诱导组和对照组的代谢产物。诱导1周后的MSCs形态呈心肌样改变,cTnI、α-actin、Nkx-2.5和GATA-4的基因表达均明显升高,正交偏最小二乘法判别分析(OPLS-DA)模型显示诱导的MSCs代谢物向CMs转变趋势明显。通过多元和单元统计分析筛选差异变量,根据一级质谱和二级质谱比对结果,最终确定12种差异代谢物。与未经诱导的MSCs相比,经诱导的MSCs与CMs中变化趋势相同的差异代谢物有7种,变化趋势不同的差异代谢物有5种。实验结果表明,无论从形态、基因、蛋白质还是代谢层面看,MSCs通过与CMs间接接触共培养后均发生了心肌样改变,但是与CMs仍存在差异。
关键词:共培养微环境;代谢组学;心肌样分化;骨髓间充质干细胞;心肌细胞
心血管疾病严重威胁着人类的生命健康[1,2],心力衰竭是心血管疾病的终末阶段表现,其主要病理变化是心肌细胞(cardiomyocytes, CMs)数量减少。成熟CMs的再生能力有限,心肌组织中干细胞数量极少,而心脏移植又存在供体有限及排斥反应等问题,因此细胞移植成了一种有望治愈心力衰竭的新方法[3,4]。骨髓间充质干细胞(bone marrow mesenchymal stem cells, MSCs)具备强大的自我更新能力和多向分化潜能[5],因此成为干细胞移植中比较理想的种子细胞[6]。诱导MSCs向心肌方向分化的方法包括化学物质(如5-氮胞苷)诱导法及与心肌细胞共培养法,其中前者存在转化率低及致癌等问题[7,8]。本实验在体外将MSCs与CMs进行间接共培养,一定程度上模拟了细胞移植到心肌组织后的体内微环境,研究通过该方法诱导MSCs向心肌方向分化的可行性。
作为判定MSCs诱导分化为心肌样细胞的检测方法,如免疫荧光和实时荧光定量聚合酶链式反应(RT-PCR)等已经得到普遍应用[9-11],并初步揭示了共培养微环境诱导MSCs心肌样分化的机制。多种心肌细胞表面标志物的表达检测是鉴定MSCs心肌样分化的重要前提,然而仅靠鉴定个别细胞表面抗原表达手段单一,缺乏有效性和可靠性,并且诱导后的MSCs是否与CMs生物表型完全一致尚不能肯定。代谢组学是继基因组学和蛋白质组学之后又一门新兴的系统生物学科。近年来,随着代谢组学技术的发展,其临床及科研应用日益增多。与传统研究技术相比,代谢组学技术具有敏感、快速以及不偏倚的特点。其检测平台主要有核磁共振(NMR)、液相色谱(LC)、气相色谱(GC)等[12]。超高效液相色谱-串联质谱(UPLC-MS/MS)是一种新的代谢组学分析技术,它对代谢表达差异性检测更为敏感,稳定性更好[13]。如果能找出相关的差异代谢产物或代谢通路,可为MSCs心肌样分化中的分子生物学机制提供理论基础。
本实验以大鼠MSCs与新生乳鼠CMs间接共培养模拟心肌内环境,研究心肌微环境对体外诱导MSCs定向分化的影响,分别从形态、基因、蛋白质及代谢角度探索MSCs的微环境诱导法的可行性。
1实验部分
1.1实验动物、试剂及仪器
4~6周成年SD(sprague dawley)大鼠1只,雌雄不限,体重200~250 g; 1~3天新生SD乳鼠8只(重庆医科大学实验动物中心)。
DMEM/F12(dulbecco’s modified eagle medium/nutrient mixture F-12)培养基、胎牛血清、成骨细胞诱导培养液、成软骨细胞诱导剂、成脂细胞诱导培养液、茜素红S、Alcian Blue(阿辛蓝)染色液、油红O工作液(美国Gibco公司);磷酸盐缓冲溶液(PBS)(中国武汉博士德生物工程有限公司);胶原酶(美国Sigma公司);异硫氰酸荧光素(FITC)标记的CD(cluster of differentiation)11b、CD 29、CD 44和CD 45(美国Biolegend公司); FITC标记的山羊抗兔免疫球蛋白G(IgG)(中国北京中杉金桥生物技术有限公司);心肌特异性肌钙蛋白I(cTnI)抗体、α-肌动蛋白(α-actin)抗体(英国Abcam公司); transwell小室(美国Corning公司); RNAiso Plus试剂、逆转录试剂盒、SYBR Green Supermix(日本Takara公司);乙腈(纯度99.8%,美国TEDIA公司);甲酸(纯度99.9%,美国Sigma-Aldrich公司);甲醇(纯度99.9%,中国成都科龙化工试剂厂);二氯甲烷(纯度99.5%,中国重庆川东化工有限公司)。
倒置相差显微镜(日本Olympus公司);流式细胞仪(FCM,美国BD公司); CO2恒温培养箱(美国Thermo公司);核酸浓度测定仪(美国Quawell公司);定量PCR仪(美国Bio-Rad公司);LC-20 AD超高效液相色谱仪(日本岛津公司);Triple TOF 5600质谱仪(美国AB SCIEX公司);KinetexXB-C18 色谱柱 (100 mm×2.1 mm, 2.6 μm,美国菲罗门公司); OA-SYS氮吹仪(美国Organomation公司)。
1.2MSCs的培养及鉴定
1.2.1MSCs的培养
采用全骨髓贴壁法培养MSCs。用颈椎脱臼法处死4~6周成年SD大鼠,取双侧股骨、胫骨,去除软组织,剪去长骨两头,暴露骨髓腔,用完全培养基(DMEM/F12培养基和胎牛血清按体积比9∶1混合)冲洗骨髓腔,将冲洗液中的细胞以2×106个细胞/cm2的密度接种于25 cm2培养瓶中,置于37 ℃ 5%CO2的培养箱中孵育。2周后待细胞密度接近80%融合时,以细胞数目1∶2的比例进行传代。
1.2.2MSCs表面标志物检测
取第3代MSCs,用2.5 g/L(0.25%(w/v))的胰酶充分消化,以1 000 r/min的转速离心5 min,用100 μL PBS重悬,计数,使每管细胞数不小于1×106个,加入带荧光标记的单克隆抗体CD 11b、CD 29、CD 44和CD 45,置于冰盒中避光孵育40 min,用流式细胞仪进行检测分析[14]。
1.2.3MSCs体外诱导分化能力鉴定
待24孔培养板内第3代贴壁MSCs生长至细胞密度约为70%时,在试验孔中加入成骨细胞诱导培养液诱导25天,用10 g/L(1%(w/v))的茜素红S染色。取1×106个细胞放入离心管,加入成软骨细胞诱导剂,于离心管中培养21天。诱导后的细胞经固定后再染色,用10 g/L(1%(w/v))的Alcian Blue染色液染色。于试验孔中加入成脂细胞诱导培养液诱导21天,用油红O工作液染色。于显微镜下观察并拍照。
1.3CMs的培养及鉴定
取1~3天新生SD乳鼠,手术摘取心脏,去除心底结缔组织和心房,将心室剪成1 mm3组织碎块。加入质量体积分数为1 g/L(0.1%(w/v))的胶原酶于37 ℃消化5 min,反复消化4次。终止消化,用200目不锈钢滤网过滤,以1 000 r/min的转速离心5 min,弃上清液,重悬接种于6孔板中,于37 ℃、5%CO2的培养箱中培养。60 min后,通过差速贴壁法分离成纤维细胞和心肌细胞,将细胞悬液转移至新6孔板培养,培养7天后用于免疫荧光鉴定。
1.4实验分组
建立共培养体系,同时设置对照组。阳性对照组为单独培养的原代CMs,阴性对照组为单独培养的第3代MSCs。共培养诱导组:取第3代MSCs接种于6孔板中,次日在transwell小室内加入5倍细胞数目的CMs,将小室插入6孔板内。48 h后换液,观察1周至实验结束。
1.5鉴定MSCs心肌样分化
1.5.1免疫荧光
取诱导组和阴性对照组的MSCs,去除细胞培养基,用甲醇于-20 ℃固定10 min。于室温加入50 μL正常非免疫山羊血清(用PBS按体积比1∶10稀释)封闭30 min。吸除封闭血清并加入50 μL一抗(用PBS按体积比1∶50稀释的抗cTnI抗体),于4 ℃湿盒中孵育过夜。次日室温放置1 h,用PBS清洗,加入50 μL二抗(用PBS按体积比1∶50稀释的FITC标记的山羊抗兔IgG),室温孵育2 h。4′,6-二脒基-2-苯基吲哚(DAPI)室温染色5 min,加抗荧光淬灭封片剂,荧光显微镜下观察。
按上述方法进行α-actin免疫荧光染色并观察。
1.5.2RT-PCR
采用RNAiso Plus试剂提取诱导组和对照组的细胞总RNA,测定光密度值(OD),计算总RNA浓度。使用逆转录试剂盒将样品逆转录为cDNA,再经定量PCR仪扩增。
PCR引物如下。Nkx-2.5: (F)5′-CAGTGGAGCTGGACAAAGCC-3′,(R)5′-TAGCGACGGTTCTGGAACCA-3′; GATA-4: (F)5′-CTGTCATCTCACTATGGGCA-3′,(R)5′-CCAAGTCCGAGCAGGAATTT-3′; Actin: (F)5′-ACGGTCAGGTCATCACTATCG-3′,(R)5′-GGCATAGAGGTCTTTACGGATG-3′。
PCR反应体系为:2.5 μL 10×buffer(缓冲液), 2.0 μL 25 mmol/L Mg2+, 0.5 μL 10 mmol/L dNTP(脱氧核糖核苷三磷酸), 1.0 μL上游引物,1.0 μL下游引物,2.0 μL cDNA(互补脱氧核糖核苷酸), 0.5 μL 5 U/μL的Taq酶,15.5 μL去离子水。
反应参数为:94 ℃预变性4 min, 94 ℃变性40 s, 60~62 ℃退火40 s, 72 ℃延伸60 s。经分析系统进行相关基因表达的定量检测。
1.5.3UPLC-MS/MS
样品预处理[15]:用细胞计数法收集等量诱导组和对照组细胞,用PBS重悬,超声破碎。加入400 μL乙醇-乙酸乙酯(1∶1, v/v),以3 000 r/min的转速离心5 min,收集上清液,加入200 μL甲醇,混匀,以3 000 r/min的转速离心5 min,收集上清液。加入200 μL甲醇-水(3∶1, v/v),混匀,以3 000 r/min的转速离心5 min,收集上清液。加入200 μL二氯甲烷-甲醇(3∶1, v/v),混匀。全程在冰上操作。每组吸出1 mL上清液,置于氮吹仪中常温吹干,用100 μL的甲醇-水(4∶1, v/v)复溶,振荡2 min,超声10 min,以12 000 r/min的转速离心10 min,吸出60 μL的溶液用于进样。
样品分析[15]:每组吸取1 μL进样,用UPLC-MS/MS进行分析,每组重复6次。阳离子模式和阴离子模式中均使用Turbo V ESI离子源,从Triple TOF MS流出的样品以流速为0.35 mL/min的速度注入Kinetex XB-C18柱。毛细管电压:5.5 kV;雾化气体压力:1 379 Pa;涡旋气体压力:250.7 Pa;电离电压:5 500 V(ESI+)或-5 500 V(ESI-);离子源温度:500 ℃;碰撞能量:10 V(ESI+)或-10 V(ESI-);去簇电压:80 V(ESI+)或-80 V(ESI-)。流动相A:水;流动相B:乙腈。流动相梯度:0~1.0 min, 1%B; 1.0~12.0 min, 1%~85%B; 12.0~12.1 min, 85%~5%B; 12.1~15.0 min, 5%B。雾化气体和涡旋气体的压力均为379.225 kPa,加热温度为600 ℃。在增强全扫描模式中使用电喷雾电离进行全扫描分析。扫描范围为m/z50~1 000,扫描速率为1 000次/min。
1.6统计学处理
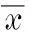
代谢组学数据处理使用机器自带软件MarkerView 1.2.1对所提取的数据进行峰检测、峰对齐、pareto(帕累托)缩放以及标准化。其中对缺失值使用80%去值原则,去除缺失值过多的变量,将得到的数据导入SIMCA-P 13.0对其进行正交偏最小二乘法判别分析(OPLS-DA)。将OPLS-DA分析中变量权重性投影(VIP)值大于1的变量导出,用SPSS 17.0进行非参数检验,将P<0.05的变量保留下来。再将得到的变量导入Shortcut to Peak View,导出二级质谱并在Massbank、HMDB数据库中比对二级质谱,找到可能的对应物质。
2结果与讨论
2.1MSCs的培养及鉴定
2.1.1MSCs的形态学观察及表面标志物鉴定
MSCs接种后为单个细胞,呈圆形,未伸展。24 h后瓶底出现贴壁细胞,呈长梭形,成纤维细胞样,散布于瓶底,换液去除造血细胞。4~5天后,细胞开始迅速增殖,体积变大,形成多个细胞集落,呈旋涡状、火山口状或放射状排列。2周后细胞集落逐渐增大,相互融合连接,待密度达到80%时即可传代。传代培养的MSCs表达CD 29和CD 44,阳性率分别为99.88%和99.99%,而CD 11b和CD 45表达呈阴性。
2.1.2体外诱导的MSCs具有多项分化能力
如图1所示,MSCs经成骨方向诱导25天后,用茜素红S染色可见红色矿化结节;经成软骨方向诱导21天后,用Alcian Blue染色,可见蛋白多糖呈蓝色;经成脂方向诱导21天后,用油红O染色,可见胞质中橙红色圆形或类圆形脂肪滴。

图 1 体外诱导的骨髓间充质干细胞(MSCs)的多项分化能力(100×)Fig. 1 Multilineage differentiation of induced bone marrow mesenchymal stem cells (MSCs) in vitro (100×) a. osteogenic differentiation; b. chondrogenic differentiation; c. adipogenic differentiation.
2.2CMs的培养及鉴定
采用60 min差速贴壁法[16]可得到纯度为95%的CMs。贴壁4~6 h后,细胞伸出伪足变成菱形或多角形。20 h后,可见单个细胞的搏动,频率不等(40~120次/min); 3~4天后,细胞伸出的原生质突起互相接触交织呈网状,形成同步性搏动的细胞单层,频率为80次/min左右,持续约30天后逐渐消失。免疫荧光结果显示95%以上的细胞为cTnI及α-actin阳性(见图2)。
2.3共培养的MSCs形态学观察与免疫荧光检测
MSCs与CMs体外间接共培养1周后,MSCs胞体变大,伸出伪足,呈扁平多角形并相互连接,连接细胞出现肌管样结构。经免疫荧光检测(见图3),可见诱导组的MSCs胞质中出现绿色(cTnI)和红色(α-actin)荧光,cTnI及α-actin表达呈阳性,胞核呈蓝色。而单独培养的阴性对照组MSCs呈长梭形,细胞增殖较快,大量子代细胞形成,免疫荧光检测未见cTnI及α-actin的表达。

图 2 心肌细胞(CMs)的免疫荧光图(100×)Fig. 2 Immunofluorescence images of cardiomyocytes (CMs) (100×) a. expression of cTnI (green) in CMs; b. expression of α-actin (red) in CMs. Blue: nucleus stained by DAPI.
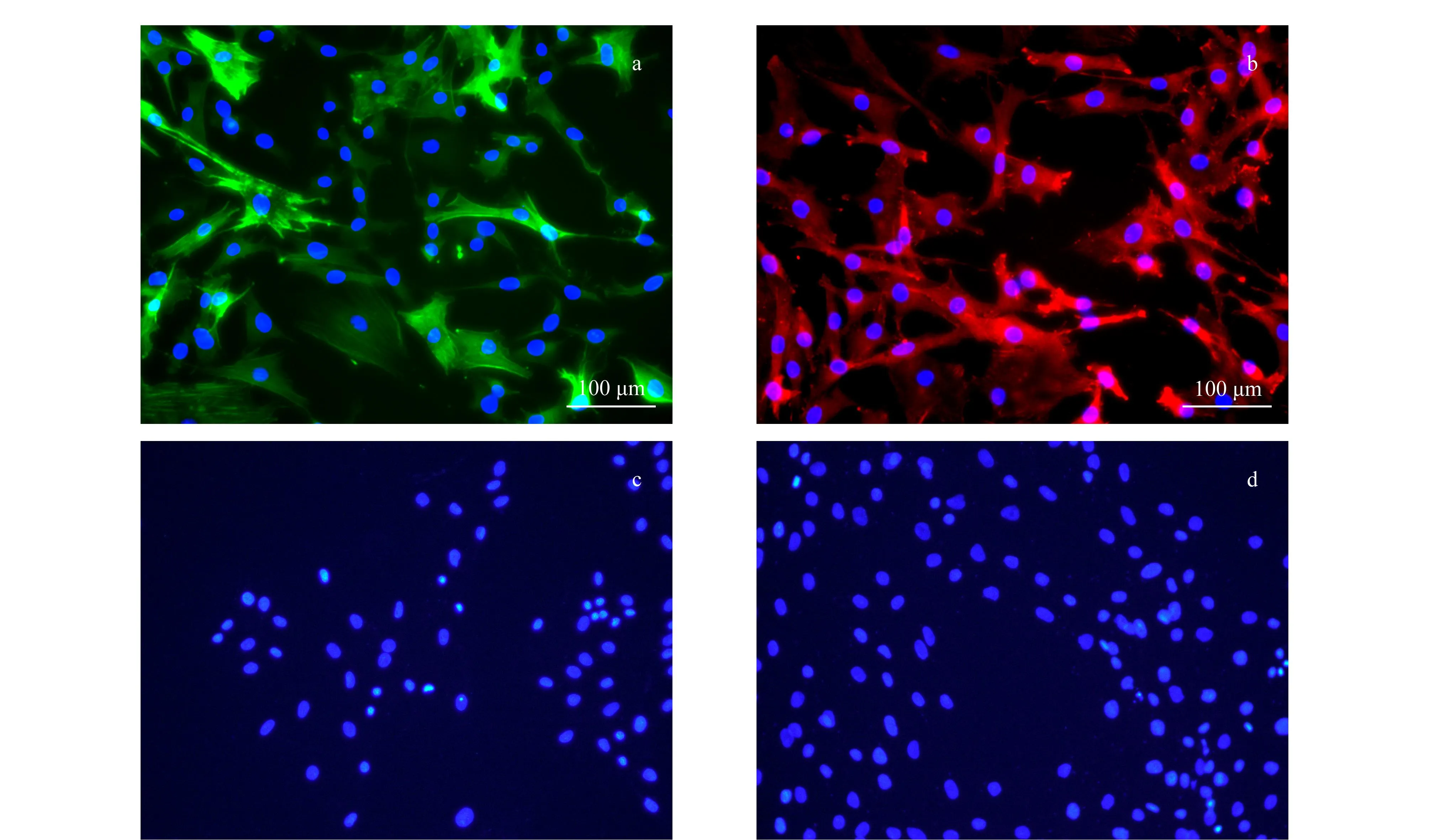
图 3 MSCs与CMs共培养前后心肌特异性标记物的免疫荧光图(100×)Fig. 3 Immunofluorescence images of muscle-specific markers in MSCs co-cultured with or without CMs (100×) a. positive immunofluorescence against cTnI (green) in MSCs co-cultured with CMs; b. positive immunofluorescence against α-actin (red) in MSCs co-cultured with CMs; c. negative immunofluorescence against cTnI in MSCs cultured without CMs; d. negative immunofluorescence against α-actin in MSCs cultured without CMs. Blue: the nucleus stained by DAPI.
近几年的研究[17]表明,利用transwell小室建立间接共培养体外微环境可诱导MSCs向心肌样细胞分化。α-actin主要存在于肌细胞胞质中,是骨骼肌与心肌特异性表达的具有收缩功能的细胞骨架蛋白,为胎儿或新生儿心室肌的主要成分,α-actin阳性说明MSCs发生了肌源性分化[9]。cTnI是心肌细胞中特异性表达的结构蛋白,在参与调控肌纤维的舒缩活动中发挥重要作用,cTnI阳性表明诱导后的MSCs有心肌细胞特征[9]。
2.4RT-PCR检测结果
以Actin为内参,进行统计学分析,当P<0.05时,基因表达差异显著。如图4所示,阳性对照组CMs中Nkx-2.5和GATA-4的mRNA呈高表达;阴性对照组MSCs中Nkx-2.5和GATA-4的mRNA呈低表达;共培养诱导1周后,诱导组MSCs中Nkx-2.5和GATA-4的mRNA表达增强。
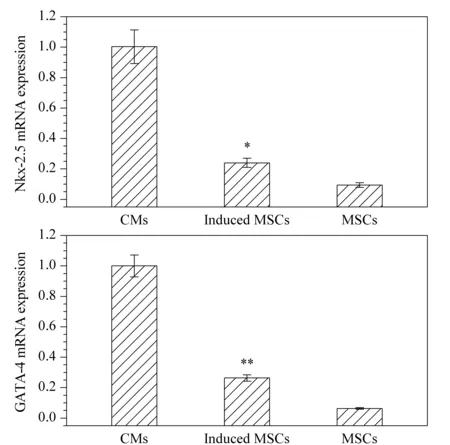
图 4 RT-PCR检测经诱导的MSCs中转录因子Nkx-2.5 和GATA-4的基因表达情况Fig. 4 Gene expressions of the transcription factors (Nkx-2.5 and GATA-4) in induced MSCs by RT-PCR * P<0.05, ** P<0.01.
Nkx-2.5与GATA-4是目前研究较多的与心脏发育密切相关的早期转录因子[10,11]。Nkx-2.5在心肌开始分化前即开始表达,持续表达于心肌细胞分化阶段,随后在胚胎、胎儿和成体心肌细胞中保持一定的表达水平。GATA-4是调节心脏基因表达的重要转录因子,参与了心脏正常发育、功能基因表达和心肌肥大的病理过程,是心脏前体细胞最早的标志物之一。Nkx-2.5与GATA-4的表达表明MSCs经共培养微环境诱导后向心脏前体细胞进行分化。
2.5基于UPLC-MS/MS的细胞代谢组学分析
相比于基因组学和蛋白质组学,代谢组学具有下列优势:1.由于基因或蛋白质的微小变化将会在代谢产物上得到放大,所以利用代谢组学使得结果更容易检测;2.由于代谢产物的种类相比基因和蛋白质的数目要小很多,所以其检测种类少;3.由于代谢物在各种生物机体内都是类似的,所以代谢产物具有通用性的特点。UPLC-MS/MS是一种新的代谢组学检测技术,具有分辨率高、敏感性高、快捷、方便等优点[18,19]。因此,本文用UPLC-MS/MS对诱导细胞的代谢物进行检测,采用多元和单元统计进行分析,以期找到CMs及MSCs在诱导前后代谢产物的不同,筛选出差异代谢产物和与之相关的差异代谢通路。
图 5 经诱导的MSCs代谢物的OPLS-DA得分图Fig. 5 OPLS-DA score plot of the metabolites of the induced MSCs
利用OPLS-DA方法去除与样品分类无关的信息,对诱导组及对照组细胞代谢全谱进行分析。图5是UPLC-MS/MS检查的细胞代谢物全谱数据的OPLS-DA分类图,该模型包含3个主成分:1为阴性对照组的MSCs, 2为阳性对照组的CMs, 3为诱导组的MSCs。模型参数R2X=0.72及Q2=0.56说明模型的解释能力和预测能力较强,其中X代表在横坐标的解释能力(单位为cum),R2代表模型中相应主成分对整体变异的解释能力,Q2表示主成分对模型变异的预测能力。一般来说,R2X和Q2均大于0.5才能说明模型构建成功。图5显示对照组与诱导组样本能明显区分,经诱导分化1周后的第3组样本向第2组样本靠近而远离第1组样本,说明诱导的MSCs代谢变化有逐渐向阳性对照组的CMs转化的趋势。这从代谢角度表明了共培养诱导后MSCs的代谢向心肌细胞的代谢改变。
VIP值是OPLS-DA模型有监督性分析方法中评价变量贡献的最常用方法。本文设定VIP>1和P<0.05(差异具有统计学意义),在HMDB和MassBank数据库中分别比对一级质谱和二级质谱,最终推定其变量可能对应的物质。与阴性对照组的MSCs相比,诱导组的MSCs和阳性对照组CMs的差异代谢物中变化趋势相同的物质有L-谷氨酰胺、L-酪氨酸、PC(18∶1(9Z)/14∶0)(聚碳酸酯)、LysoPE(22∶6 (4Z,7Z,10Z,13Z,16Z,19Z)/0∶0)(溶血性聚乙烯)、deterrol stearate(硬酸酯)、pyrrolidonecarboxylic acid(吡咯烷酮羧酸)、AS 1-2(鞘糖脂);诱导组的MSCs和阳性对照组CMs的差异代谢物中变化趋势不同的物质有甘氨酸苄酯、DHAP(18∶0) (磷酸二羟丙酮)、LysoPC(16∶0)(溶血性磷脂酰胆碱)、LysoPC(20∶4(5Z,8Z,11Z,14Z))、尿苷(见表1)。
心脏为高耗能器官,为保证其能够持续进行有节律的搏动,需要源源不断的能量供给。谷氨酰胺是代谢旺盛细胞重要的能源物质,对维持细胞正常的能量代谢具有重要意义。心肌细胞中存在大量的谷氨酰胺酶,在其催化下谷氨酰胺通过脱氨基反应生成谷氨酸,后者在谷氨酸脱氢酶的作用下氧化脱羧,生成α-酮戊二酸进入三羧酸循环氧化供能。近年来的研究[20,21]表明,在缺血再灌注损伤后,谷氨酰胺能促进心肌组织糖原重新合成,调节心肌细胞内碳水化合物代谢,促进ATP合成,增加细胞生物能量储备,同时促进谷胱甘肽和金属硫蛋白合成,减少自由基生成,减轻心肌细胞脂质过氧化损害,维护细胞正常的能量代谢。也有研究证明谷氨酰胺可通过己糖胺合成途径避免心脏缺血再灌注损伤,并且对冠心病病人的心脏有保护作用[22]。因此,经诱导的MSCs中升高的谷氨酰胺提示MSCs已发生心肌样分化。
生理条件下,不同于其他器官(如肝脏和脑)可利用循环中的多种物质作为其能量来源(如葡萄糖、脂肪酸、氨基酸、酮体等),心脏心肌细胞60%~70%的ATP由脂肪酸的β-氧化提供,以维持心脏生理性收缩活动所需的大量能量[23]。筛选出的差异代谢物中有相当一部分为脂类,尤其是磷脂类物质,如LysoPC(16∶0)、LysoPC(20∶4(5Z,8Z,11Z,14Z))、PC(18∶1(9Z)/14∶0)、LysoPE(22∶6(4Z,7Z,10Z,13Z,16Z,19Z)/0∶0)、deterrol stearate等。作为磷脂类物质重要分支的甘油磷脂类物质除构成生物膜外,还是胆汁和膜表面活性物质等的成分之一,参与细胞膜对蛋白质的识别和信号传导。在本研究中发现多种LysoPC在CMs和经诱导的MSCs中的含量与诱导前的MSCs相比呈上调趋势,这可能与磷脂酸类物质引起外钙内流的钙离子动员效应、参与心肌细胞膜的构成有关,同时也是心肌收缩力的标志[24,25]。
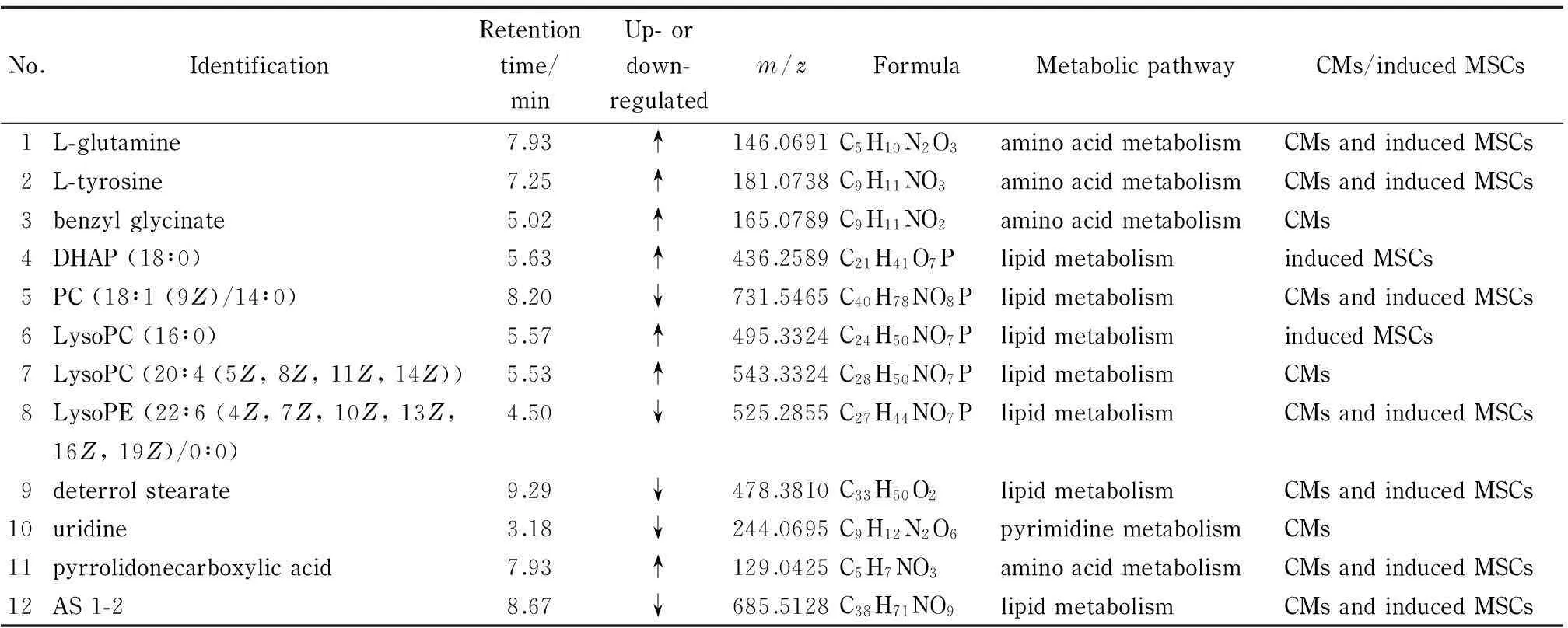
表 1 CMs、经诱导的MSCs和MSCs相比的差异代谢物
↑: up-regulated; ↓: down-regulated.
3结论
综上所述,本实验通过体外间接共培养,一定程度上模拟了体内心肌内环境,从细胞的形态变化、免疫荧光、基因表达及代谢组学层面证实共培养微环境能够在体外诱导MSCs定向分化为心肌样细胞,且分化的细胞具有心肌细胞的特性,但是其代谢表型仍存在一定差异。这为进一步的动物实验和临床应用提供了实验依据和理论基础。本研究未进行诱导细胞电生理及起搏基因等检测,故未能了解其具体功能变化,如膜电位变化和If(Na+内流)电流等,有待于进一步深入研究。
参考文献:
[1]Moran A E, Forouzanfar M H, Roth G A, et al. Circulation, 2014, 129(14): 1493
[2]Cherubini A, Palomba A, Morosin M, et al. G Ital Cardiol (Rome), 2015, 16(4): 240
[3]Tanaka M, Taketomi K, Yonemitsu Y. Curr Gene Ther, 2014, 14(4): 300
[4]Cao Y. Chem Immunol Allergy, 2014, 99: 170
[5]Adegani F J, Langroudi L, Arefian E, et al. Mol Biol Rep, 2013, 40(5): 3693
[6]Choi S H, Jung S Y, Kwon S M, et al. Circ J, 2012, 76(6): 1307
[7]Ling S K, Wang R, Dai Z Q, et al. Biotechnol Prog, 2011, 27(2): 473
[8]Elnakish M T, Kuppusamy P, Khan M. J Pathol, 2013, 229(2): 347
[9]Sun Q G, Zhao W J, Wang R Z, et al. Chinese Journal of Laboratory Diagnosis, 2012, 16(12): 2202
孙庆国, 赵文静, 王日中, 等. 中国实验诊断学, 2012, 16(12): 2202
[10]Jiang C K, Gong F. Chinese Journal of Biochemistry and Molecular Biology, 2015, 31(4): 408
蒋昌科, 龚放. 中国生物化学与分子生物学报, 2015, 31(4): 408
[11]Den Hartogh S C, Schreurs C, Monshouwer-Kloots J J, et al. Stem Cells, 2015, 33(1): 56
[12]Shi D D, Kuang Y Y, Wang G M, et al. Chinese Journal of Chromatography, 2014, 32(3): 278
史栋栋, 况媛媛, 王桂明, 等. 色谱, 2014, 32(3): 278
[13]Li T. Chinese Journal of Chromatography, 2015, 33(10): 1017
李彤. 色谱, 2015, 33(10): 1017
[14]Nery A A, Nascimento I C, Glaser T, et al. Cytometry A, 2013, 83(1): 48
[15]Huang L, Dai Y F, Wang P Y, et al. Chinese Journal of Chromatography, 2015, 33(10): 1097
黄鹂, 戴意飞, 王萍亚, 等. 色谱, 2015, 33(10): 1097
[16]Meng Y H, Li Y X, Yu H Q, et al. Chinese Journal of Integrative Medicine on Cardio-/Cerebrovascular Disease, 2014,12(1) : 78
孟云辉, 李永新, 于慧卿, 等. 中西医结合心脑血管病杂志, 2014, 12(1): 78
[17]Luo Y, Sun G B, Qin M, et al. China Journal of Chinese Materia Medica, 2012, 37(22): 3345
罗云, 孙桂波, 秦蒙, 等. 中国中药杂志, 2012, 37(22): 3345
[18]Zhu W X, Yang J Z, Yuan P, et al. Chinese Journal of Chromatography, 2013, 31(10): 934
祝伟霞, 杨冀州, 袁萍, 等. 色谱, 2013, 31(10): 934
[19]Kong H W, Dai W D, Xu G W. Chinese Journal of Chromatography, 2014, 32(10): 1052
孔宏伟, 戴伟东, 许国旺. 色谱, 2014, 32(10): 1052
[20]Zhang Y, Yan H, Lv S G, et al. Int J Clin Exp Pathol, 2013, 6(5): 821
[21]Badole S L, Jangam G B, Chaudhari S M, et al. PLoS One, 2014, 9(3): e92697
[22]Li K, Cui Y C, Zhang H, et al. Chinese Circulation Journal, 2015, 30(z1): 22
李凯, 崔永春, 张宏, 等. 中国循环杂志, 2015, 30(z1): 22
[23]Harasim E, Stepek T, Konstantynowicz-Nowicka K, et al. Cell Physiol Biochem, 2015, 37(3): 1147
[24]van Brocklyn J R, Williams J B. Comp Biochem Physiol B Biochem Mol Biol, 2012, 163(1): 26
[25]Zhang L, Gao J, Zhang F M, et al. Chinese Journal of Laboratory Medicine, 2013, 36(11): 1022
张立, 高洁, 张凤美, 等. 中华检验医学杂志, 2013, 36(11): 1022
Feasibility of cardiac differentiation of bone marrow mesenchymal stem cells induced by co-culture indirectly with cardiomyocytes in several dimensions
HE Linjing, DENG Fuxue, HU Yunfeng, ZHU Weiwen, WU Jiayan, CHANG Jing*
(Department of Cardiology, the First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China)
Abstract:The objective of this research is to investigate the feasibility of cardiac differentiation of bone marrow mesenchymal stem cells (MSCs) by co-culture with cardiomyocytes (CMs) in vitro. The third generation of MSCs from bone marrow and CMs were co-cultured indirectly in a transwell. One week later, the expressions of muscle-specific markers (cardiac troponin I and α-actin) by immunofluorescence staining and the gene expressions of transcription factors (Nkx-2.5 and GATA-4) were measured by real-time polymerase chain reaction (RT-PCR). Then, orthogonal partial least squares discriminant analysis (OPLS-DA) models were employed to confirm the difference among MSCs, induced MSCs and CMs by ultra-performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) analysis. The distinctive changes were identified by multivariate analysis and variate analysis, and the changed metabolites were identified by MS and MS/MS. One week after co-cultured with CMs indirectly, the specific myocardium morphology of MSCs was observed under microscope. The positive immunofluorescence stainings against cTnI and α-actin were detected, and the positive expressions of the transcription factors Nkx-2.5 and GATA-4 were measured by RT-PCR. In OPLS-DA mode, obvious trend of cardiac differentiation of MSCs can be seen, and seven metabolites were tested both in induced MSCs and CMs, but five metabolites were tested in induced MSCs or CMs. Cardiac differentiation of MSCs can be induced by co-cultured with CMs indirectly in vitro. However, metabolism difference still existed between induced MSCs and CMs.
Key words:co-culture microenvironment; metabonomics; myocardium-like differentiation; bone marrow mesenchymal stem cells (MSCs); cardiomyocytes (CMs)
中图分类号:O658
文献标识码:A
文章编号:1000-8713(2016)04-0414-08
基金项目:国家临床重点专科建设项目(2011170).
*收稿日期:2016-01-06
DOI:10.3724/SP.J.1123.2016.01006
*通讯联系人.Tel:(023)89011590,E-mail:chang8753@163.com.
Foundation item: National Key Clinical Specialties Construction Program of China (No. 2011170).
