2型糖尿病大鼠肝脏组织中Toll样受体4和NF-κB表达变化及意义
2016-05-12韩荣凤江霞天津市第一中心医院天津300192
韩荣凤,江霞(天津市第一中心医院,天津 300192)
2型糖尿病大鼠肝脏组织中Toll样受体4和NF-κB表达变化及意义
韩荣凤,江霞(天津市第一中心医院,天津 300192)
摘要:目的观察2型糖尿病大鼠肝脏组织中Toll样受体4(TLR4)和NF-κB的表达变化,并探讨其意义。方法 将清洁级SD大鼠随机分为正常对照组(NC组)、胰岛素抵抗组(IR组)、糖尿病4周组(DM4周组)和糖尿病8周组(DM8周组),动物处死前股动脉取血,测定空腹胰岛素(FINS)、空腹血糖(FPG)、糖化血清蛋白(GSP)、血脂等生化指标。应用RT-PCR法检测大鼠肝脏组织中TLR4 mRNA表达,免疫组化法测定肝脏组织中NF-κB蛋白表达。结果大鼠血清ALT、AST和肝脏TLR4 mRNA及NF-κB蛋白表达于NC组、IR组、DM4周组、DM8周组依次递增,DM4周组和DM8周组的FPG、TG、TC、GSP高于NC组和IR组,与NC组比较,其他3组的FINS、LDL-C均高于NC组,而HDL-C均低于NC组,差异有统计学意义(P<0.05)。TLR4 mRNA与NF-κB蛋白表达、ALT、AST水平均呈正相关(r分别为0.706、0.974、0.950,P均<0.01);NF-κB蛋白表达与ALT、AST水平呈正相关(r分别为0.657、0.646,P均<0.01)。结论 2型糖尿病大鼠肝脏组织中TLR4 mRNA与NF-κB蛋白表达随病情的进展而逐渐增加,TLR4/NF-κB信号通路介导炎症反应在2型糖尿病发生、发展及肝脏组织的脂肪变性中可能起重要作用。
关键词:2型糖尿病;Toll样受体4;核因子-κB;肝脏;大鼠
Toll样受体4(TLR4)是内毒素(LPS)的关键受体,为联系固有免疫和适应性免疫的纽带。TLR4主要表达于髓源性细胞,其启动的胞内信号转导在肝损伤发生、发展过程中发挥重要作用。NF-κB是广泛存在于哺乳动物细胞中的一种重要转录调控因子,能与多种细胞基因的启动子和增强子序列位点发生特异性结合,通过调控多种重要的细胞因子、黏附分子和趋化因子的表达,在机体免疫应答、炎症反应及细胞生长调控等方面发挥作用。2013年3月~2014年6月,我们通过建立2型糖尿病(T2DM)大鼠模型,动态观察TLR4和NF-κB在肝组织中的表达情况,探讨其意义。
1材料与方法
1.1材料清洁级近交系雄性SD大鼠 (购买及饲养于中国医学科学院放射研究所动物实验中心),体质量240~270 g。普通饲料及高脂高糖乳剂(脂肪乳):动物实验中心提供。链脲佐菌素(STZ)购自美国Sigma公司。通用RT-PCR试剂盒购自北京博大泰克生物基因技术有限责任公司。兔抗鼠NF-κB单克隆抗体、即用型第二代免疫组化SP广谱试剂盒、DAB试剂盒购自天津灏阳生物工程有限公司。
1.2动物模型的建立与分组将大鼠适应性饲养5 d,随机分为正常对照组(NC组)10只及造模组30只,NC组普通饲料喂养并给予蒸馏水灌胃,造模组普通饲料喂养并予脂肪乳灌胃,8周末处死NC组8只,造模组中随机处死8只作为IR组。造模组其余22只按30 mg/kg体质量尾静脉注射小剂量STZ诱导2型糖尿病模型,3 d后,血糖测定结果>16.7 mmol/L为造模成功。造模成功大鼠再随机分成糖尿病4周组(DM 4周组)和糖尿病8周组(DM 8周组)继续分别维持普通饲料喂养并脂肪乳灌胃4周和8周后处死大鼠各8只。
1.3各组生化指标的测定用罗氏血糖仪每周检测血糖1次;处死大鼠前股动脉取血,用全自动生化分析仪测定空腹血糖(FPG)、TG、TC、LDL-C、HDL-C、ALT、AST,采用比色法测定糖化血清蛋白(GSP),采用液相平衡竞争放射免疫分析法测定血清胰岛素(FINS)。
1.4大鼠肝脏组织TLR4 mRNA、NF-κB蛋白表达测定大鼠处死后立即打开腹腔,新鲜无菌分离大鼠的肝脏组织块,部分置于DEPC水处理过的冻存管中,投入液氮内保存备用,部分置于10%的中性甲醛中。①TLR4 mRNA:采用RT-PCR法。取大鼠肝脏组织按试剂操作说明书提取总RNA,反转录合成cDNA,PCR扩增TLR4基因片段。PCR反应条件:预变性94 ℃ 5min,变性94 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 30 s,35个循环,最后72 ℃延续延伸10 min;TLR4上游引物为5′-AGAATGAGGACTGGGTGA-3′;TLR4下游引物为5′-TTGTATCGCCTTCT- TAGC-3′,扩增产物323 bp。β-actin为内参照,β-actin上游引物为5′-CACCCGC-GAGTACAACCTTC-3′;下游引物为5′-CCCATACCCACCATCACACC-3′,扩增产物232 bp,行琼脂糖凝胶电泳,应用VDS凝胶影像分析系统进行吸光度扫描,计算TLR4/β-actin值。②NF-κB蛋白:大鼠肝脏组织于10%甲醛固定液中固定24 h以上,经逐级脱水、透明、浸蜡行常规石蜡包埋,4 μm厚连续石蜡切片,50~60 ℃烤箱烘干,进行HE染色。免疫组化:取石蜡切片,常规脱蜡、水化,抗原修复,3%H2O2孵育,血清封闭,PBS冲洗,滴加1∶100稀释的NF-κB p65抗体,4 ℃过夜,PBS冲洗,滴加生物素化二抗,37 ℃孵育10 min,PBS冲洗;滴加辣根过氧化物酶标记的链卵白素,37 ℃孵育15 min;DAB显色,苏木素复染,中性树脂封片。免疫组化用北航CM-2000B型生物医学图像分析系统作半定量分析,每张标本按顺序选5个视野,用平均光密度表示阳性物质的相对含量。
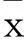
2结果
2.1各组生化指标水平比较NC组、IR组、DM4周组、DM8周组大鼠的ALT、AST依次递增,差异有统计学意义(P均<0.05)。DM4周组和DM8周组的FPG、TG、TC、GSP高于NC组和IR组(P<0.05)。与NC组比较,其他3组的FINS、LDL-C均高于NC组,而HDL-C均低于NC组,差异有统计学意义(P均<0.05),见表1、2。

表1 各组血清ALT、AST、GSP、FPG及FINS水平比较
注:与NC组相比,*P<0.05;与IR组相比,#P<0.05;与DM4周组相比,&P<0.05。
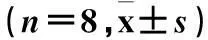
表2 各组血脂水平比较
注:与NC组相比,*P<0.05;与IR组相比,#P<0.05;与DM4周组相比,&P<0.05。
2.2肝脏组织病理学变化HE染色显示NC组大鼠肝细胞呈单核多层状,肝细胞索以肝小叶中央静脉为中心呈放射样排列,IR组大鼠肝细胞肿胀,胞质疏松,肝小叶内可见少量肝细胞小泡性脂肪变;DM4周组大鼠肝小叶结构存在,边界尚清,肝细胞中到重度脂肪变性,伴轻度炎症浸润,肝小叶内坏死灶明显增多;DM8周组大鼠肝组织小叶结构欠清,肝细胞重度脂肪变,散在点片状或灶状坏死及轻到重度炎症,部分大鼠出现小叶内大片坏死及桥接坏死,伴纤维化。
2.3肝脏组织中NF-κB蛋白及TLR4 mRNA表达变化NC组少数肝脏细胞可见弱NF-κB蛋白表达,DM组肝脏组织可见大量NF-κB蛋白强表达。NC组、IR组、DM4周组、DM8周组肝脏组织中NF-κB蛋白、TLR4 mRNA表达依次递增。见表3。
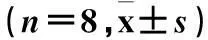
表3 各组TLR4 mRNA、NF-κB蛋白表达比较
注:与NC组相比,*P<0.05;与IR组相比,#P<0.05;与DM4周组相比,&P<0.05。
2.4TLR4 mRNA、NF-κB蛋白与生化指标的相关性分析TLR4 mRNA与NF-κB蛋白表达、ALT、AST均呈正相关(r分别为0.706、0.974、0.950,P均<0.01);NF-κB蛋白表达与ALT、AST呈正相关(r分别为0.657、0.646,P均<0.01)。
3讨论
糖尿病是一种常见的代谢性内分泌疾病,发病率、病死率、致残率均较高,其中2型糖尿病比例较高。胰岛素抵抗(IR)和胰岛素分泌不足是2型糖尿病发病的两个关键因素,但其机制尚未阐明。近年来炎症学说备受关注,认为2型糖尿病是一先天性免疫和低度慢性炎症性疾病[1~3]。
Toll样受体(TLRs)是炎症信号传递的门户蛋白,是连接天然免疫和获得性免疫系统的重要桥梁,在免疫防御反应中起重要作用。迄今为止,在哺乳动物中已发现13个TLR成员。其中,TLR4是第一个被发现的哺乳动物TLRs,亦是该家族中目前研究最为详尽的成员,其主要表达于淋巴样组织、外周血白细胞、树突状细胞及T、B淋巴细胞上。TLR4的基本功能是信号的跨膜转导,其可通过广泛而特异地识别病原体相关的分子模式,偶联信号转导通路,激活天然免疫细胞和炎症细胞,最终导致一系列的免疫炎症反应[4]。2型糖尿病常缺乏直接病原微生物的侵入,故炎症反应的激活机制目前尚未明了。研究显示TLR4除可识别病原微生物外尚可识别内源性配体[5],提示TLR4可参与非病原体侵入性组织损伤时免疫炎症反应的激活。与肥胖有关的炎性反应是2型糖尿病的致病因子之一。体外实验中脂多糖和游离脂肪酸可增加3T3-L1脂肪细胞中TLR4的表达,并通过NK-κB信号途径使炎性反应因子TNF-α和IL-6表达增强,进一步产生IR[6]。另有研究表明,TLR4介导的炎症反应可能在2型糖尿病患者β细胞功能障碍中发挥重要作用[7]。本实验发现,随着糖尿病的发展,大鼠肝脏组织中TLR4 mRNA表达上调,肝脏组织脂肪变性和炎症反应逐渐加重。有研究显示,在TLR4基因突变小鼠中,TLR4活性降低可减轻白色脂肪组织中炎性反应和葡萄糖的转运,脂联素和相关脂肪生成的标记蛋白减少,使棕色脂肪组织中解耦联蛋白-1表达减少,最终使肝脏中甘油三酯的含量减少,延缓肝细胞的脂肪变性[8]。
NF-κB是1986年Singh等[9]从B淋巴细胞、浆细胞核中检测到的一种能与免疫球蛋白κ轻链基因增强子10 bpDNA序列特异性结合的蛋白质,NF-κB目前被认为是应激反应尤其是炎症过程的关键调控因子。NF-κB信号途径在TLR4介导的免疫调节中起重要作用[10]。NF-κB过度活化一方面可使炎性反应相关基因表达异常,激活炎性反应与组织损伤;另一方面可通过组织损伤暴露出的大量内源性TLR4配体而诱导TLR4的进一步表达与活化。有研究表明,TLR4/NF-κB信号途径有可能作为桥梁将天然免疫、脂肪代谢、IR等联系起来[11,12]。本实验结果显示,随着2型糖尿病的发生及发展,大鼠肝脏组织中的NF-κB阳性着色逐渐加重,表达逐渐增强,且与TLR4的表达呈正相关,结合肝脏的病理及肝酶均提示肝脏损伤随病程的发展而逐渐加重,由此表明,TLR4/NF-κB通路在2型糖尿病肝脏损伤起重要作用。
综上所述,2型糖尿病大鼠肝脏组织中TLR4 mRNA与NF-κB蛋白表达随病情进展而逐渐升高,TLR4/NF-κB信号通路介导炎症反应在2型糖尿病发生、发展及肝脏组织的脂肪变性中可能起重要作用,阻断该通路能否延缓糖尿病及其并发症的发展有待进一步研究证实。
参考文献:
[1] Klebanova EM, Balabolkin MI, Kreminskaia VM. The role of the fat tissue and its hormones in the mechanisms of insulin resistance and the development of type 2 diabetes mellitus[J]. Klinicheskaia Meditsina (Mosk), 2007,85(7):20-27.
[2] Bahceci M, Gokalp D, Bahceci S, et al. The correlation between adiposity and adiponectin, tumor necrosis factor alpha, interleukin-6 and high sensitivity C-reactive protein levels. Is adipocyte size associated with inflammation in adults[J]. J Endocrinol Invest, 2007,30(3):210-214.
[3] Kolb H, Mandrup-Poulsen T. An immune origin of type 2 diabetes[J]. Diabetologia, 2005,48(8):1038-1050.
[4] Kim F, Pham M, Luttrell I, et al. Toll-like receptor-4 mediates vascular inflammation and insulin resistance in diet-induced obesity[J]. Circulation Research, 2007,100(11):1589-1596.
[5] Feterowski C, Emmanuilidis K, Miethke T, et al. Effects of functional Toll-like receptor-4 mutations on the immune response to human and experimental sepsis[J]. Immunology, 2003,109(3):426-431.
[6] Song MJ, Kim KH, Yoon JM, et al. Activation of Toll-like receptor 4 is associated with insulin resistance in adipocytes[J]. Biochemical & Biophysical Research Communications, 2006,346(3):739-745.
[7] Ladefoged M, Buschard K, Hansen AMK. Increased expression of toll-like receptor 4 and inflammatory cytokines, interleukin-6 in particular, in islets from a mouse model of obesity and type 2 diabetes[J]. Apmis, 2012,121(6):531-538.
[8] Poggi M, Bastelica D, Gual P, et al. C3H/HeJ mice carrying a toll-like receptor 4 mutation are protected against the development of insulin resistance in white adipose tissue in response to a high-fat diet[J]. Diabetologia, 2007,50(6):1267-1276.
[9] Singh H, Sen R, Baltimore D, et al. A nuclear factor that binds to a conserved sequence motif in transcriptional control elements of immunoglobulin genes[J]. Nature, 1986,319(6049):154-158.
[10] Akira S, Takeda K. Toll-like receptor signaling[J]. Nature Reviews Immunology, 2004,4(40):499-511.
[11] Raveendran VV, Tan X, Sweeney ME, et al. Lipopolysaccharide induces H1 receptor expression and enhances histamine responsiveness in human coronary artery endothelial cells[J]. Immunology, 2011,132(4):578-588.
[12] Ji Y, Wang Z, Li Z, et al. Modulation of LPS-mediated inflammation by fenofibrate via the TRIF-dependent TLR4 signaling pathway in vascular smooth muscle cells[J]. Cell Physiol Biochem, 2010,25(6):631-640.
(收稿日期:2015-09-26)
中图分类号:R587.1
文献标志码:A
文章编号:1002-266X(2016)13-0027-03
doi:10.3969/j.issn.1002-266X.2016.13.010
