金乌贼幼体捕食行为及捕食能力的研究*
2016-05-12雷舒涵张秀梅张沛东覃乐政
雷舒涵, 张秀梅, 张沛东, 覃乐政
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
金乌贼幼体捕食行为及捕食能力的研究*
雷舒涵, 张秀梅**, 张沛东, 覃乐政
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
摘要:实验室条件下,观察并记录胴背长为8.2~22.9 mm的金乌贼(Sepia esculenta)幼体的捕食行为,通过分析不同的捕食行为指标研究金乌贼幼体的捕食能力。研究发现,金乌贼幼体对糠虾的捕食行为分为攻击和摄食两部分,其中攻击行为分为发现、定位和捕捉3个阶段。金乌贼幼体捕食成功率较高,胴背长大于10 mm的幼体捕食成功率大于80%。捕食发生次数(FT)、攻击距离(AD)、最大攻击距离(MAD)和总捕食时间(TFT)与胴背长(DML)均呈二次多项式关系,分别为:FT=0.107DML2-0.170DML+3.157,AD=-0.030DML2-1.641DML+3.150,MAD=-0.067DML2+3.226DML-2.682,TFT=-7.947DML2+404.9DML-1079;总捕食量(TFA)与胴背长呈指数关系(TFA=5.254e(0.133 DML));食饵操纵时间(HT)与胴背长呈幂函数关系(HT=1587DML(-0.91))。捕食发生次数、攻击距离、最大攻击距离、总捕食时间和总捕食量随生长而增大,食饵操纵时间随生长而减少,表明金乌贼幼体随生长捕食能力迅速增强。本研究结果丰富了头足类行为生态学理论知识。
关键词:金乌贼; 幼体; 捕食行为; 捕食能力
引用格式:雷舒涵,张秀梅,张沛东,等. 金乌贼幼体捕食行为及捕食能力的研究[J].中国海洋大学学报(自然科学版),2016, 46(4): 37-42.
LEI Shu-Han, ZHANG Xiu-Mei, ZHANG Pei-Dong, et al. Studies on the feeding behavior and ability of juvenileSepiaesculenta(Cephalopoda: Sepiida) [J].Periodical of Ocean University of China, 2016, 46(4):37-42.
金乌贼(Sepiaesculenta)属软体动物门(Mollusca)头足纲(Cephalopoda)鞘亚纲(Coleoidea)乌贼目(Sepiida)乌贼科(Sepiidae)乌贼属(Sepia),是中国沿海重要经济头足类。主要分布在俄罗斯远东海海域,日本本州、四国、九州海域,朝鲜半岛西海岸、南海岸,中国沿海及菲律宾群岛海域[1-2]。金乌贼生命周期短,世代更替快,生长迅速,肉质鲜美,蛋白质含量高,是一种具有较高经济价值的优良种类[3]。
由于金乌贼特殊的生态习性和较高的经济价值,国内外学者在生理、行为、资源增殖等方面展开了相关研究[4-7]。关于行为生态学方面,国外学者研究较多,主要集中于繁殖行为[8-9],而对捕食行为的研究仅见郝振林[3]关于不同底质、光照度、视角对金乌贼捕食行为影响的报道。金乌贼幼体阶段是一个快速生长和高死亡率的发育阶段[10],幼体的捕食能力对其早期生长和存活具有重要影响[11]。本文在实验室条件下,观察了胴背长8.2~22.9mm金乌贼幼体的捕食行为,探讨了金乌贼幼体早期发育阶段的捕食能力,以期为头足类的早期培育和人工养殖提供科学依据。
1材料与方法
1.1 实验材料
实验用金乌贼受精卵于2010年6月取自山东黄岛金乌贼繁殖基地。受精卵运至中国海洋大学鱼类行为生态实验室后置于4个35cm×25cm×30cm玻璃水槽(养殖水体15 L)中孵化,孵化水温22~24℃,盐度32±0.5,pH7.8~8.6,连续充氧,日换水量为1/2。孵出后,幼体培育条件与孵化条件相同。0~5日龄幼体投喂卤虫(Artemiaurmiana)无节幼体和活体糠虾(Neomysisawatschensis),5~30日龄投喂活体糠虾,从30日龄开始投喂全长为3~4cm的日本沼虾(Macrobrachiumnipponense)和麦穗鱼(Pseudorasboraparva),每天投饵2次(09:00和18:00),每次投饵充足。
1.2 实验方法
实验对象为胴背长(Dorsal mantle length,DML)8.2~22.9mm的20尾(10~50日龄)金乌贼幼体。为保证饵料的一致性和可比性,捕食实验中统一使用糠虾。实验前将实验个体饥饿1 d,随机选取一尾幼体移入60cm×30cm×40cm玻璃水槽(养殖水体50L)中,水槽中糠虾密度为50ind/L,糠虾全长为(8.4 ± 1.1)mm。幼体的捕食行为用挂在水槽正上方的Sony HDR-XR550E摄像机记录。摄影从幼体第一次捕食开始,随捕食糠虾数量的增加,幼体对糠虾的食饵操纵时间会逐渐延长,当食饵操纵时间延长至10min时(幼体进入饱食状态),摄影停止。利用该段视频资料,统计分析每只幼体在总捕食时间段内捕食发生次数、捕食成功率、攻击距离、最大攻击距离、总捕食量、食饵操纵时间和总捕食时间等指标。捕食实验结束后立即称取幼体体质量(Body weight,BW)。
1.3 数据分析
利用MoveTr2D和ImageJ软件分析捕食录像,计算各捕食能力指标,如下:
总捕食时间(Total feeding time,TFT):视频资料中,幼体乌贼开始捕食至捕食最后一只糠虾所用时间。
捕食发生次数(Feeding times,FT):总捕食时间段内幼体完成捕食反应的总次数。
捕食成功率(Successful feeding rate,SFR):总捕食时间段内幼体成功捕食糠虾的次数与捕食发生次数的比例。
攻击距离(Attacking distance,AD):幼体发现饵料并定位后,捕食糠虾的平均距离。
最大攻击距离(Maximum of attacking distance,MAD):幼体发现饵料并定位后,捕食糠虾的最大距离。
总捕食量(Total feeding amount,TFA):幼体乌贼捕食糠虾的总质量(湿重),计量方法采用估算法,由于同一批糠虾的个体质量相差不大,用精密电子天平(Sartorius)称取100尾糠虾的体质量后,估算出每一尾糠虾的平均体质量,再乘以幼体乌贼捕食糠虾的总个数即为总捕食量。
食饵操纵时间(Handling time,HT):幼体袭击、捕捉并撕咬饵料生物的耗时以及开始重新搜寻饵料的停留时间的和。
最优食物供给量(Optimal food supply,OFS):总捕食量占乌贼幼体体质量的百分比。
2结果
2.1 捕食行为的观察
金乌贼对糠虾的捕食行为分为攻击和摄食两个部分,而攻击又主要分为3个阶段:发现、定位和捕捉(见图1)。
发现(Attention,见图1a,1b):当糠虾进入到幼体的视野内,即刻发生一系列的行为反应:幼体眼睛随着糠虾位置发生转动,腕、头、胴体的颜色加深;头和胴体转向糠虾方向,第一对腕竖直向上延伸,左右摆动。发现的过程通常时间很短,一般小于1 s。
定位(Positioning,见图1b):当乌贼面向糠虾后,或原地不动,或按着食饵—身体轴线的方向前进或者后退。当距糠虾较远时,乌贼会前进以便接近糠虾;当距糠虾较近时,乌贼则会向后游泳,与糠虾保持一定距离。这个距离被称为攻击距离(Attacking distance),攻击距离并不恒定。
捕捉(Seizure,见图1c):当乌贼调整好攻击距离后,第一对腕对着食物的方向部分展开并持续几秒钟,随后持续左右摆动。腕、头部、胴体表面颜色变化迅速,似黑色波浪闪动,此时,鳍波动的速率加快,犹如悬浮在水中。随后乌贼突然跃起迅速伸出触腕捕食糠虾,从触腕伸出到捕到糠虾用时仅为30 ms。捕到食物后,幼体胴体呈现斑块状花纹。
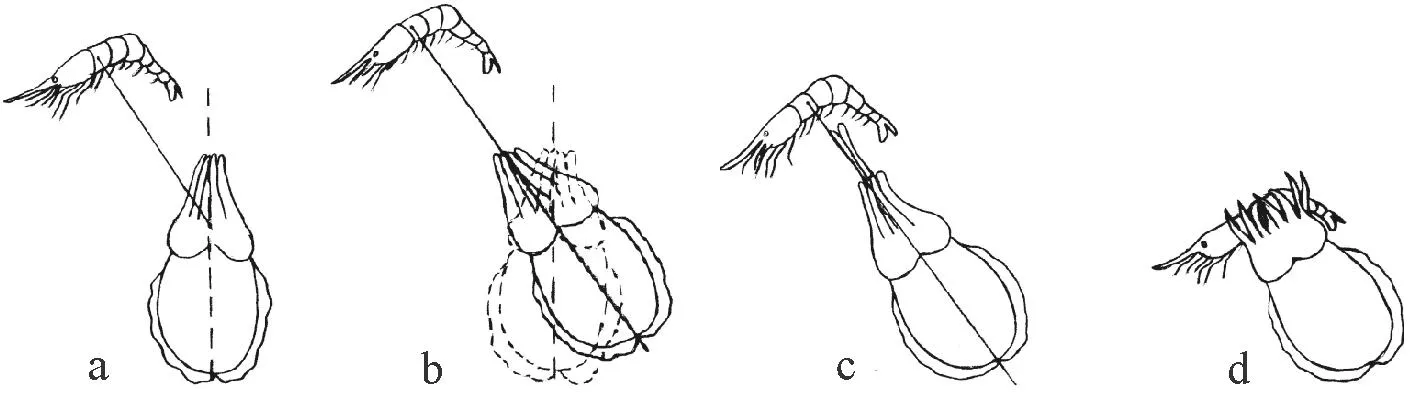
(a: 糠虾进入乌贼视野范围; b: 头和身体转向糠虾的方向; c: 乌贼伸出触腕捕食糠虾; d; 乌贼用喙撕咬,并食掉全部糠虾。a: The shrimp swum into cuttlefish’s field of vision; b: The head-body axis turned to the shrimp; c: Tentacles ejected quickly to prey on the shrimp; d: The cuttlefish ate the whole shrimp by the beaks.)
图1金乌贼捕食行为示意图
Fig.1Sketch of the feeding behavior of golden cuttlefishSepiaesculenta
摄食(Eating,见图1d):当金乌贼捕到食物后,触腕收回到触腕腔中,其他腕迅速抱住食物,用喙撕咬,并食掉全部糠虾,水槽中未见头胸甲残余。
2.2 捕食能力
2.2.1 捕食发生次数及捕食成功率分析录像得出,DML为8.2mm的金乌贼幼体在观测时间内共发生捕食行为9次,而DML为21.8mm的幼体发生捕食行为57次(见图2)。胴背长和捕食发生次数的关系可以用二次多项式函数表示:FT=0.107DML2-0.170DML+3.157(R2= 0.834)。DML为8.8mm的金乌贼幼体捕食成功率最低,为58.3%,而DML>10mm的幼体捕食成功率较高,均大于80%(见图3)。
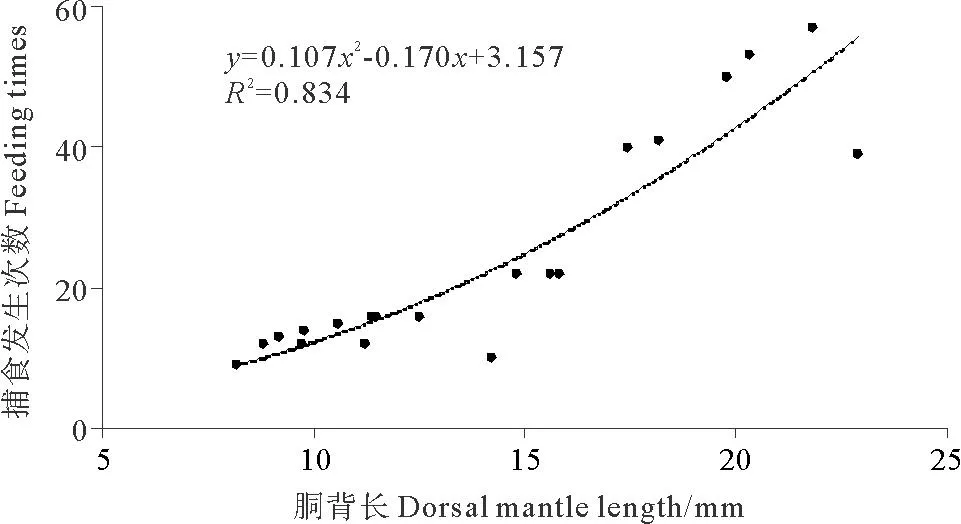
图2 金乌贼幼体捕食发生次数与胴背长的关系
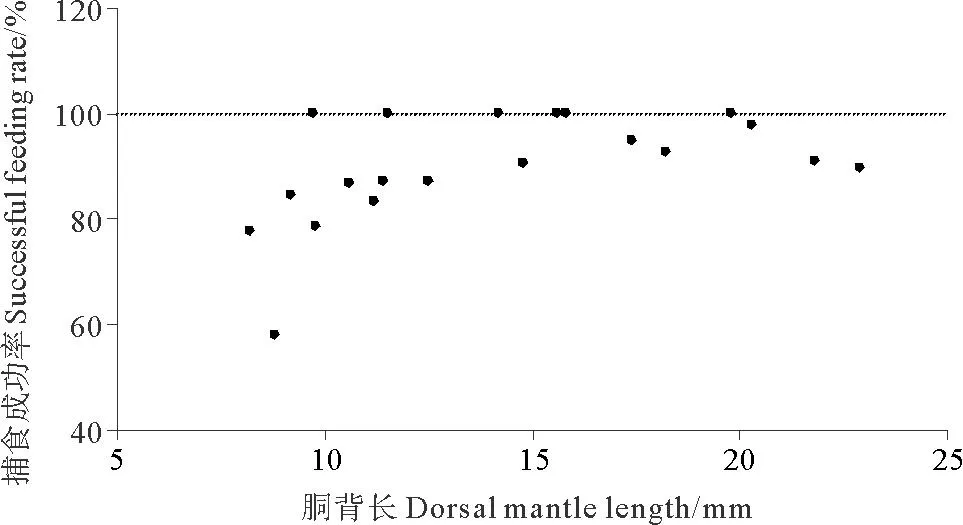
图3 金乌贼幼体的捕食成功率
2.2.2 攻击距离金乌贼幼体的攻击距离随着胴背长的生长而发生变化,攻击距离为胴背长的1~2倍,且胴背长和攻击距离的关系可以用二次多项式函数表示:AD=-0.030DML2-1.641DML+3.150(R2=0.865)(见图4)。
金乌贼幼体的最大攻击距离为胴背长的1.5~3倍(见图4)。胴背长和最大攻击距离的关系可以用二次多项式函数表示:MAD=-0.067DML2+3.226DML-2.682(R2=0.879)。
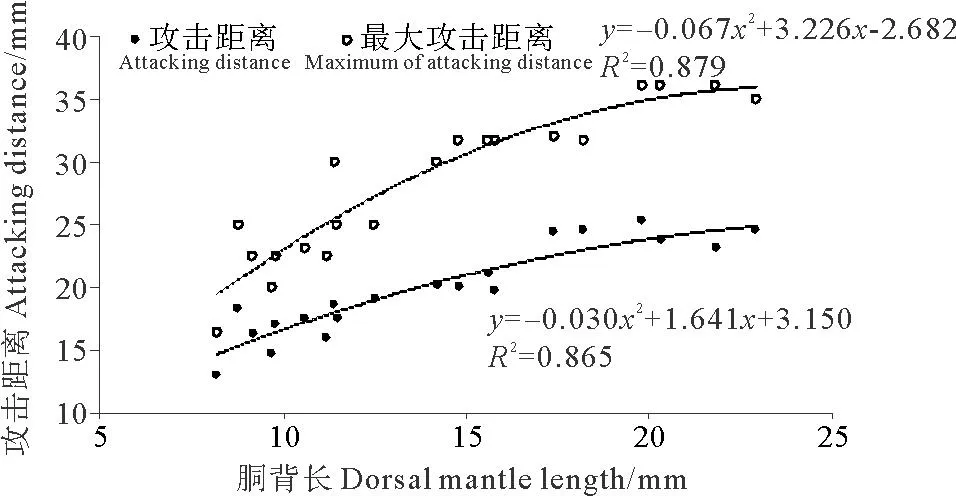
图4 金乌贼幼体攻击距离与胴背长的关系
2.2.3 总捕食量在一次捕食全过程中,DML为8.2mm的金乌贼幼体捕食糠虾的总湿重为13.27mg,而DML为21.8mm的幼体捕食糠虾的总湿重为98.54mg(见图5)。胴背长和总捕食量的关系可以用指数函数表示:TFA=5.254e0.133 DML(R2=0.861)。
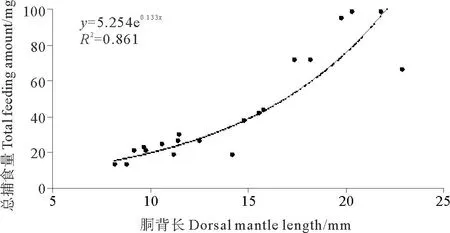
图5 金乌贼幼体总捕食量与胴背长的关系
金乌贼幼体总捕食量与体质量的关系如图6所示,其关系可以用多项式函数表示:TFA=-0.0085BW2+0.0705BW+0.0019(R2=0.972)。

图6 金乌贼幼体总捕食量与体质量的关系
2.2.4 食饵操纵时间及总捕食时间金乌贼幼体食饵操纵时间随着胴背长的增大有减小的趋势(见图7), DML为8.2mm幼体的食饵操纵时间最长,为265s,而DML为21.8mm个体的食饵操纵时间最短,为75s。胴背长和食饵操纵时间的关系可以用幂函数表示:HT=1587DML-0.91(R2=0.629)。
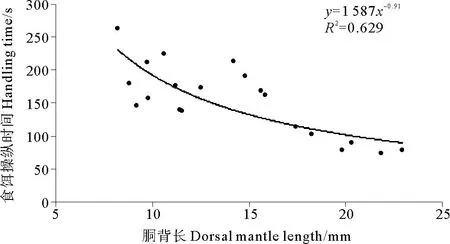
图7 金乌贼幼体食饵操纵时间与胴背长的关系
金乌贼幼体总捕食时间随着胴背长的增大有增加的趋势(见图8)。DML为9.2mm个体的总捕食时间最短,为1768s;捕食时间最长(4712s)的个体胴背长为20.3mm。胴背长和总捕食时间的关系可以用二次多项式函数表示:TFT=-7.947DML2+404.9DML-1079(R2=0.569)。

图8 金乌贼幼体总捕食时间与胴背长的关系
2.2.5 最优食物供给量金乌贼幼体最优食物供给量随着体质量的增大有减小的趋势(见图9),体质量为0.20g个体的最优食物供给量最高,为金乌贼幼体体质量的11.19%;体质量为1.79g个体的最优食物供给量最低,为金乌贼幼体体质量的5.49%。最优食物供给量和体质量的关系可以用对数函数表示:OFS = -1.487ln (BW)+6.1108(R2=0.479)。

图9 金乌贼幼体最优食物供给量与体质量的关系
3讨论
乌贼类的捕食行为较为相似,Messerger[12]和Kasugai[13]分别研究了欧洲乌贼(Sepiaofficinalis)和微鳍乌贼(Idiosepiusparadoxus)的捕食行为,发现攻击行为均分为发现、定位和捕捉3个阶段。但是Kasugai[13]发现微鳍乌贼的摄食行为比较特殊,它捕到食物后将口球(Buccal mass)伸入到甲壳动物的外壳中,口球可以伸长到与第一对腕相同的长度,并可以伸向任意方向,只食用软体组织,丢弃的外壳犹如刚刚蜕皮的完整外壳。而本实验中,由于糠虾个体较小,金乌贼将糠虾全部食掉,包括糠虾最硬的头胸甲。
本研究发现金乌贼幼体捕食成功率普遍较高,相同的结果在其它种类的乌贼中亦有报道。Duval等[14]在研究欧洲乌贼的捕食行为中发现,白色水槽中欧洲乌贼捕食成功率为87.7%,在灰色的水槽中更高达91%。乌贼捕食成功率较高的原因可能有:(1)金乌贼具有发达的视觉系统。个体在孵化初期,眼已经发育完全,具有与成体相似的结构[15],因此它们可以准确地判断饵料生物的方向和距离。(2)金乌贼具有发达的触腕。触腕是金乌贼的捕食器官,触腕的顶端为触腕穗,具有10余行吸盘[2],吸盘可以紧紧吸住食物,防止饵料生物逃脱。(3)金乌贼具有快速的触腕发射能力,触腕的发射极为迅速(约为22ms),这一点在Messerger[12]的实验中也被证实:在水温为25℃的条件下,欧洲乌贼触腕从发射到捕捉到饵料生物的用时仅为15ms,如此之快的捕捉速度要归功于触腕高度发达的横纹肌的快速收缩[16]。
本研究发现,金乌贼个体捕食发生次数、总捕食量和总捕食时间随幼体生长而增加,表明个体随生长需要更多的食物来满足生长能量的需求(见图1、5、8)。目前研究最优食物供给量的计算方法为食物占生物体重的百分比[17-18]。Koueta and Boucaud-Camou[18]在实验室条件下研究欧洲乌贼幼体生长时发现,乌贼随生长发育所需要的最优食物供给量是随生长逐渐降低的。本研究中,将总捕食量换算为最优食物供给量后也得出相同的结论,虽然乌贼幼体捕食饵料增多,但随着生长体重逐渐增大,其相对捕食量有降低的趋势。本研究发现,金乌贼个体的攻击距离和最大攻击距离随着生长发育有增大的趋势,这不仅增加了金乌贼的有效捕食范围,还可以有效防止因距离过近可能会导致饵料生物对金乌贼产生躲避行为。然而Chen等[19]在研究乳光枪乌贼(Loligoopalescens)对桡足类的捕食行为中发现,与枪乌贼的发育阶段和攻击速度变化无明显相关,当攻击距离大于胴背长时,攻击行为极少成功,攻击距离并没有随生长而增大,反而最小攻击距离随生长减小。这可能是因为乳光枪乌贼的捕食方式异于金乌贼。当乳光枪乌贼发现食饵后,它会将头和身体转向食饵,张开腕并前跃抱住食饵[19]。这样的捕食方式导致远距离捕食成功率大大降低。而金乌贼捕食用触腕吸住食物后回缩,同时游向食物,用口腕抱住进行摄食,从而显著扩大了捕食范围。
随生长发育,金乌贼幼体的食饵操纵时间明显减少。食饵操纵时间为个体发现、捕捉和吞食饵料生物的时间以及开始重新搜寻饵料的停留时间的总和。随着幼体生长,视觉敏感度(Visual sensitivity)逐步提高[15],个体搜寻生物饵料的能力也逐步提升;与此同时,幼体的消化能力也得到增强[20],因此,食饵操纵时间随幼体生长逐渐缩短。除此之外,在真鲷(Pagrosomusmajor)仔鱼早期捕食能力的研究中也发现相同的结果[21],干重为50μg的仔鱼在捕食褶皱臂尾轮虫(Brachionusplicatilis)时的食饵操纵时间为0.90h/ind,而干重为100μg仔鱼的食饵操纵时间下降为0.04h/ind,并且饵料密度对食饵操纵时间的影响随着仔鱼个体的增大而逐渐减小。
综上所述,金乌贼幼体对糠虾的捕食行为分为攻击和摄食两个部分,其中攻击行为又主要分为发现、定位和捕捉3个阶段;金乌贼幼体捕食成功率较高,并且捕食能力随生长而增强。自然环境中的饵料密度较低,金乌贼幼体高效的捕食能力对其生长和存活具有重要的生物学意义。研究确定的金乌贼胴背长和总捕食量的关系曲线,为其幼体人工培育过程中的适量投饵,节约养殖成本、避免水质恶化和饵料浪费提供了重要参考依据。
参考文献:
[1]齐钟彦. 中国经济软体动物 [M]. 北京: 中国农业出版社, 1998: 293-294.
Qi Zhongyan. Economic mollusca of China [M]. Beijing: China Agriculture Press, 1998: 293-294.
[2]郑元甲, 陈雪忠, 程家骅, 等. 东海大陆架生物资源与环境 [M]. 上海: 上海科学技术出版社, 2003: 722-727.
Zheng Yuanjia, Chen Xuezhong, Cheng Jiahua, et al. The continental shelf, biological resources and the environment of east China sea [M]. Shanghai: Shanghai Science and Technology Press, 2003: 722-727.
[3]郝振林. 金乌贼的行为习性及标志技术的研究 [D]. 青岛: 中国海洋大学, 2007.
Hao Zhenlin. Studies on the behavior and marking technology ofSepiaesculenta[D]. Qingdao: Ocean University of China, 2007.
[4]Watanuki N, Kawamura G, Kaneuchi S, et al. Role of vision in behavior, visual field, and visual acuity of cuttlefishSepiaesculenta[J]. Fisheries Science, 2000, 66: 417-423.
[5]郝振林, 张秀梅, 张沛东. 金乌贼的生物学特性及增殖技术 [J]. 生态学杂志, 2007, 26(4): 601-606.
Hao Zhenlin, Zhang Xiumei, Zhang Peidong. Biological characteristics and multiplication techniques ofSepiaesculenta[J]. Chinese Journal of Ecology, 2007, 26(4): 601-606.
[6]雷舒涵, 吴常文, 高天翔, 等. 金乌贼和曼氏无针乌贼胚胎发育及其盐度耐受能力的比较研究[J]. 中国水产科学, 2011, 18(2): 350-359.
Lei Shuhan, Wu Changwen, Gao Tianxiang, et al. A comparative study ofSepiaesculentaandSepiellamaindronion embryonic development and ability of salinity tolerance [J]. Journal of Fishery Sciences of China, 2011, 18(2): 350-359.
[7]Lei S, Zhang X, Liu S, et al. Effects of temperature fluctuations on cuttlebone formation of cuttlefishSepiaesculenta[J]. Chinese Journal of Oceanology and Limnology, 2012, 30: 547-553.
[8]Fujita T, Hirayama I, Matsuoka T, et al. Spawning behavior and selection of spawning substrate by cuttlefishSepiaesculenta[J]. Nippon Suisan Gakkaishi, 1997, 63: 145-151.
[9]Wada T, Takegaki T, Mori T, et al. Sperm displacement behavior of the cuttlefishSepiaesculenta(Cephalopoda: Sepiidae) [J]. Journal of Ethology, 2005, 23: 85-92.
[10]陈四清, 刘长琳, 庄志猛, 等. 饵料、盐度对金乌贼幼体生长的影响 [J]. 渔业现代化, 2008, 35(6): 23-25.
Chen Siqing, Liu Changlin, Zhuang Zhimeng, et el. Effect of feeds and water salinity on growth of golden sepia (Sepiaesculenta) [J]. Fishery Modernization, 2008, 35(6): 23-25.
[11]范帆, 尹飞, 彭士明, 等. 饥饿胁迫对曼氏无针乌贼幼体的影响 [J]. 生态学杂志, 2011, 30(10): 2262-2268.
Fan Fan, Yin Fei, Peng Shiming, et al. Impacts of starvation on biochemical indices and behaviors ofSepiellamaindronijuveniles [J]. Chinese Journal of Ecology, 2011, 30(10): 2262-2268.
[12]Messenger J B. The visual attack of the cuttlefish,Sepiaofficinalis[J]. Animal Behaviour, 1968, 16: 342-357.
[13]Kasugai T. Feeding behaviour of the Japanese pygmy cuttlefishIdiosepiusparadoxus(Cephalopoda: Idiosepiidae) in captivity: evidence for external digestion [J]. Journal of the Marine Biological Association of the United Kingdom, 2001, 81: 979-981.
[14]Duval P, Chichery M P, Chichery R. Prey capture by the cuttlefish (SepiaofficinalisL): An experimental study of two strategies [J]. Behavioural Processes, 1984, 9: 13-21.
[15]Hao Z L, Zhang X M, Kudo H, et al. Development of the retina in cuttlefishSepiaesculenta[J]. Journal of Shellfish Research, 2010, 29(2): 463-470.
[16]Kier W M. Squid cross-striated muscle: the evolution of a specialized muscle fiber type [J]. Bulletin of Marine Science, 1991, 49: 389-403.
[17]Koueta N, Boucaud-Camou E. Food intake and growth in reared early juvenile cuttlefishSepiaofficinalisL. (Mollusca Cephalopoda) [J]. Journal of Experimental Marine Biology and Ecology, 1999, 240: 93-109.
[18]Koueta N, Boucaud-Camou E. Basic growth relations in experimental rearing of early juvenile cuttlefishSepiaofficinalisL. (Mollusca: Cephalopoda) [J]. Journal of Experimental Marine Biology and Ecology, 2001, 265: 75-87.
[19]Chen D S, Van Dykhuizen G, Hodge J, et al. Ontogeny of copepod predation in juvenile squid (Loligoopalescens) [J]. Biological Bulletin, 1996, 190: 69-81.
[20]Moguel C, Mascaró M, Avila-Poveda O H, et al. Morphological, physiological and behavioural changes during post-hatching development ofOctopusmaya(Mollusca: Cephalopoda) with special focus on the digestive system [J]. Aquatic Biology, 2010, 9:35-48.
[21]殷名称, 鲍宝龙, 苏锦祥. 真鲷仔鱼早期阶段的摄食能力——发育反应和功能反应 [J]. 海洋与湖沼, 1999, 30(6): 591-596.
Yin Mingcheng, Bao Baolong, Su Jinxiang. Feeding ability ofPagrosomusMajorlarvae during early edvelopment - ITS developmental and functional responses [J]. Oceanologia ET Limnologia Sinica, 1999, 30(6): 591-596.
责任编辑朱宝象
Studies on the Feeding Behavior and Ability of JuvenileSepiaesculenta(Cephalopoda: Sepiida)
LEI Shu-Han, ZHANG Xiu-Mei, ZHANG Pei-Dong, QIN Le-Zheng
(The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China)
Abstract:Cuttlefish is an active predator. Like all known coleoid cephalopods, it feeds on small crusta-ceans, fish, and shrimps. The feeding ability is vital for cuttlefish to grow and survive, especially for the newly hatched larvae. Aiming to gain the knowledge on the feeding ability of early developing cuttlefish, the feeding behavior of juvenile Sepia esculenta was observed under laboratory conditions. The mantle length of the experimental cuttlefish was 8.2~22.9 mm in length. The video camera was used to record the feeding behavior and the indicators of feeding ability. The feeding behavior on prawns consisted of two phases, namely attacking and eating. The sequence of attacking behavior comprised three phases, attention, positioning and seizure. The successful feeding rate of the juvenile cuttlefish with>10mm dorsal mantle length (DML) was relatively high, no less than 80%. The relationship between DML and feeding time (FT), attacking distance (AD), maximum of attacking distance (MAD), total feeding time (TFT) could be described with a quadratic model expressed as FT=0.107DML2-0.170DML+3.157; AD=-0.030DML2-1.641DML+3.150; MAD=-0.067DML2+3.226DML-2.682; and TFT=-7.947DML2+404.9DML-1079, respectively, while the relationship between DML and total feeding amount (TFA), handling time (HT) with an exponential model expressed as TFA=5.254e(0.133 DML) and HT=1587DML(-0.91), respectively. Feeding time, attacking distance, maximum of attacking distance, total feeding time and total feeding amount increased with the growth while handling time decreased with the growth. In conclusion, the successful feeding rate of juvenile cuttlefish was relatively high and the feeding ability rapidly increased with the growth. Because low prey density, high feeding rate and efficient feeding ability is extremely vital for cuttlefish to survive wild, the relationship between DML and TFA provides the evidence for suitable feeding. The results obtained in present study would enrich the knowledge of the ethology and ecology of cephalopods.
Key words:Sepia esculenta; juvenile; feeding behavior; feeding ability
DOI:10.16441/j.cnki.hdxb. 20130194
中图法分类号:S917.4
文献标志码:A
文章编号:1672-5174(2016)04-037-06
作者简介:雷舒涵(1987-), 女, 博士生, 研究方向:金乌贼资源增殖学研究。 E-mail: shuhanlei@163.com**通讯作者: E-mail: gaozhang@ouc.edu.cn
收稿日期:2014-11-06;
修订日期:2015-09-07
*基金项目:国家海洋公益性行业科研专项经费项目(201405010;201305043)资助
Supported by National Marine public welfare industry research special funds project (201405010;201305043)
